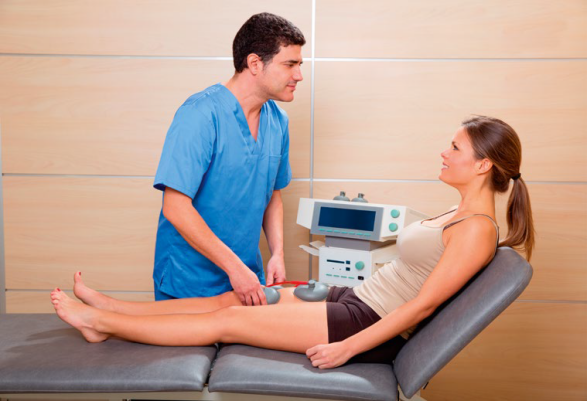
Użytecznym narzędziem w pracy fizjoterapeuty są różne metody fizykoterapii. Jedną z nich jest elektroterapia, czyli zastosowanie prądu elektrycznego w celach leczniczych. Bardzo ważną postacią elektroterapii jest zaś elektrostymulacja, czyli pobudzenie mięśni lub nerwów przy pomocy prądu elektrycznego. Główne obszary zastosowania elektrostymulacji w rehabilitacji to leczenie stanu zapalnego, poprawa funkcjonowania osłabionych mięśni, łagodzenie bólu i skurczów oraz wspomaganie gojenia się ran.
Korzenie elektrostymulacji sięgają starożytnej Grecji, gdzie przy pomocy potartego bursztynu lub drętwy (rażącej prądem ryby) wywoływano skurcze mięśni. Oczywiście dopiero odkrycia Volty i Faradaya, pozwalające na utworzenie źródeł energii poddających się ludzkiej kontroli, oraz badania neurofizjologiczne takich autorytetów jak Galvani i Duchenne, umożliwiły powstanie elektrostymulacji takiej, jaką znamy.
Elektrostymulacja neuromięśniowa
Elektrostymulacja neuromięśniowa, czyli NMES (neuromuscular electrical stimulation) to stymulacja stosowana w rehabilitacji ruchowej, podczas której bodziec elektryczny wywołuje skurcze sparaliżowanych mięśni, pod warunkiem, że zachowało się ich unerwienie. Dzięki elektrostymulacji neuromięśniowej osiągać można m.in. zwiększoną siłę mięśni, obniżać ich napięcie, wspomagać ruch.
Według kanadyjskiego przeglądu badań z 2017 r. istnieją dowody na skuteczność NMES w leczeniu niektórych problemów poudarowych w obrębie kończyn górnych i dolnych, słabości mięśni po rekonstrukcji więzadła krzyżowego przedniego i całkowitej endoprotezoplastyce stawu kolanowego, przy słabości mięśni w przebiegu choroby zwyrodnieniowej stawu kolanowego oraz przy osłabieniu po ciężkiej chorobie. Niepewne są natomiast korzyści odnośnie do leczenia zespołu bólu rzepkowo-udowego1.
Typy neuroprotez stosowanych jako urządzenia wspomagające przez osoby po udarze lub uszkodzeniu rdzenia kręgowego2 : a) neuroprotezy do stania – mogą aktywować mięśnie wokół stawu skokowego, co w połączeniu z pionizatorem lub ortezą obejmującą całe ciało pozwala pacjentowi na stanie, b) neuroprotezy do chodzenia – należą do nich urządzenia kompensujące opadanie stopy (wpływające na działanie stawu skokowego) i urządzenia ułatwiające chodzenie przy większej niepełnosprawności kończyny dolnej, c) neuroprotezy czynności kończyny górnej – dzielą się na urządzenia do chwytania oraz urządzenia do chwytania i sięgania po przedmioty, przydatne dla osób z większym poziomem niepełnosprawności.
Udar i uraz rdzenia kręgowego
Szczególnie ważnym w fizjoterapii podtypem NMES jest elektrostymulacja funkcjonalna (FES – functional electrical stimulation). Polega ona ona wspomaganiu celowych i funkcjonalnych ruchów pacjenta, co osiąga się poprzez elektrostymulację mięśni, które podczas skurczu powodują ruch wykorzystywany funkcjonalnie. Przy tym rodzaju stymulacji wybiera się te mięśnie i taką kolejność ich kurczenia się, by w efekcie otrzymać pożądany ruch. Urządzenie FES ułatwiające konkretny ruch nazywane jest często „neuroprotezą” lub, ściślej rzecz biorąc, „neuroprotezą ruchową” (jako że do neuroprotez zaliczane są również urządzenia nie wspomagające ruchu, a np. słuch lub inne sposoby porozumiewania się pacjenta ze światem zewnętrznym). Istnieją neuroprotezy ruchowe wspomagające stanie, chodzenie, sięganie do przedmiotów i ich chwytanie.
Tradycyjnie FES traktowana była jako metoda, którą dany pacjent powinien stosować do końca życia. Obecnie jednak możliwe jest przeprowadzanie krótkoterminowych interwencji przy użyciu FES, mających na celu przywrócenie zdolności danej osoby do samodzielnego poruszania się. Taki rodzaj leczenia nosi nazwę terapii przy pomocy funkcjonalnej elektrostymulacji (FEST – functional electrical stimulation therapy).
W przeglądzie z 2020 r. Marquez-Chin i Popovic piszą, że FEST stanowi dzisiaj jedno z najważniejszych narzędzi dostępnych terapeutom zajmującym się neurorehabilitacją osób po udarze lub urazie rdzenia kręgowego. Podczas interwencji typu FEST fizjoterapeuta prosi pacjenta o podjęcie próby wykonania ruchów funkcjonalnych kończyną (lub kończynami) z niedowładem i po kilku sekundach starań włączana jest stymulacja pożądanego ruchu. Procedurę tę powtarza się wiele razy podczas każdej sesji (przy czym często na jednej sesji ćwiczone są różne ruchy). Gdy już przywrócona zostaje zdolność do wykonywania ruchów celowych, wykorzystanie FES stopniowo się zmniejsza aż do zupełnego jej zarzucenia pod koniec interwencji. Najczęściej spotykana w literaturze długość terapii FEST wynosi 40 sesji.
Aby leczenie było udane, należy pamiętać o trzech najważniejszych komponentach FEST:
- po pierwsze, pacjent musi próbować wykonać ruch;
- po drugie, elektrostymulacja ułatwia ćwiczone zadanie dzięki temu, że wywołuje reakcję motoryczną oraz zapewnia właściwą sensoryczną informację zwrotną;
- po trzecie, terapeuta nadzoruje ruch danej kończyny, by upewnić się, że ruch ten jest właściwy i dobrej jakości.
Zadaniem terapeuty jest także modyfikacjarozmieszczenia elektrod i parametrów stymulacji wraz z postępami pacjenta. Przypuszcza się, że mechanizm działania tej metody polega na tym, iż jednoczesne pojawienie się zamiaru wykonania ruchu i sensorycznej informacji zwrotnej w wyniku wykonania wspomaganego ruchu wywołuje zmiany neuroplastyczne – i zmiany te ostatecznie prowadzą do przywrócenia zdolności wykonywania ruchów celowych2.
Najważniejsze obszary zastosowania FES u pacjentów po udarze to poprawa chodzenia, funkcji kończyny górnej, siły i wytrzymałości mięśni oraz czucia, a także zmniejszanie spastyczności i zapobieganie podwichnięciu stawu barkowego. Mimo tak szerokich możliwości oferowanych przez elektrostymulację funkcjonalną, fizjoterapeuci nie sięgają po nią wystarczająco często, nawet w krajach bardzo zaawansowanych technologicznie. Na przykład w badaniu obserwacyjnym przeprowadzonym w 2016 r. wśród kanadyjskich fizjoterapeutów stwierdzono, że wykorzystanie FES w terapii pacjentów po udarze jest niskie, a jednocześnie połowa respondentów oświadczyła, że chciałaby to wykorzystanie zwiększyć. Najważniejszymi barierami ograniczającymi stosowanie tej formy terapii były brak dostępu do zasobów, czyli czasu, sprzętu i szkolenia3.
Parametry techniczne funkcjonalnej stymulacji elektrycznej:
- intensywność stymulacji – określana jest przez amplitudę impulsów, czas trwania (czyli szerokość) impulsów i ich częstotliwość, przy czym amplituda impulsów jest odwrotnie skorelowana z czasem ich trwania; minimalna częstotliwość impulsów wymagana do uzyskania odpowiednich skurczów wynosi 16-20 Hz, choć czasem konieczne może być zastosowanie częstotliwości 40 Hz (czyli 40 impulsów na sekundę); im wyższa częstotliwość, tym silniejsze skurcze, ale zbyt silne skurcze mogą prowadzić do szybszego zmęczenia mięśni; typowo stosowane częstotliwości mieszczą się w przedziale 20-50 Hz;
- kształt impulsu:
- – jednofazowy – nie jest zalecany, ponieważ może prowadzić do uszkodzenia stymulowanej tkanki,
- dwufazowy symetryczny – składa się z dwóch faz o takim samym czasie trwania i amplitudzie, różniących się polaryzacją,
- dwufazowy asymetryczny – składający się z dwóch faz o odwrotnej polaryzacji, różniących się także amplitudą i/lub czasem trwania; przy impulsach asymetrycznych zalecane jest ich równoważenie, tak by całkowity ładunek elektryczny odprowadzany z organizmu równał się całkowitemu ładunkowi doprowadzanemu do organizmu (takie podejście zapewnia długoterminowe bezpieczeństwo stymulowanych tkanek).
Parametry FES, jakie należy ustalić przed rozpoczęciem stymulacji:
- arozmieszczenie elektrod – często ustalane jest metodą prób i błędów; najpierw elektrody umieszcza się nad nerwami mięśnia, który ma być stymulowany; jeśli uzyskujemy pożądany ruch, elektrody pozostają na miejscu; jeśli nie, ich rozmieszczenie jest korygowane (zwykle o odległości nie większe niż kilka centymetrów) i proces jest powtarzany do uzyskania pożądanego ruchu,
- intensywność stymulacji, czyli czas trwania i amplituda impulsów – zwykle terapeuta ustala ją, biorąc pod uwagę następujące parametry:
- próg sensoryczny – najmniejszą intensywność, przy której pacjent postrzega stymulację (nawet bez wywoływania ruchu),
- próg motoryczny – minimalną intensywność powodującą widoczny skurcz mięśnia (nawet jeśli nie dochodzi do ruchu),
- maksymalną tolerowaną intensywność – maksymalny poziom tolerowany przez pacjenta bez dyskomfortu,
- operacyjną intensywność stymulacji – intensywność używaną podczas rzeczywistego korzystania z FES;
- czy nie istnieją przeciwwskazania do elektrostymulacji, czyli:
- podrażnienia lub uszkodzenia skóry w miejscach, gdzie mamy umieścić elektrody,
- źle kontrolowana padaczka,
- znacząca dysrefleksja autonomiczna w przeszłości, – ciąża (nieznany jest wpływ FES na płód),
- stymulator serca,
- guzy nowotworowe w obszarze elektrostymulacji,
- metalowe protezy lub implanty w obszarze elektrostymulacji,
- nie zrośnięte złamania,
- podejrzewane, zdiagnozowane lub źle kontrolowane choroby sercowo-naczyniowe (w takich przypadkach wymagana jest szczególna ostrożność ze względu na obciążenie układu sercowo- -naczyniowego powodowane przez skurcze podczas stosowania FES).
Porażenie mózgowe
Niezwykle ważnym obszarem zastosowania elektrostymulacji jest porażenie mózgowe. Nawet 80% dzieci z tym schorzeniem cierpi na jego spastyczną postać. Wiąże się ona z deficytami neuromięśniowymi, które ograniczają mobilność z powodu słabości mięśni, skrócenia struktury mięśniowo-ścięgnistej, spastyczności i zaburzonej selektywnej kontroli motorycznej. Pomocne jest tutaj leczenie farmakologiczne czy chirurgiczne, natomiast może ono prowadzić do dalszego osłabienia – stąd znaczenie innych metod, takich jak elektrostymulacja. Już w roku 1993 opublikowano studium przypadków dwojga dzieci z tym typem zaburzeń, u których dodanie do programu fizjoterapii elektrostymulacji neuromięśniowej kończyny górnej przyniosło znaczącą poprawę. Półtoraroczne dziecko natychmiast zaczęło raczkować przy użyciu obu kończyn górnych, a dziecko w wieku 6,5 roku, z porażeniem połowiczym, uzyskało poprawę czucia i używania ręki z niedowładem4. Wright i wsp. przeprowadzili w roku 2012 przegląd dostępnych badań nad zastosowaniem NMES u dzieci z porażeniem mózgowym.
Ustalili oni, że metoda ta stosowana jest w następujących obszarach:
- poprawa chodu, poprzez:
- NMES podczas ćwiczeń,
- NMES podczas cyklu chodu,
- połączone zastosowanie NMES i toksyny botulinowej,
- przywrócenie funkcji kończyny górnej, poprzez: – NMES wspomagającą siłę i funkcję mięśni, – połączone zastosowanie NMES i ortez, – połączone zastosowanie NMES i toksyny botulinowej.
W omówieniu wyników tego przeglądu autorzy donoszą, że choć bez wątpienia potwierdzone zostały korzyści ze stymulacji mięśnia piszczelowego przedniego, połączonej ze stymulacją mięśnia brzuchatego łydki lub bez takiej stymulacji, to dostępne dane są niewystarczające do wydawania klinicznych zaleceń. Jeśli zaś chodzi o kończynę górną, dowody potwierdzają, że NMES przynosi zwiększenie siły mięśni, zakresu ruchu, zmniejszenie spastyczności i poprawę funkcjonowania dzieci z PM. Ogólnie rzecz biorąc, do osiągnięcia efektów wymagane jest wystarczająco długie zastosowanie tej metody, czyli 30-60 minut dziennie przez co najmniej 6-8 tygodni, przy czym dzienną dawkę można rozbić na dwie-trzy sesje. Działanie NMES można wzmóc dzięki zastosowaniu szyny dynamicznej na kończynę górną – zaobserwowano, że połączenie tych metod przynosi lepsze efekty, odnośnie do poprawy funkcji i postawy, niż każda z nich z osobna. Jeśli chodzi o toksynę botulinową, sugerowano, że może ona nasilać efekt NMES poprzez tymczasowe zmniejszenie napięcia mięśni, autorzy przeglądu stwierdzili jednak, że mało jest prac na ten temat5.
Kwestia ta pozostawała przedmiotem zainteresowania naukowców w latach późniejszych. W roku 2021 ukazał się obszerny przegląd badań nad nasilaniem efektu iniekcji toksyny botulinowej, wykonywanych w celu zmniejszenia spastyczności mięśni, poprzez zastosowanie elektrostymulacji. Włoscy uczeni ustalili w nim, że metoda ta w większości badań dawała korzystne efekty. Autorzy przeglądu podkreślają, że mechanizm leżący u podstaw tej terapii polega oczywiście na antyspastycznym działaniu obu jej elementów (toksyny botulinowej i elektrostymulacji), ale również na przypuszczalnym nasilaniu wchłaniania toksyny przez mięsień podczas elektrostymulacji. Kładą więc nacisk na to, by zabiegi elektrostymulacji były przeprowadzane w tym samym dniu, co iniekcje. W rozdziale przeglądu poświęconym dziecięcemu spastycznemu porażeniu mózgowemu ujęto siedem badań, spośród których w pięciu stwierdzono przewagę metody łączonej nad samymi iniekcjami. Odnotowane korzyści obejmowały poprawiony zakres ruchu i biomechanikę stawu skokowego, lepszy chód i stabilność postawy. W żadnym z badań nie wystąpiły efekty uboczne6.
Postęp zaszedł również w badaniach nad samą NMES w poprawianiu chodu u dzieci z porażeniem mózgowym. W 2019 r. opublikowano przegląd literatury na ten temat. Jego autorzy zidentyfikowali 18 badań nad tym zagadnieniem, obejmujących w sumie 212 uczestników w wieku 9,8 lat (średnia), z funkcjonowaniem mieszczącym się na poziomach I-III w klasyfikacji GMFCS (System Klasyfikacji Funkcji Motoryki Dużej). Wyniki przeglądu wskazują, że Funkcjonalna elektrostymulacja pomaga dzieciom z porażeniem mózgowym. jednokanałowa NMES ukierunkowana na chód poprawia zakres ruchu stawu skokowego podczas fazy przenoszenia – poprawiona jest kinematyka zgięcia grzbietowego – natomiast nie wpływa na takie problemy jak przeprost czy sztywność stawu kolanowego podczas chodu. Autorzy sugerują, że korzystny tutaj byłby powrót do stosowanej wcześniej wielokanałowej NMES – efekty jej wczesnych zastosowań były bardzo obiecujące, poprawiała ona bowiem różne elementy chodu. Zalecane są dalsze badania nad tą metodą7.
Według innej metaanalizy, również z 2019 r., na temat NMES w poprawianiu motoryki dużej u dzieci z porażeniem mózgowym, istnieją dowody przemawiające za zastosowaniem tej formy terapii jako leczenia uzupełniającego w poprawianiu siedzenia i stania8.
Siła i masa mięśniowa
Z wiekiem dochodzi do utraty siły mięśni w wyniku zmian w składzie włókien mięśniowych i ogólnego spadku jakości mięśni towarzyszącego procesom zastępowania funkcjonalnej kurczliwej tkanki zwłóknieniami. Starzeniu się mięśni towarzyszy ich atrofia i znaczne zmniejszenie plastyczności włókien mięśniowych, w wyniku postępującej utraty masy mięśniowej, zwłaszcza jeśli chodzi o włókna szybkokurczliwe.
Jednym ze sposobów leczenia tych procesów – czyli sarkopenii – jest elektrostymulacja. Jak dowodzą Barberi i wsp., metoda ta może pomagać osobom, które nie są w stanie podejmować normalnej aktywności fizycznej. Mechanizm jej działania polega zwłaszcza na aktywacji insulinopodobnego czynnika wzrostu-1 (IGF-1). Czynnik ten uruchamia anaboliczną ścieżkę zwiększającą syntezę białek, a jednocześnie redukuje degradację białek i aktywuje komórki satelitarne, zaś wszystkie te procesy poprawiają wydajność mięśni. Wyniki badań sugerują, że elektrostymulacja, podobnie jak ćwiczenia fizyczne, łagodzi spadek funkcjonalny związany z wiekiem, poprawia siłę mięśni i ich masę, podtrzymuje rozmiar włókien mięśniowych, aktywuje komórki satelitarne i zapewnia adaptację mięśni9.
W japońskim przeglądzie badań z 2016 r. czytamy, że elektrostymulacja mięśni zwiększa ich siłę i masę, co może być wykorzystane w leczeniu sarkopenii. Stymulacja o niskiej częstotliwości wydaje się bardziej wpływać na wzmacnianie, natomiast o wysokiej częstotliwości sprzyja zwiększaniu masy mięśniowej. Elektrostymulacja mięśni przyczynia się także do korzystnych zmian składu włókien mięśniowych, do poprawy aktywności oksydacyjnej enzymów i do lepszego wychwytu glukozy. Autorzy sugerują, że protokół interwencji przy zastosowaniu elektrostymulacji mięśni powinien skupiać się na stymulacji włókien mięśniowych typu II, a nie na wywoływaniu hipertrofii mięśni10.
Jak pisze Volker Adams w artykule z 2018 r., „w ostatnich latach elektromiostymulacja (EMS) w celu poprawy funkcji mięśni i zwiększania ich masy zyskuje na popularności. Stosowana jest szczególnie u osób po urazie, w celu odbudowania masy mięśniowej, oraz u pacjentów z poważną atrofią, którzy nie są w stanie lub nie chcą wykonywać konwencjonalnych programów treningu ćwiczeniowego. Badania na modelach eksperymentalnych oraz na ludziach potwierdziły, że EMS może zwiększać masę mięśniową o około 1% i poprawiać działanie mięśni o około 10-15% po 5-6 tygodniach leczenia. Mimo poważnego wzrostu kinazy kreatynowej we krwi podczas pierwszej sesji, EMS można uważać za bezpieczną interwencję terapeutyczną. Na poziomie molekularnym EMS poprawia równowagę anaboliczno-kataboliczną i stymuluje zdolność do regeneracji komórek satelitarnych”. Autor ten zaleca stosowanie maksymalnej intensywności stymulacji tolerowanej przez pacjenta. Sesje powinny odbywać się co najmniej trzy razy w tygodniu przez przynajmniej 5-6 tygodni. Rekomendowane jest stosowanie dużych impulsów (300-450 μs) i wysokiej częstotliwości (50-100 HZ u osób młodych i około 30 Hz u osób starszych). Według badań, EMS poprawia wydolność funkcjonalną lepiej niż trening. Ponadto metoda ta przeciwdziała atrofii szybkokurczliwych włókien mięśniowych, jaka zwykle występuje w sarkopenii. Choć temat łączenia EMS z treningiem konwencjonalnym w celu nasilenia efektu budzi wciąż kontrowersje, nie jest zalecane zupełne zarzucanie ćwiczeń na rzecz elektrostymulacji, jako że korzystne efekty treningu to nie tylko budowanie masy mięśniowej, ale również dobroczynny wpływ na funkcję śródbłonka, funkcję poznawczą oraz czynność mięśni serca11.
Prądy Kotza
Elektrostymulacja przy pomocy prądów Kotza polega na zastosowaniu prądu bipolarnego przeciętnie o częstotliwości 2,5 kHz z modulowaną amplitudą. Najczęściej tę technologię stosuje się do treningu mięśni. Jako że są to prądy o średniej częstotliwości, mają mniejszy wpływ na receptory sensoryczne w skórze niż prądy o niskiej częstotliwości, co pozwala na użycie większej amplitudy i osiągnięcie pełnego skurczu mięśnia.
Stymulacja prądami Kotza nazywana jest także rosyjską stymulacją, ponieważ powstała w celu poprawienia siły mięśni rosyjskich olimpijczyków – autor metody twierdził, że udało mu się osiągnąć zwiększenie siły o 40%. Poza tym ten rodzaj terapii stosowany jest często w leczeniu urazów sportowych, takich jak zerwanie więzadła krzyżowego przedniego (oczywiście w połączeniu z innymi formami fizjoterapii). Prowadzone są – z sukcesem – badania nad innymi zastosowaniami tych prądów, np. w leczeniu opadania stopy w przebiegu radikulopatii kręgosłupa lędźwiowego12 czy w leczeniu bólu stawów (np. w przebiegu hemofilii)13.
Łagodzenie bólu i skurczów
Najczęściej stosowanym typem elektrostymulacji w celu uśmierzania bólu jest TENS (transcutaneous electrical nerve stimulation), czyli przezskórna elektrostymulacja nerwów. Łagodzi ona objawy bólowe poprzez pobudzanie nerwów czuciowych, a to z kolei stymuluje mechanizm bramki kontrolnej i/lub układ opioidowy. Ponadto dolegliwości bólowe często powodują napięcie mięśni, co z kolei prowadzi do nasilenia bólu, i tak dochodzi do powstania „błędnego koła bólu”. Terapia TENS, zwłaszcza niskiej częstotliwości, rozluźnia mięśnie, dzięki czemu przerywa to błędne koło. Badania wskazują, że odpowiednio zastosowana TENS zapewnia znacząco większą ulgę w bólu niż placebo.
Terapię przy pomocy TENS często może przeprowadzać sam pacjent, przy pomocy przenośnego aparatu. Wymaga to jednak wcześniejszego przeszkolenia przez doświadczonego fizjoterapeutę, aby leczenie było skuteczne i nie dawało niepożądanych skutków ubocznych. Dobrym przykładem zastosowania tej metody jest leczenie przy jej pomocy bólu kręgosłupa lędźwiowo- -krzyżowego. Jak piszą Weber-Rajek i wsp., „w przewlekłych zespołach bólowych kręgosłupa L-S stosuje się TENS niskiej częstotliwości (do 10 HZ) i czasie trwania impulsu 150-200 μs. Efekt przeciwbólowy jest wynikiem uwalniania endorfin, pojawia się po 20-30 minutach stymulacji i utrzymuje się przez dłuższy czas po zakończeniu zabiegu. W przypadku bólu ostrego zaleca się stosowanie TENS o wysokiej częstotliwości (50-150 Hz) i czasie trwania impulsu 50 μs. Efekt przeciwbólowy pojawia się w trakcie stymulacji, ale jest bardziej krótkotrwały, niż w przypadku TENS o niskiej częstotliwości, dlatego ten rodzaj stymulacji można stosować kilka razy w ciągu dnia, zachowując kilkugodzinne przerwy”.
Polscy naukowcy z Bydgoszczy przeprowadzili badanie skuteczności TENS na czterdziestu pacjentach z ww. rodzajem bólu kręgosłupa. W przypadku pacjentów z bólem ostrym stosowano impuls symetryczny o częstotliwości 150 Hz i szerokości 50 μs, a w przypadku pacjentów z bólem przewlekłym – impuls symetryczny o częstotliwości 4 Hz i szerokości 200 μs. Każdorazowo sesja trwała 30 minut, a terapię przeprowadzano raz dziennie 5 dni w tygodniu przez 2 tygodnie. W jej wyniku zaobserwowano znaczącą poprawę stanu pacjentów – zmniejszoną intensywność i częstotliwość bólu oraz mniejsze ilości stosowanych leków przeciwbólowych. Ponadto zwiększył się zakres ruchu zgięcia kręgosłupa oraz zmniejszyło się ograniczenie aktywności ruchowej pacjentów. Autorzy formułują wniosek, że TENS jest skuteczną metodą terapii w tego rodzaju zespołach bólowych, przy czym jej efektywność uwarunkowana jest prawidłowo dobranymi parametrami stymulacji14.
W amerykańskim klinicznym badaniu randomizowanym wykazano, że już jedna sesja TENS zmniejsza odczuwanie bólu. Badaniem objęto 75 osób z chorobą zwyrodnieniową stawu kolanowego. Jedną trzecią z nich poddano jednorazowemu działaniu TENS o wysokiej częstotliwości (100 Hz), jedną trzecią – terapii TENS o niskiej częstotliwości (4 Hz), a pozostali stanowili grupę kontrolną (wykonano u nich TENS o intensywności poniżej progu motorycznego – placebo). W obu grupach objętych terapią zaobserwowano znaczące obniżenie się uciskowego progu bólu w obrębie stawu kolanowego, a w grupach z TENS o wysokiej częstotliwości – również nad mięśniem piszczelowym przednim. Co ciekawe, we wszystkich trzech grupach doszło do znaczącego obniżenia odczuwania bólu podczas spoczynku oraz podczas testu „wstań i idź”15.
W roku 2021 brytyjscy naukowcy przeprowadzili obszerną ocenę publikacji na temat TENS w leczeniu ostrego i przewlekłego bólu, obejmującą aż 169 przeglądów i 49 metaanalizy badań. Stwierdzili oni, że wprawdzie wiele publikacji ma niedociągnięcia metodologiczne, które utrudniają wyciąganie stanowczych wniosków, ale natrafili na metaanalizy zawierające wystarczające dowody na korzyści płynące ze stosowania tej metody – nie natrafili natomiast na metaanalizy zawierające wystarczające dowody na brak korzyści. Dlatego zalecają oni, by uwzględniać TENS wśród metod leczenia. Odnalezione dowody naukowe przemawiały zwłaszcza za tym, że ten rodzaj elektrostymulacji zmniejsza intensywność bólu mięśniowo-szkieletowego oraz bólu podczas porodu, a także zmniejsza ilość stosowanych leków przeciwbólowych u pacjentów po operacji16.
Przeciwbólowe działanie wykazuje również terapia prądami interferencyjnymi (prądami Nemeca). Polega ona na użyciu dwóch prądów przemiennych o przebiegu sinusoidalnym i o różnych częstotliwościach, nakładających się na siebie (wywołując interferencję). Są to prądy średniej częstotliwości, modulowane w amplitudzie z małą częstotliwością. Ich zaletą jest zdolność do głębszej penetracji tkanek. Według przeglądu badań z 2018 r. terapia prądami interferencyjnymi ma podobny ogólny wpływ na ból i korzystny wpływ na funkcjonowanie co TENS, fizjoterapeuci mogą więc z równym powodzeniem stosować obie te metody, zarówno w leczeniu bólu ostrego, jak i przewlekłego17.
Inne obszary, w jakich znajdują zastosowanie prądy interferencyjne, to stymulacja mięśni, miejscowe zwiększanie przepływu krwi i zmniejszanie obrzęków, brak jest natomiast obszerniejszych badań nad tymi zastosowaniami.
Gojenie się ran
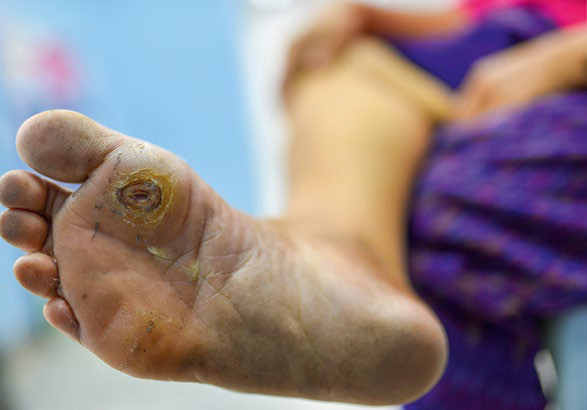
Proces gojenia się rany skórnej zwykle trwa do tygodnia lub dwóch. W niektórych przypadkach jednak jest on wydłużony i zakłócone zostają niektóre etapy gojenia się – wtedy mówimy o ranach przewlekłych. Do czynników zaburzających ten proces należą wiek, otyłość, palenie, niedobory składników odżywczych lub niektóre choroby (takie jak cukrzyca czy choroba naczyń obwodowych). Dlatego poszukiwane są sposoby wspomagające leczenie ran.
Jednym z nich jest elektrostymulacja, której działanie sprzyjające procesom gojenia się jest przedmiotem badań co najmniej od paru dziesięcioleci. Przegląd z roku 2005 mówił o wpływie na syntezę białek i migrację komórek oraz o właściwościach antybakteryjnych prądu elektrycznego jako o mechanizmach działania ważnych przy tym zastosowaniu. Już wtedy donoszono o korzystnym wpływie elektrostymulacji na przeszczepy skóry i miejsca pobrania skóry w badaniach na zwierzętach, a także – w licznych badaniach klinicznych – na gojenie się ran kończyn dolnych, zwłaszcza powstałych z powodu niedokrwienia lub neuropatii cukrzycowej18.
Najnowszy przegląd literatury na ten temat, opublikowany w 2021 r., stwierdza, że eksperymenty in vitro i in vivo wykazały, iż elektrostymulacja nasila epitelializację (naskórkowanie) rany, migrację fibroblastów i ukrwienie wokół rany. Potwierdzony został również efekt antybakteryjny prądu zmiennego i pulsującego. I, co najważniejsze, dwanaście randomizowanych badań kontrolowanych (czyli wszystkie tego rodzaju badania zidentyfikowane przez autorów przeglądu) nad wpływem prądów pulsujących na rany przewlekłe wykazało dużą redukcję rozmiaru rany i przyspieszenie tempa gojenia się w porównaniu z grupami kontrolnymi (przy czym rany przewlekłe obejmowały owrzodzenia cukrzycowe, odleżyny oraz owrzodzenia o tle niedokrwiennym). Rajendran i wsp. konkludują, że elektrostymulacja stanowi narzędzie przydatne w leczeniu ran, zarówno ostrych, jak i przewlekłych, ponieważ ogranicza stan zapalny, zwiększa perfuzję rany, kontroluje rozrost bakterii, nasila migrację fibroblastów, wywołuje angiogenezę i sprzyja aktywności keratynocytów. Dostępne obecnie dowody przemawiają więc za stosowaniem elektrostymulacji jako terapii pomocniczej w postępowaniu z ranami przewlekłymi19. Przykładem elektrostymulacji w tym zastosowaniu jest elektrostymulacja wysokonapięciowa (EWN) z użyciem prądu pulsującego. Stosuje się w niej prąd monofazowy, składający się z podwójnych impulsów (5-200 μs) o bardzo wysokiej amplitudzie (2-2,5 A) i wysokim napięciu (do 500 V), o częstotliwości 1-125 impulsów na sekundę. Ten rodzaj elektrostymulacji powoduje zmiany w przepuszczalności błon granicznych skóry i ścian naczyń krwionośnych, nasila osmozę, dyfuzję i przemianę materii. Dochodzi również do wzrostu podziału fibroblastów i syntezy kolagenu. Ponadto obserwuje się takie zjawiska, jak pobudzenie układu wegetatywnego, optymalizacja ciśnienia śródtkankowego, poprawa napięcia ścian naczyń krwionośnych i mikrokrążenia oraz zwiększenie nasycenia tkanek tlenem. Elektrostymulacja wysokonapięciowa wykazuje również właściwości przeciwbólowe i bakteriobójcze.
Polscy uczeni przeprowadzili przegląd badań, z którego wynika, że elektrostymulacja wysokonapięciowa prądem pulsującym skutecznie wspomaga gojenie się owrzodzeń żylnych kończyn dolnych oraz odleżyn20.
Jonoforeza
Przykładem zastosowania prądu w fizjoterapii jest również jonoforeza, z tym że tutaj czynnikiem leczniczym nie jest prąd, a jony substancji aktywnych wprowadzanych do tkanek przy pomocy prądu stałego. Z przeglądu literatury autorstwa Kruegera i wsp. z roku 2014 wynika, że ta forma terapii skuteczna jest na przykład w leczeniu zapalenia ścięgna ze zwapnieniami i kostniejącego zapalenia mięśni (substancją czynną jest tutaj kwas octowy), różnego rodzaju stanów zapalnych (deksametazon), stanów zapalnych tkanek miękkich (lidokaina) oraz reumatoidalnego zapalenia stawów (tlenek cynku). Metoda ta znajduje zastosowanie praktyczne w fizjoterapii i przynosi dobre rezultaty21.
Zaletą jonoforezy jest możliwość bezinwazyjnego wprowadzenia dużych dawek środka leczniczego bezpośrednio do chorej tkanki, bez ogólnoustrojowego obciążania organizmu.
Powyższe przykłady nie wyczerpują oczywiście tematu zastosowań elektrostymulacji, który jest zbyt obszerny na nasze łamy. Mamy natomiast nadzieję, że artykuł ten przybliży tę formę fizykoterapii tym, którzy jeszcze nie zastanawiali się nad jej wypróbowaniem albo stosowali ją sporadycznie. Bowiem, jak widać z powyższego, potencjał elektrostymulacji jest nie w pełni wykorzystywany, a częstsze sięganie po nią podczas rehabilitacji mogłoby się przyczynić do lepszych wyników leczenia.
- Nussbaum E.L. et al., Physiother Can. 2017; 69(5): 1-76.
- Marquez-Chin C., Popovic M.R., BioMedical Engineering Online. 2020; 19: 34.
- Auchstaetter N. et al., Phys Ther. 2016 Jul 1; 96(7): 995-1005.
- Carmick J. Phys Ther. 1993; 73: 514-527.
- Wright P.A. et al., Arch Dis Child. 2012 Apr; 97(4): 364-71.
- Picelli A. et al., Toxins. 2021; 13: 303.
- Mooney J.A., Rose J., Front Neurol. 2019 Aug 21; 10: 887.
- Salazar A.P. et al., Braz J Phys Ther. 2019 Sep 1; 23(5): 378-386.
- Barberi L. et al., Eur J Transl Myol. 2015 Aug 24; 25(4): 5227.
- Nishida M.N. et al., Eur Geriatr Med. 2016 Jun; 7(3): 267-271.
- Adams V., J Cachexia Sarcopenia Muscle. 2018 Aug; 9(4): 631-634.
- Wang T.J. et al., Innov Clin Neurosci. 2019 May 1; 16(5-6): 46-49.
- Correa-Márquez L.I. et al., Rev Hematol Mex. 2019 Apr-Jun; 20(2): 131-136.
- Weber-Rajek M. i wsp.; Journal of Education, Health and Sport. 2016; 6(3): 11-20.
- Vance C.G.T. et al., Phys Ther. 2012 Jul; 92(7): 898-910.
- Paley C.A. et al., Medicina. 2021; 57: 1060.
- de Almeida C.C. et al., Braz J Phys Ther. 2018 Sep-Oct; 22(5): 347-354.
- Kloth L.C., Int J Low Extrem Wounds. 2005 Mar; 4(1): 23-44.
- Rajendran S.B. et al., J Funct Biometer. 2021; 12: 40.
- Polak A. et al., Adv Wound Care (New Rochelle). 2014 Feb 1; 3(2): 104-117.
- Krueger E. et al., Fisioter mov. 2014 Sep; 27(3): doi.org/10.1590/0103-5150.027.003.AR02.