Anatomia i funkcja ścięgna Achillesa
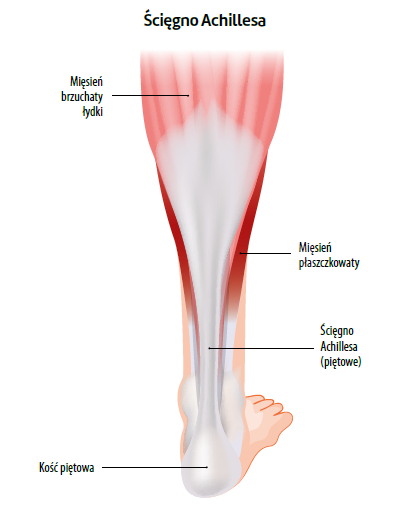
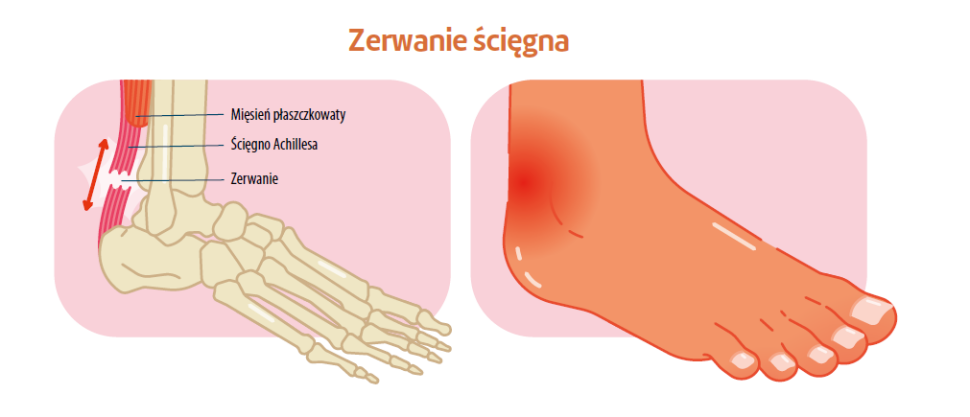
Ścięgno Achillesa (ŚA), czyli ścięgno piętowe (tendo calcaneus), łączy mięśnie łydki z kością piętową. Ma ono średnio długość 15 cm (od 11 do 26 cm) u osób dorosłych. Przeciętna szerokość u jego początku wynosi 6,8 cm, przy czym stopniowo maleje do 1,8 cm w części środkowej. Na wysokości ok. 4 cm nad kością piętową ŚA zaokrągla się i w miejscu przyczepu do guza tej kości przyjmuje szerokość 3,4 cm.
ŚA zaczyna się w okolicy połowy długości goleni i łączy się proksymalnie z mięśniem brzuchatym łydki. Dwie głowy tego mięśnia (przyśrodkowa i boczna) tworzą razem jeden brzusiec zajmujący tylny powierzchowny przedział podudzia. Głębiej leży mięsień płaszczkowaty, który wraz z mięśniem brzuchatym tworzy mięsień trójgłowy łydki; ten zaś, za pośrednictwem ścięgna Achillesa, pozwala na zginanie podeszwowe stawu skokowego. Na podkolanowej powierzchni kości udowej rozpoczyna się mięsień podeszwowy, mały i cienki mięsień szczątkowy (nie występuje u ok. 8% ludzi). Jego ścięgno zachodzi na przyśrodkową część kości piętowej i łączy się z ŚA.
Tendinopatia ścięgna Achillesa – patofizjologia i epidemiologia
Tendinopatię określa się jako ból i obrzęk w okolicy ścięgna, niezwiązane z jego zerwaniem i powodujące pogorszenie funkcjonowania, przy czym objawy nasilają się podczas aktywności fizycznej.
Maffulli i wsp. definiują tendinopatię ŚA jako „zasadniczo nieudaną odpowiedź regeneracyjną przy chaotycznej proliferacji tenocytów, anomaliach dotyczących tenocytów, wraz z przerwaniem włókien kolagenowych, a następnie z rozrostem macierzy niekolagenowej”2.
Często używany jest również termin „zapalenie ścięgna”, ale może być on mylący, ponieważ nierzadko badania histopatologiczne nie uwidoczniają stanu zapalnego.
Procesy patofizjologiczne leżące u podłoża tendinopatii mieszczą się na pewnym kontinuum. Rozciąga się ono od tendinopatii reaktywnej (faza ostra), gdzie mamy do czynienia z proliferacją tenocytów (dojrzałych komórek ścięgna), zwiększonym wytwarzaniem białek i zwiększaniem się grubości ścięgna, poprzez stan, gdy ścięgno nie jest w stanie się regenerować, w którym wytwarzanie tenocytów i białek jeszcze bardziej się nasila i dochodzi do ogniskowego przerwania włókien kolagenowych, do tendinopatii degeneracyjnej (faza przewlekła), wiążącej się ze śmiercią komórek, dużymi obszarami dezorganizacji kolagenu oraz obszarami wypełnionymi naczyniami i nerwami. Wydaje się, że ból związany z tendinopatią może wynikać właśnie z neowaskularyzacji i wrastania nowych włókien nerwowych. Opisanym procesom może towarzyszyć stan zapalny, ale raczej tylko na wczesnych etapach.
Według badań prospektywnych do czynników ryzyka tendinopatii ścięgna Achillesa należą: płeć żeńska, wysoki indeks masy ciała, rasa czarna, wcześniejsza tendinopatia lub złamanie, wysokie spożycie alkoholu, obniżona siła zgięcia podeszwowego (w stawie skokowym), większy tygodniowy wolumen biegania, większa liczba lat biegania, używanie butów z kolcami lub obuwia absorbującego wstrząsy, trenowanie w zimnej aurze, stosowanie doustnych środków antykoncepcyjnych i/lub hormonalnej terapii zastępczej, zmniejszony lub zbyt duży zakres ruchu zgięcia grzbietowego stawu skokowego oraz używanie antybiotyków z grupy fluorochinolonów3.
Tendinopatia ścięgna Achillesa dotyka zarówno osoby aktywne fizycznie, jak i prowadzące siedzący tryb życia. Z danych obserwacyjnych wynika, że co najmniej raz w życiu doświadcza jej co czwarty sportowiec, a największym ryzykiem obarczeni są biegacze – ten problem zdrowotny dotyczy aż 40–50% tej grupy sportowców4.
Rozpoznanie tendinopatii ścięgna Achillesa
Rozróżnia się zasadniczo dwa typy tendinopatii ścięgna Achillesa – tendinopatię poza przyczepem i tendinopatię przyczepu (insercyjną).
Tendinopatia poza przyczepem objawia się przede wszystkim bólem umiejscowionym 2–6 cm nad przyczepem do kości piętowej. Ból może znacząco zaburzać funkcjonowanie, a zwłaszcza aktywność sportową. Jest on najsilniejszy podczas rozpoczęcia ruchu po okresie odpoczynku. U pacjentów często występuje obrzęk oraz tkliwość palpacyjna po tylno-przyśrodkowej stronie ścięgna.
Badanie w kierunku tendinopatii nieinsercyjnej obejmuje badanie palpacyjne i testy obciążeniowe ścięgna. To pierwsze sprawdza występowanie pogrubienia ścięgna, jego trzeszczenia i bólu podczas palpacji. Przeprowadzany jest także test Royal London Hospital (przy tendinopatii bolesność obrzęku zmniejsza się lub zupełnie zanika podczas maksymalnego zgięcia grzbietowego stawu skokowego) oraz badanie w kierunku objawu łuku (istnienie wewnątrz ścięgna zgrubienia, które przesuwa się względem kostek podczas aktywnego zginania grzbietowego i podeszwowego stopy). Natomiast podczas testów obciążeniowych stwierdza się ból przy biernym zginaniu grzbietowym, ból przy uniesieniu pięty i ból podczas skakania.
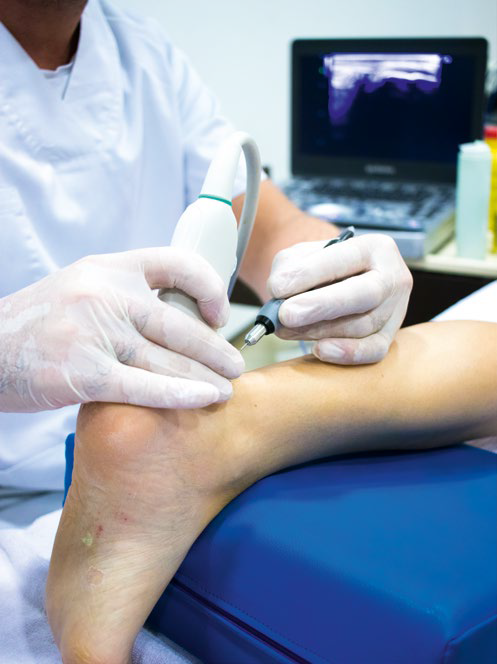
Przy diagnozowaniu tendinopatii poza przyczepem bywają stosowane badania obrazowe, pomocne w identyfikowaniu natury, umiejscowienia i rozmiaru zmian. Szczególnie użyteczne może być badanie ultrasonograficzne połączone z badaniem dopplerowskim, jako że ból w tym schorzeniu wydaje się związany z neowaskularyzacją. Wykazano bowiem, że skuteczne w uśmierzaniu objawów są metody leczenia ograniczające neowaskularyzację.
Stosowane jest również obrazowanie za pomocą rezonansu magnetycznego, natomiast Pearce i Tan skłaniają się raczej ku ultrasonografii, jako że jest to metoda tańsza i – jak wykazały niedawne badania – co najmniej tak samo dokładna jak rezonans5.
Typowe objawy tendinopatii przyczepu (insercyjnej) to tkliwość podczas badania palpacyjnego w obrębie dystalnych 2 cm od ścięgna Achillesa. Podczas oględzin widoczny jest opuchnięty i zaczerwieniony obszar z tyłu pięty. Pomocne może być sprawdzenie ograniczenia zakresu ruchu zgięcia grzbietowego stawu skokowego (łącznie z testem Silverskiölda, czyli biernym zgięciem grzbietowym stawu skokowego przy kolanie wyprostowanym i przy kolanie zgiętym, który pozwala ocenić izolowany skurcz mięśnia brzuchatego łydki) oraz słabości zginaczy podeszwowych stawu skokowego. Niestety, ból podczas badania może utrudniać interpretację wyników. Pomocne przy diagnozie jest zgłaszanie przez pacjentów bólu nasilającego się podczas aktywności oraz sztywności związanej z dłuższymi okresami odpoczynku.
Przy tym rodzaju tendinopatii stosuje się rutynowo badania obrazowe. Badanie RTG stopy z obciążeniem w płaszczyźnie bocznej jest pomocne w wykrywaniu entezofitów, zwapnień w ścięgnie oraz deformacji Haglunda (powiększenia tylnej i tylno-górnej części guza piętowego). Ocena trójkąta Kagera na radiogramie może pozwolić na wykrycie zapalenia kaletki. Obrazowanie za pomocą USG lub MRI może posłużyć do identyfikacji zmian zarówno w obrębie tkanek miękkich (degeneracji ścięgna, neowaskularyzacji, zapalenia kaletki lub zapalenia pochewki ścięgna), jak i kostnych (entezofitów, zwapnień w ścięgnie). Ogólnie, niezależnie od typu tendinopatii, badania obrazowe nie w pełni pokrywają się z występowaniem objawów. Nawet do 35% pacjentów ze zmianami widocznymi w badaniach obrazowych nie odczuwa żadnych objawów, a u 19% pacjentów z objawami tendinopatii badania obrazowe nie uwidaczniają żadnych zmian6.
Leczenie tendinopatii ścięgna Achillesa
Najbardziej aktualne zalecenia dotyczące tendinopatii ścięgna Achillesa to holenderskie wytyczne multidyscyplinarne opublikowane w 2021 r. Zostały one opracowane przez Quality Foundation of the Dutch Federation of Medical Specialists na podstawie dostępnych danych naukowych i wcześniejszych wytycznych. W procesie tworzenia dokumentu brali udział również pacjenci.
Jedyne narzędzie zalecane przez te wytyczne do monitorowania postępów leczenia to kwestionariusz VISA-A (Victorian Institute of Sport Assessment – Achilles questionaire). Nie jest wymagane wykonywanie w tym celu badań obrazowych.
Polityka przeczekania objawów nie jest zalecana, ponieważ może ona przynieść najwyżej ograniczoną poprawę krótkoterminową. Wskazane jest natomiast aktywne leczenie zachowawcze obejmujące następujące elementy:
- edukację pacjenta, czyli wyjaśnienie, na czym polega ten problem zdrowotny, jakie jest rokowanie, jak uśmierzać ból i jak radzić sobie z czynnikami psychologicznymi,
- poradę odnośnie do obciążeń, czyli zalecenie:
- tymczasowego zaprzestania czynności (sportów) wywołujących ból,
- tymczasowego zastąpienia czynności (sportów) wywołujących ból czynnościami, które go nie powodują,
- stopniowego zwiększania obciążenia czynnościami,
- korzystania ze skali mierzenia bólu do monitorowania poziomu dolegliwości związanych z danymi czynnościami (sportami) oraz dostosowywania tych czynności odpowiednio do poziomu bólu,
- progresywne ćwiczenia wzmacniające mięśnie łydki, przeprowadzane co najmniej przez 12 tygodni, w formie dostosowanej do pacjenta; przy tendinopatii przyczepu należy rozważyć początkowe wykonywanie ćwiczeń na płaskiej powierzchni.
Jeśli po trzech miesiącach edukacji pacjenta, terapii ćwiczeniowej i stosowania się do porad odnośnie do obciążeń nie następuje poprawa, należy omówić dodatkowe metody leczenia. Do metod takich należą:
- terapia falą uderzeniową,
- inne metody bierne (np. szyny zakładane na noc, wkładki, suplementy z kolagenem, ultradźwięki i masaże frykcyjne, terapia laserowa i terapia światłem),
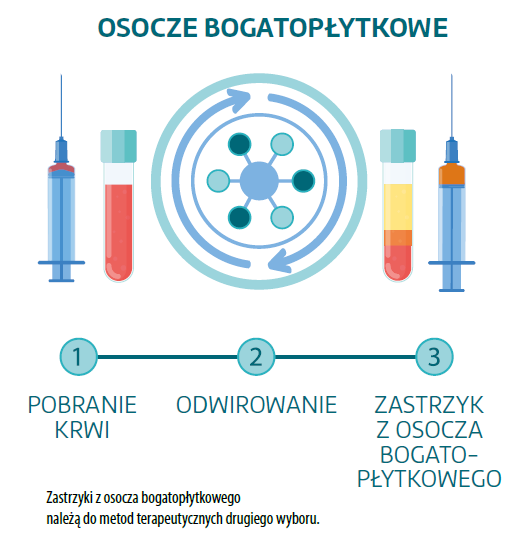
- iniekcje, takie jak polidokanol, lidokaina, krew autologiczna, osocze bogatopłytkowe, frakcja stromalna, kwas hialuronowy, proloterapia (wielokrotne wstrzykiwanie do ścięgna środków drażniących) lub iniekcje wysokoobjętościowe oraz akupunktura.
Ostrożność zalecana jest wobec niesteroidowych leków przeciwzapalnych oraz zastrzyków z kortykosteroidów.
Jeśli po co najmniej sześciu miesiącach aktywnego leczenia nie zachodzi poprawa, można rozważyć leczenie chirurgiczne, po wzięciu pod uwagę oczekiwanej skuteczności w porównaniu z metodami leczenia zachowawczego i ewentualnych powikłań.
W ramach profilaktyki powtórnego zachorowania ważne jest, by aktywne leczenie prowadzone było dostatecznie długo przed powrotem do stosowania obciążeń, które wcześniej powodowały objawy. Ogólnie rzecz biorąc powrót do bezobjawowego obciążenia możliwy jest najwcześniej po kilku miesiącach aktywnej terapii. Po powrocie do zdrowia należy zaplanować stopniowe zwiększanie obciążenia. Nawet po ustąpieniu objawów należy rozważyć kontynuowanie ćwiczeń mięśni łydki.
Jeśli chodzi o rokowanie związane z tendinopatią ścięgna Achillesa, według holenderskich wytycznych należy poinformować pacjenta, że większość chorych odzyskuje zdrowie, choć istnieje ryzyko, że objawy, mimo leczenia, będą się utrzymywać długoterminowo: 23–37% pacjentów ma uporczywe objawy utrzymujące się powyżej 10 lat.
Dodanie do ćwiczeń ekscentrycznych przezskórnej elektrolizy międzytkankowej
daje obiecujące wyniki.
Większość (85%) sportowców z tendinopatią ŚA wraca do aktywności sportowej, choć nie wiadomo, czy zachowują poziom wydolności sprzed zachorowania i czy zupełnie nie odczuwają objawów. Postawienie długoterminowej prognozy jest niemożliwe, ponieważ nie zidentyfikowano czynników, które by ją umożliwiały7.
Skuteczność terapii tendinopatii ścięgna Achillesa i metod dodatkowych
Najbardziej zalecaną formą fizjoterapii w tendinopatii są ćwiczenia ekscentryczne. Autorzy przeglądu badań z 2013 r. zauważyli znaczącą różnicę między skutecznością takich ćwiczeń w pełnym zakresie ruchu (poniżej schodka) i ćwiczeń na poziomie podłogi (gdzie przyczep ścięgna podlega mniejszemu obciążeniu). Przy tym pierwszym typie ćwiczeń ból w wizualnej skali analogowej obniżył się tylko o 2 punkty i jedynie 30% pacjentów zgłaszało satysfakcję z terapii, podczas gdy przy typie drugim (na poziomie podłogi) ból obniżył się już o 3,9 punktu, a satysfakcję z terapii zgłaszało 67% pacjentów.
Leczenie chirurgiczne rozważane jest u pacjentów z tendinopatią insercyjną oporną na inne formy leczenia. Większość procedur obejmuje usunięcie zmienionych patologicznie tkanek ścięgna i jego zwapnień, tylno- -górnego wyrostka kości piętowej oraz kaletki maziowej. Według ww. przeglądu badania donoszą o wysokiej satysfakcji pacjentów z leczenia chirurgicznego, wynoszącej średnio 89%. Powikłania odnotowano w 23% przypadków, a poważne powikłania – w 3,1% przypadków.
Autorzy przeglądu zaznaczają, że wyniki leczenia mogą być różne u pacjentów ze zmianami kostnymi (zwapnieniami) niż u pacjentów bez takich zmian, podkreślają zatem znaczenie badań obrazowych przy stawianiu diagnozy i podejmowania decyzji o leczeniu.
Dwa badania objęte przeglądem sprawdzały wpływ fali uderzeniowej. Jedno z nich wykazało, że metoda ta zmniejsza ból w większym stopniu (o cztery punkty 12 miesięcy po terapii) i przynosi większą satysfakcję pacjentów niż „leczenie tradycyjne” . W drugim porównano falę uderzeniową z programem ćwiczeń ekscentrycznych. Okazało się, że ta pierwsza metoda daje bardziej znaczące zmniejszenie bólu (o 4 punkty przy 2 punktach w grupie z ćwiczeniami ekscentrycznymi), poprawę ogólnego funkcjonowania (z 53 do 80 punktów w grupie z falą uderzeniową – w porównaniu do wzrostu z 53 do 63 punktów w grupie z ćwiczeniami) i wyższą satysfakcję pacjentów (64% przy fali uderzeniowej w porówaniu z 28% w grupie z ćwiczeniami).
Według innych danych odnośnie do tendinopatii insercyjnej iniekcje dekstrozy hiperosmolarnej pomagają zmniejszyć o 4 punkty ból mierzony w 10-stopniowej wizualnej skali analogowej podczas katamnezy (28 miesięcy po terapii). Małe badanie nad zastrzykami z polidokanolu wykazało zmniejszenie bólu o prawie 6 punktów (8 miesięcy po leczeniu) oraz satysfakcję 73% pacjentów.
Przegląd ten wspomina również o jednym małym badaniu porównującym takie metody jak krioterapia, laser CO2 i TECAR (Transfer of Energy Capacitive and Resistive, czyli transfer elektryczny pojemnościowy i rezystywny; terapia ta generalnie polega na stymulacji ciała falami radiowymi w celu wytworzenia ciepła w leczonej tkance). Według wyników każdy z tych trzech sposobów leczenia przyniósł znaczące zmniejszenie bólu i satysfakcję wszystkich pacjentów8.
Hiszpańscy naukowcy przeprowadzili badanie prospektywne nad zastosowaniem przezskórnej elektrolizy wewnątrztkankowej połączonej z ćwiczeniami ekscentrycznymi u pacjentów z tendinopatią ŚA. Jego wyniki są bardzo obiecujące. Dzięki terapii uzyskano obniżenie bólu (w wizualnej skali analogowej) z poziomu około 4 (i 8 podczas uprawiania sportu) do około 1 punktu, a wynik kwestionariusza VISA-A poprawił się z poziomu średnio 46 punktów do 88 punktów10.
Przypuszcza się, że stan ŚA można poprawić dzięki zwiększeniu jego ukrwienia. Do metod stosowanych w celu nasilenia mikrocyrkulacji w tym ścięgnie należą ultradźwięki i masaż wibracyjny, jak wskazuje choćby badanie tajwańskie z 2015 r., z udziałem zdrowych ochotników11.
Do zdrowia ścięgna Achillesa mogą się przyczyniać także niektóre suplementy diety. Jak wynika z tureckiego badania na szczurach z 2018 r., preparat zawierający mukopolisacharydy, witaminę C i kolagen wprawdzie nie wpływa realnie na syntezę kolagenu, wywołuje natomiast zwiększoną ekspresję PCNA (antygenu jądrowego proliferującej komórki) i TFGβ1 (transformującego czynnika wzrostu β 1) w fibroblastach łącznej tkanki luźnej w miejscu po rekonstrukcji przeciętego ścięgna, co może odgrywać pewną rolę w ciągłości gojenia się tej struktury12. Ponadto w hiszpańskim badaniu prospektywnym z 2014 r. stwierdzono, że suplement diety zawierający ww. składniki zmniejsza ból w spoczynku i podczas aktywności, poprawia wyniki kwestionariusza badania funkcjonalnego i zmniejsza grubość chorego ścięgna. Badanie przeprowadzono z udziałem pacjentów cierpiących na tendinopatię ścięgna Achillesa, ścięgna rzepki lub ścięgna nadkłykcia bocznego kości ramiennej13.
Zerwanie ścięgna Achillesa – epidemiologia i diagnoza
Występowanie zerwania ścięgna Achillesa w populacji ogólnej wynosi od 5 do 10 na 100 tys., choć może być wyższe w niektórych populacjach i ogólnie wykazuje tendencję wzrostową14. Do ponad 80% zerwań dochodzi podczas rekreacyjnego uprawiania sportu, przy czym tylko u około 10% pacjentów doświadczających zerwania występowały wcześniej problemy ze ścięgnem15. Według danych brytyjskich typowy pacjent z zerwaniem ścięgna Achillesa ma od 20 do 49 lat i jest mężczyzną (mężczyźni doznają zerwania tego ścięgna nawet 20 razy częściej niż kobiety).
Typowym tłem tego urazu jest bieganie, skakanie lub inna czynność charakteryzująca się ruchliwością i wiążąca się z gwałtownymi skurczami pliometrycznymi.
Prawdopodobieństwo zerwania ŚA jest większe w przypadku nadmiernego obciążenia tego ścięgna podczas inwersji i ewersji stawu skokowo-piętowego. Do zwykle zgłaszanych mechanizmów zerwania należą: odpychanie się obciążoną stopą przy wyprostowanym kolanie, niespodziewane zgięcie grzbietowe stawu skokowego oraz gwałtowne zgięcie grzbietowe stawu skokowego z pozycji zgięcia podeszwowego. Obciążenia doznawane podczas takich skurczów mogą sięgać 6- lub nawet 12-krotności ciężaru ciała, co stanowi wartość graniczną wytrzymałości fizjologicznej zdrowego ścięgna Achillesa. Do zerwania najczęściej dochodzi w rejonie od 3 do 6 cm proksymalnie do przyczepu piętowego ścięgna, ponieważ ten odcinek ma niewielki przekrój, jest poddawany dużym obciążeniom ekscentrycznym i jest słabo unaczyniony.
Wewnętrznym czynnikiem ryzyka zerwania ŚA jest predyspozycja anatomiczna lub niezdolność organizmu do naturalnej absorpcji doznawanego obciążenia. Ścięgno ma zmniejszoną zdolność do absorpcji wstrząsu, gdy utrzymują się zaburzenia dystalnego łańcucha kinetycznego. Ryzyko zerwania jest większe między innymi przy koślawości lub szpotawości stopy, zwiększonej antewersji kości udowej, małej elastyczności mięśniowo-ścięgnowej, różnicy w długości kończyn dolnych, słabości mięśni, nadwadze oraz starzeniu się. Natomiast do zewnętrznych czynników ryzyka należą wszelkie błędy w stosowanej technice treningu lub czynniki środowiskowe, czyli np. nadmierna intensywność lub czas trwania biegania, nowa lub nadmierna aktywność pliometryczna, nieodpowiednia lub zmieniona powierzchnia, na której przeprowadzany jest trening. Ponadto zidentyfikowano dwa leki wiążące się z opóźnioną regeneracją ścięgna i jego nekrozą – są to antybiotyki z grupy fluorochinolonów (osłabiają macierz pozakomórkową ścięgna) oraz kortykosteroidy (osłabiają kolagen i zmniejszają ukrwienie i tak już słabo ukrwionego obszaru). Dlatego po zakończeniu stosowania tych leków należy odczekać przed powrotem do treningów16.
Ważne jest wczesne postawienie diagnozy, jako że rozpoznanie zerwania ŚA w czasie dłuższym niż 24 godziny od urazu stanowi względne wskazanie do leczenia operacyjnego.
W 2015 r. opublikowano artykuł brytyjskich specjalistów opisujący, jak przeprowadzić diagnostykę, by nie przeoczyć tego urazu (tekst był adresowany do lekarzy rodzinnych, ale może być użyteczny również w praktyce fizjoterapeutycznej). W typowym wywiadzie pacjent opisuje nagły ból nogi, który pojawił się w momencie, gdy słyszalny był wyraźny trzask (odgłos zerwania). Pacjent często odnosi wrażenie, że został uderzony („kopnięty”) bezpośrednio w łydkę i zwykle nie miał wcześniej żadnych objawów ze strony ścięgna. Pacjent może też być przekonany, że skręcił staw skokowy lub nadwerężył łydkę.
Podczas badania nie należy kierować się występowaniem obrzęku lub siniaków, ponieważ nie jest to wiarygodne kryterium. Bardzo prawdopodobne jest występowanie tkliwości, ale może być ona obecna na nieco innym poziomie, niż się tego spodziewamy. Często nie można wyczuć przerwy w ścięgnie, ponieważ może być ona maskowana przez miejscowy obrzęk. Mimo zerwania, możliwe jest w pewnym zakresie czynne zgięcie podeszwowe stawu skokowego (dzięki innym ścięgnom biegnącym z łydki do stopy). Zgięcie podeszwowe bierne wiąże się z bólem, ale nie jest tak naprawdę ograniczone. Zgięcie grzbietowe pozostaje prawidłowe. Pacjent nadal jest w stanie chodzić, czasem nawet może stać na palcach obu stóp (ale nie podczas stania jednonóż na kończynie z urazem).
Natomiast najważniejszym badaniem, jakie należy przeprowadzić przy podejrzeniu zerwania ŚA, jest test Simmondsa. Pacjent klęczy na krześle lub leży na brzuchu na leżance, przy czym stopy i stawy skokowe wystają poza brzeg mebla i nie mają podparcia. Delikatne ściśnięcie zdrowej nogi nad wypukłością mięśni łydki spowoduje zgięcie podeszwowe stawu skokowego. Gdy badanie powtórzy się po stronie z urazem, stopa się nie poruszy, jeśli doszło do zerwania ŚA – ze względu na brak połączenia między mięśniami łydki (brzuchatym i płaszczkowatym) a stopą. Test Simmondsa w wyjątkowych sytuacjach może dawać wynik fałszywie ujemny (na przykład u pacjentów po artrodezie tylnej części stopy, z bardzo sztywnym stawem skokowym w wyniku urazu czy choroby zwyrodnieniowej stawów lub po operacji związanej z wydłużeniem ŚA). Należy również pamiętać, że test ten nadaje się wyłącznie do rozpoznawania ostrego zerwania ŚA. W przypadkach przewlekłych najlepszy do zastosowania jest test hiperzgięcia grzbietowego stawu skokowego – po zrośnięciu się ŚA bez leczenia jest ono wydłużone, w związku z czym staw skokowy ma większy zakres ruchu biernego zgięcia grzbietowego niż staw skokowy zdrowej kończyny17.
Ostre zerwanie ŚA diagnozuje się na podstawie badania klinicznego, ze wsparciem badań obrazowych, przy czym ultrasonografia wydaje się tutaj skuteczniejsza od rezonansu magnetycznego, ponieważ pozwala na zidentyfikowanie umiejscowienia urazu, wielkości przerwy między zerwanymi końcami ścięgna oraz na stwierdzenie, czy chodzi o pełne zerwanie, czy naderwanie. Przy planowaniu leczenia użyteczne jest zwykłe badanie RTG (widok boczny stawu skokowego). Może ono pomóc również w wykryciu obrzęku ścięgna i zwiększonej gęstości tkanki miękkiej w trójkącie Kagera i jest niezastąpione, jeśli chodzi o wykrywanie zwapnień, pięty Haglunda czy złamań awulsyjnych kości piętowej. Problemy tego typu sugerowałyby wcześniejszą degenerację lub przewlekłe zapalenie ścięgna. W przypadkach chronicznej tendinopatii ŚA ryzyko ponownego zerwania jest wysokie, bez względu na wdrożoną terapię. Lekarz rozważa wtedy leczenie chirurgiczne i rekonstrukcję ścięgna przy użyciu zdrowej tkanki.
Terapia zerwania ścięgna Achillesa
Zerwanie ścięgna Achillesa jest leczone zachowawczo lub operacyjnie i wciąż trwają dyskusje nad tym, która z tych opcji jest skuteczniejsza. Przy leczeniu zachowawczym istnieje ryzyko opóźnienia w zrastaniu się ścięgna, co może skutkować słabością łydki, a niepełne wyzdrowienie może zwiększać ryzyko ponownego zerwania. Natomiast pewne dowody wskazują, że ścięgno może się zregenerować mimo braku bezpośredniego kontaktu zerwanych końców – pod warunkiem jednak, że tkanka na krańcach zerwanego ścięgna jest zdrowa, a nie patologiczna.
Leczenie zachowawcze polega na zastosowaniu unieruchomienia na 6-8 tygodni. Staw skokowy w pozycji zgięcia podeszwowego umieszcza się w gipsie na 4 tygodnie, a następnie w pozycji neutralnej na kolejne 2 do 4 tygodni.
Pomocną metodą może być zastosowanie ortezy funkcjonalnej. Już w 1992 r. porównano unieruchomieniem przez 3 tygodnie i następnie zastosowaniem ortezy funkcjonalnej.Okazało się, że ta druga opcja przynosiła szybszą poprawę zginania grzbietowego stawu skokowego i umożliwiała wcześniejszy powrót do aktywności.
Do niedawna leczenie zachowawcze wiązało się z wyższym ryzykiem ponownego zerwania ścięgna (12,5% vs. 3,5%), dlatego też wielu lekarzy opowiadało się za leczeniem chirurgicznym. Ono z kolei może prowadzić do powikłań i infekcji podczas gojenia się rany. Dlatego też poszukuje się rozwiązań alternatywnych w celu zminimalizowania ryzyka zarówno postępowania chirurgicznego, jak i zachowawczego.
Bardzo obiecujące wydaje się stosowane w wielu ośrodkach leczenie zachowawcze obejmujące wczesną mobilizację (skrócenie okresu zastosowania gipsu) i rehabilitację funkcjonalną – okazuje się, że takie połączenie zmniejsza ryzyko ponownego zerwania ścięgna do poziomu podobnego jak przy leczeniu operacyjnym.
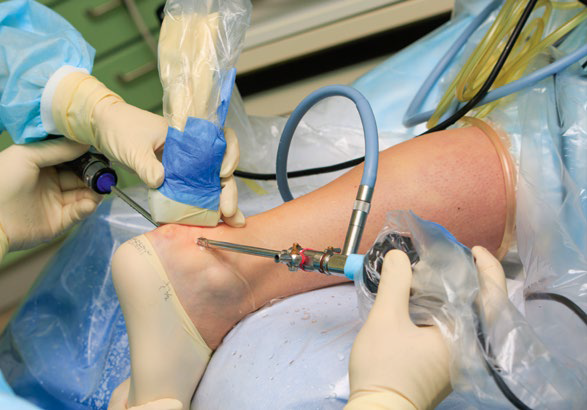
Niestety, istnieją obawy, że przy podejściu zachowawczym siła łydki będzie niższa niż po zastosowaniu leczenia operacyjnego, co skłania niektórych lekarzy do tego, by bardziej aktywnym pacjentom zalecać leczenie chirurgiczne. To ostatnie także przechodzi ewolucję ku minimalnie inwazyjnym i przezskórnym technikom operowania – w celu zmniejszenia ryzyka powikłań, jakie towarzyszy chirurgii otwartej18.
W 2021 r. opublikowano metaanalizę badań autorstwa kanadyjskich naukowców na temat metod leczenia ostrego zerwania ŚA. Porównuje ona takie strategie terapeutyczne jak chirurgia otwarta, chirurgia małoinwazyjna, rehabilitacja funkcjonalna i unieruchomienie. Autorzy stwierdzają, że leczenie poprzez unieruchomienie wiąże się z większym ryzykiem ponownego zerwania ścięgna niż chirurgia otwarta, a poza tym nie wystąpiły żadne różnice między tymi metodami odnośnie do ryzyka ponownego zerwania. Pierwsze miejsce w porównaniu zajęła chirurgia małoinwazyjna, jako że daje ona mniej powikłań niż chirurgia otwarta i wiąże się z niższym ryzykiem komplikacji prowadzących do (ponownej) operacji niż rehabilitacja funkcjonalna, chirurgia otwarta czy unieruchomienie. Natomiast unieruchomienie i chirurgia otwarta mają porównywalne ryzyko powikłań prowadzących do (ponownej) operacji19.
Rehabilitacja ścięgna Achillesa
Fizjoterapia stanowi nieodłączną część leczenia – czy to zachowawczego, czy operacyjnego.
W tym roku ukazał się belgijski przegląd badań nad tzw. przyspieszoną rehabilitacją w leczeniu zachowawczym zerwania ŚA. Autorzy piszą, że wciąż trwają dyskusje nad optymalnym sposobem postępowania przy zerwaniu ŚA, natomiast obserwuje się rosnącą tendencję w kierunku wczesnej mobilizacji. Przeanalizowali oni dostępne dane naukowe na temat przyspieszonej rehabilitacji i doszli do wniosku, że brak jest statystycznie znaczących różnic, które świadczyłyby o wyższości tego podejścia nad bardziej tradycyjnymi. Z drugiej strony nie stwierdzono żadnych powodów, by tego podejścia nie stosować – naukowcy wręcz zalecają przyspieszoną rehabilitację w odniesieniu do wszystkich pacjentów leczonych zachowawczo, ponieważ jest to opcja bezpieczna i często preferowana przez pacjentów, jako że pozwala na uniknięcie niedogodności związanych z przedłużonym unieruchomieniem20.
W rehabilitacji po zerwaniu ścięgna Achillesa
pomocne są specjalne buty ortopedyczne.
W południowokoreańskim artykule przeglądowym z 2020 r. czytamy, że rehabilitacja funkcjonalna jest skuteczna pod warunkiem odpowiedniego poinformowania pacjenta i współpracy z jego strony. Protokół takiej rehabilitacji w ramach leczenia zachowawczego przewiduje noszenie ortezy zapobiegającej nadmiernemu zgięciu grzbietowemu stawu skokowego przez 8 tygodni. W okresie do 6 miesięcy po urazie stopniowo wprowadza się czynności o niskiej intensywności, a po tym okresie można podejmować czynności o wysokiej intensywności (takie jak piłka nożna czy koszykówka). Rehabilitacja powinna być dość intensywna w pierwszym roku po urazie, a zwłaszcza w pierwszym półroczu. Pierwszy rok jest kluczowy, ponieważ badania sugerują, że po tym czasie przywrócenie siły mięśni łydki do poziomu sprzed urazu jest niemożliwe.
Jeśli chodzi o leczenie operacyjne, niesłychanie ważną rolę w procesie terapeutycznym odgrywa również wczesna rehabilitacja funkcjonalna. Według badań wczesne obciążanie nogi, połączone z wczesnymi ćwiczeniami ruchu stawu skokowego, było skuteczniejsze w rekonwalescencji pooperacyjnej niż unieruchomienie lub same wczesne ćwiczenia ruchu stawu skokowego. Między innymi Brumann i wsp. podkreślają wagę przyspieszonej rehabilitacji. Zalecenia z ich programu obejmują pełne obciążanie kończyny dolnej przy zgięciu podeszwowym pod kątem 30° od razu po operacji oraz – po upływie dwóch tygodni od operacji – kontrolowaną mobilizację stawu skokowego w nieograniczonym zgięciu podeszwowym i zgięciu grzbietowym ograniczonym do 0°21.
Ogólnie rzecz biorąc, przedłużone unieruchomienie po operacji jest niewskazane, zwłaszcza trwające powyżej 3 tygodni. Zalecane jest obciążanie kończyny w ortezie bezpośrednio po operacji lub najpóźniej w ciągu 3. tygodnia po operacji. Ortezę należy nosić przez 6-8 tygodni. Podczas ćwiczeń wykonywanych bez ortezy pacjent powinien unikać nadmiernego zgięcia grzbietowego stawu skokowego22.
Przykład protokołu rehabilitacji ścięgna Achillesa
W 2019 r. Glazebrook i Rubinger opublikowali swój protokół leczenia zachowawczego zerwania ścięgna Achillesa. Terapia rozpoczyna się od unieruchomienia na 2 tygodnie kończyny w pozycji maksymalnego biernego zgięcia podeszwowego, najlepiej za pomocą gipsu. Po upływie tego czasu nogę umieszcza się w bucie ortopedycznym, z uniesieniem pięty pod kątem 40°, i wdrażany jest protokół działań pod nadzorem fizjoterapeuty. Polega on na rozpoczęciu obciążania kończyny, przy czym pacjent opiera się na kulach. Początkowo stosuje się obciążenie 25-proc. i stopniowo, tydzień po tygodniu się je zwiększa, aż do 100-proc. w 4. tygodniu fizjoterapii. Jednocześnie wykonuje się ćwiczenia aktywnego zginania podeszwowego i grzbietowego do pozycji neutralnej i z inwersją/ewersją poniżej pozycji neutralnej. Stosowana może być elektrostymulacja mięśni łydki z unoszeniem pięty w pozycji siedzącej. Wizyty odbywają się 2-3 razy w tygodniu (w zależności od intensywności bólu i opuchlizny stopy i stawu skokowego). Wykonywane są także ćwiczenia stawów kolanowych i biodrowych niewiążące się z ruchem stawu skokowego (np. unoszenie nóg w siedzeniu, leżeniu na brzuchu lub na boku). Prowadzony jest trening kardio nieobciążający chorej kończyny, np. jazda na rowerze przy pomocy jednej nogi. Możliwe jest zastosowanie hydroterapii. Ważne jest, by pacjent podczas ćwiczeń zwracał uwagę na ból i wycofywał się z danych czynności, jeśli ból wystąpi.
W tygodniach od 2. do 4. fizjoterapii podczas elektrostymulacji mięśni łydki pacjent unosi łydkę w leżeniu (ważne, by podczas ćwiczeń staw skokowy był w pozycji neutralnej). Pacjent powinien wykonywać czynności kardio w bucie ortopedycznym.
Bardzo dobre wyniki leczenia daje chirurgia małoinwazyjna.
W ciągu kolejnych dwóch tygodni (4.-6. tydzień fizjoterapii) elektrostymulacja mięśni łydki łączona jest z ćwiczeniami wzmacniającymi. Stopniowo zmniejsza się uniesienie pięty w bucie ortopedycznym. Zwykle obciążenie kończyny (nadal w bucie ortopedycznym) dochodzi już do 100%. Wdrażane są ćwiczenia oporowe (otwarty i zamknięty łańcuch kinetyczny oraz czynności funkcjonalne) – początkowo ze sprężyną lub taśmą oporową. Wdrażany jest trening chodu, a trening kardio zaczyna obejmować obciążanie kończyny (np. jazda na rowerze). Prowadzona jest hydroterapia.
W tygodniach od 6. do 10. fizjoterapii pacjent powinien wiedzieć, że ścięgno nadal jest bardzo wrażliwe, należy więc zachować ostrożność przy czynnościach życia codziennego i ćwiczeniach. Nagłe obciążenie ścięgna (np. przy potknięciu się) może skutkować ponownym zerwaniem. Przeprowadzany jest proces (zwykle trwający 2-5 dni) zdejmowania buta ortopedycznego. Po jego zdjęciu nakładana jest na staw skokowy specjalna opaska kompresyjna zapewniająca dodatkową stabilność i kontrolę obrzęku. Pacjent może stosować kule lub laskę w razie potrzeby i powinien chodzić w butach (ograniczać czas spędzany w skarpetkach/boso). Nadal prowadzone są ćwiczenia na zakres ruchu stawu, siłę oraz ćwiczenia propriocepcji. Dodawane są nowe ćwiczenia, np. na bieżni. Dodawane są również ćwiczenia na platformie do ćwiczeń równoważnych (ale przy blokadzie zgięcia grzbietowego poza pozycję neutralną). Wykonywane są (ostrożnie) ćwiczenia rozciągające łydkę w pozycji stojącej oraz unoszenie pięty (bez wychodzenia poza pozycję neutralną).
W tygodniach od 10. do 14. fizjoterapii następuje progresja ćwiczeń na zakres ruchu, siłę i ćwiczeń propriocepcji.Pacjent powinien unikać przysiadów i wypadów nogą w przód (by nie rozciągać ścięgna nadmiernie).
Po 14. tygodniu zwiększane są dynamiczne ćwiczenia z obciążeniem kończyny i wdrażany jest powrót do sportu. W miesiącach od 6. do 9. możliwy jest powrót do normalnej aktywności sportowej niewiążącej się z kontaktem, sprintem ani skakaniem (jeśli pacjent odzyskał 80% siły). A po 12. miesiącu, jeśli pacjent odzyskał 100% siły, możliwy jest pełny powrót do sportu pod kierownictwem zespołu medycznego.
Autorzy zaznaczają, że protokół ten nie nadaje się do zastosowania w niektórych przypadkach, np. jeśli doszło do oderwania ścięgna od kości piętowej lub do rozdarcia mięśnia łydki, jeśli staw skokowy pacjenta nie został umieszczony w gipsie (zgięcie podeszwowe) w ciągu 48 godzin od urazu, jeśli w przeszłości ścięgno Achillesa doznało poważnego urazu lub jeśli istnieją czynniki zwiększające ryzyko ponownego zerwania (cukrzyca, terapia immunosupresyjna, fluorochinolony)23.
Naderwanie ścięgna Achillesa
Jak piszą Gatz i wsp., naderwanie ścięgna Achillesa występuje dość rzadko i często jest błędnie diagnozowane jako pogorszenie tendinopatii. Niewiele jest także dostępnej literatury naukowej na temat tego problemu medycznego, trudno więc formułować jakiekolwiek wytyczne. Na podstawie kilku badań i własnego doświadczenia klinicznego autorzy zalecają stawianie diagnozy w oparciu o wywiad, w którym typowo mowa o nagłym pojawieniu się bólu i niemożności pełnego obciążania ścięgna. Przed naderwaniem pacjent mógł otrzymywać do ścięgna zastrzyki z kortyzonu. W badaniu klinicznym stwierdza się tkliwość w obrębie ścięgna i często słabość podczas podnoszenia pięty. W badaniach obrazowych (USG i badanie dopplerowskie) widoczny jest obszar z nieregularnym i uwypuklonym zarysem ścięgna, często z miejscowo zwiększonym przepływem krwi. Na skanach MRI w ścięgnie widoczny jest obszar hiperintensywny w sekwencjach T1- i T2-zależnych.
Terapia pierwszego wyboru to podejście zachowawcze, polegające na uniesieniu pięty o 2 cm na pierwsze 6 tygodni i unikaniu rozciągania ścięgna przez 12 tygodni. Po 6 tygodniach uniesienie pięty zmniejsza się do 1 cm i w tygodniach od 7. do 12. przeprowadza się progresywne obciążanie ścięgna. Po 12 tygodniach usuwa się uniesienie pięty, jeśli nie powoduje to bólu. Pacjent może stopniowo podejmować ćwiczenia ekscentryczne z obniżaniem pięty poniżej poziomu podłogi. Możliwy jest także stopniowy powrót do sportu.
Jeśli leczenie zachowawcze daje słabe wyniki, wymagane jest leczenie chirurgiczne, a po nim, przed powrotem do pełnego obciążania ścięgna, zalecany jest program rehabilitacji trwający od 12 do 14 tygodni (taki jak w leczeniu zachowawczym)24.
Podsumowując, ścięgno Achillesa to struktura narażona na przeciążenia, ulegająca degeneracji i podatna na urazy. Trudno sobie wyobrazić leczenie tendinopatii lub zerwania tego ścięgna bez fizjoterapii, która odgrywa niezwykle ważną rolę w przywracaniu pacjentom sprawności.
- Del Buono A. et al., Int Orthop. 2013 Apr; 37(4): 715-721.
- Maffulli N. et al., Foot Ankle Surg. 2020 Apr; 26(3): 240-249.
- Knapik J.J., Pope R., J Spec Oper Med. 2020 Spring; 20(1): 125-140.
- Kujala U.M. et al., Clin J Sport Med. 2005; 15:133.
- Pearce C.J., Tan A., EFORT Open Rev. 2016 Nov; 1(11): 383-390.
- Chimenti R.L. et al., Foot Ankle Int. 2017 Oct; 38(10): 1160-1169.
- de Vos R.J. et al., Br J Sports Med. 2021; 55: 1125-1134.
- Wiegerinck J.I. et al., Knee Surg Sports Traumatol Arthorsc. 2013; 21: 1345-1355.
- Jarin I. et al., Foot Ankle Int. 2020 Jun; 41(6): 744-754.
- Sánchez-Sánchez J.L. et al., J Orthop Res Ther. 2020; 5: 1173.
- Chang Y.P. Et al., J Orthop Sports Phys Ther. 2015 Jul; 45(7): 563-569.
- Gemalmaz H.C. et al., Acta Orthop Traumatol Turc. 2018 Nov; 52(6): 452-458.
- Arquer A. et al., Apunts Sports Medicine. 2014 Apr-Jun; 49(182): 31-36.
- Sheth U. et al., Bone Joint J. 2017; 99B-78.
- Leppilahti J., Orava S., Sports Med. 1998; 25:79.
- Hess. G.W. Foot and Ankle Specialist. 2009. 3(1): 29-32.
- Boyd RPR et al., Br J Gen Pract. 2015 Dec; 65(641): 668-669.
- Meulenkamp B. et al., Syst Rev. 2018 Dec 23; 7(1): 247.
- Meulenkamp B. et al., Clin Orthop Relat Res. 2021 Oct 1; 479(10): 2119-2131.
- Coopmans L. et al., J Foot Ankle Surg. 2022 Jan-Feb; 61(1): 157-162.
- Brumann M. et al., Injury. 2014; 45(11): 1782-1790.
- Park S.H. et al., Clin Orthop Surg. 2020 Mar; 12(1): 1-8.
- Glazebrook M., Rubinger D., Foot Ankle Clin. 2019 Sep; 24(3): 387-398.
- Gatz M. et al., J Clin Med. 2020 Oct; 9(10): 3380.
- Fisher S. et al., Handchir Mikrochir Plast Chir. 2015; 47(04): 253-267.
- Sahin M.T. et al., J Drugs Dermatol. 2012 Jan 1; 11(1): 74-81.
- Maragakis M. et al., Drugs Exp Clin Res. 1995; 21(5): 199-206.