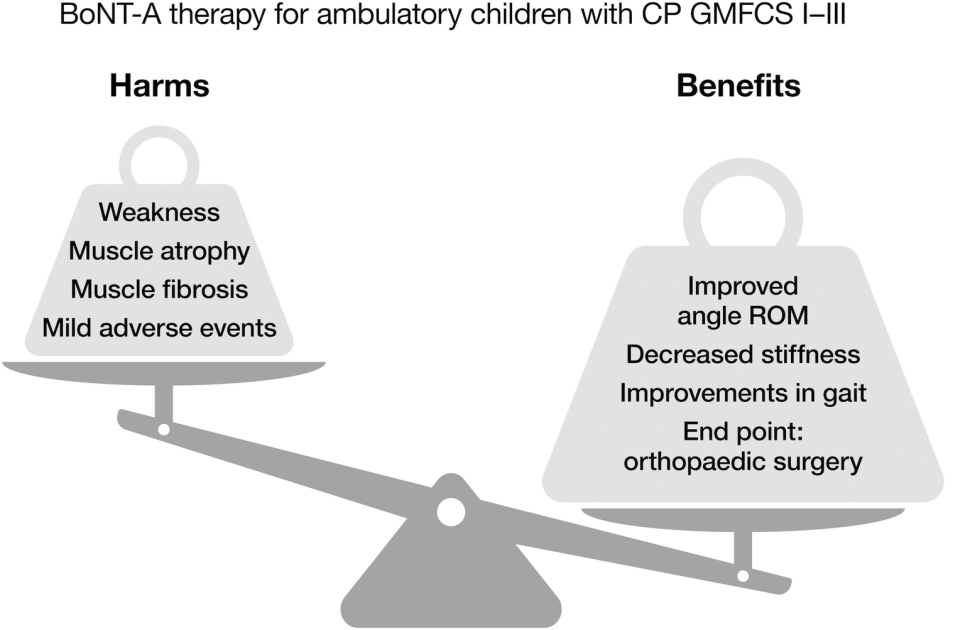
Wstrzyknięcie toksyny botulinowej typu A (BoNT-A) jest skuteczne w zmniejszaniu nadmiernej aktywności mięśni u dzieci z porażeniem mózgowym. U niektórych dzieci z porażeniem mózgowym powoduje to zmniejszenie siły i napięcia mięśniowego z niewielką, krótkotrwałą poprawą chodu i funkcji. Osiąga się to kosztem zaniku mięśni, który może nie być całkowicie odwracalny. Szkodliwe skutki zaniku mięśni mogą być związane z funkcją mięśnia docelowego.
Wstrzyknięcia BoNT-A są generalnie bezpieczne dla dziecka, ale istnieje miejscowe ryzyko dla wstrzykniętego mięśnia u dziecka poruszającego się i istnieje zwiększone ryzyko ogólnoustrojowych zdarzeń niepożądanych u dzieci nie poruszających się. Istnieją podstawy do modyfikacji istniejących protokołów wstrzyknięć i konieczne są dalsze badania w celu oceny długoterminowych skutków i ryzyka w stosunku do korzyści wstrzyknięć BoNT-A w mięśnie szkieletowe u dzieci z porażeniem mózgowym. Czas przejścia od terapii BoNT-A do ostatecznego wydłużenia ścięgna mięśnia powinien być dokładnie rozważony przez zespół multidyscyplinarny.
1 Wprowadzenie
W tym przeglądzie zdajemy sobie sprawę ze złożoności porażenia mózgowego, naszego braku wiedzy na temat patofizjologii i mechanizmów prowadzących od hipertonii do przykurczów oraz tego, jak niewiele wiadomo na temat długoterminowych skutków jednej z najczęściej stosowanych interwencji, toksyny botulinowej typu A (BoNT-A). Cytat przypisywany Wolterowi może być odpowiedni:
Pierwsze doniesienia dotyczące stosowania BoNT-A u dzieci z mózgowym porażeniem dziecięcym (MPD) zostały opublikowane przez Komana i wsp. w Stanach Zjednoczonych w 1993 r. oraz przez Grahama i wsp. w Wielkiej Brytanii w 1994 r.1,2. Od tego czasu stosowanie BoNT-A stało się „standardem opieki” nad dziećmi z CP w wielu krajach, prowadząc do powszechnego stosowania klinicznego oraz publikacji i rozpowszechniania oświadczeń konsensusu3-6. Istnieje potrzeba przeglądu najnowszej literatury w celu modyfikacji istniejących protokołów BoNT-A w świetle ostatnich badań na zwierzętach i badań klinicznych, które wzbudziły obawy dotyczące uszkodzenia wstrzykniętego mięśnia7. Gough i wsp. jako pierwsi zgłosili obawy dotyczące stosowania BoNT-A u dzieci z CP8. Zakwestionowali oni stosowanie środka, którego mechanizm działania polega na powodowaniu osłabienia, w celu leczenia stanu charakteryzującego się osłabieniem. Podnieśli oni również kwestię potencjalnego długotrwałego wpływu przed wieloma ostatnimi pracami eksperymentalnymi na modelach zwierzęcych7,8.
Najczęstszym wskazaniem do terapii BoNT-A w CP jest leczenie ogniskowej nadaktywności mięśni w celu poprawy chodu i funkcji u dzieci, które mogą chodzić1,2. Wstrzyknięcie do kończyny górnej w celu poprawy postawy i funkcji jest drugim najczęstszym wskazaniem do terapii BoNT-A u dzieci z CP9,10. Stosowanie BoNT-A u niechodzących dzieci z CP również zasługuje na dyskusję, biorąc pod uwagę niejednorodne wskazania i ryzyko ogólnoustrojowych zdarzeń niepożądanych11,12. Wstrzyknięcia BoNT-A mogą być również stosowane jako środek przeciwbólowy, szczególnie gdy ból jest związany ze skurczem mięśni3.
W ostatnich latach pojawiło się wiele podstawowych badań naukowych na zwierzętach opisujących skutki BoNT-A przy użyciu technik inwazyjnych, które nie byłyby możliwe u dzieci7. Badania te mogą mieć znaczenie dla protokołów BoNT-A i również zostaną omówione.
1.1 Obrazowanie mięśni
Zastosowanie ultradźwięków w leczeniu BoNT-A jest ważne z dwóch powodów. Po pierwsze, ultrasonografia dwuwymiarowa (2DUS) stała się preferowaną techniką obrazowania mięśni podczas procedury iniekcji13. Po drugie, trójwymiarowa ultrasonografia (3DUS) dostarczyła istotnych nowych informacji dotyczących naturalnej historii rozwoju mięśni u dzieci z CP, a także zmian po wstrzyknięciu BoNT-A14,15.
1.2 Preparaty toksyny botulinowej i ostrzeżenie/zrzeczenie się odpowiedzialności
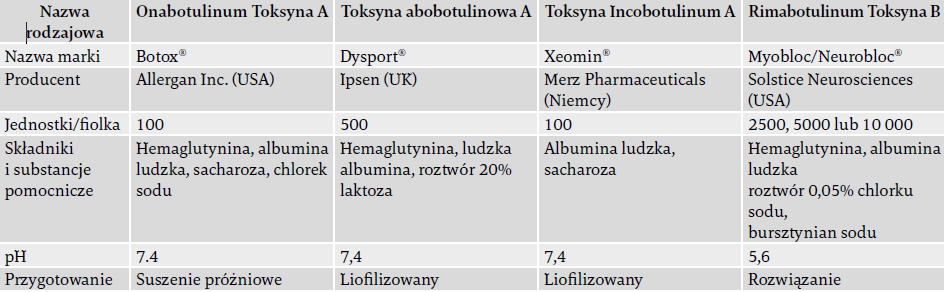
Nowe preparaty neurotoksyn botulinowych są regularnie opracowywane i wprowadzane na rynek. Istnieją obszerne dane kliniczne dotyczące tylko dwóch preparatów typu A, toksyny onabotulinowej A (Botox®, Allergan) i toksyny abobotulinowej A (Dysport®, Ipsen, Wielka Brytania), stosowanych u dzieci z CP1-6, 9, 11, 12, 16, 17. Pojawia się coraz więcej informacji na temat stosowania preparatu Xeomin® firmy Merz Pharmaceuticals z Niemiec oraz kilku preparatów z Korei i Chin (Tabela 1)18. Nowe preparaty, które są opracowywane, to toksyny typu A o różnych formułach pod względem dodatkowych białek i innych substancji pomocniczych18. Efekty kliniczne mogą być podobne do istniejących preparatów, ale prawie na pewno wystąpią różnice, które będą wymagały dalszych badań i prób klinicznych. Istnieją ograniczone informacje kliniczne dotyczące stosowania ostatnio wprowadzonych toksyn, a poniższe ostrzeżenie/zastrzeżenie jest istotne.
Neurotoksyny botulinowe są najsilniejszymi toksynami biologicznymi znanymi w świecie przyrody. Nadal zdarzają się zgony spowodowane spożyciem toksyny botulinowej w postaci zatrucia pokarmowego, a także zgony spowodowane toksyną botulinową wstrzykiwaną w celach medycznych i terapeutycznych. Licencjonowanie i rejestracja preparatów toksyny botulinowej różnią się w zależności od kraju, a etykietowanie może być specyficzne dla wskazań w ramach każdej jurysdykcji18,19. W krajach, w których preparaty zostały zatwierdzone, wiele aktualnych wskazań klinicznych ma charakter „pozarejestracyjny”18-20.
2 Definicja porażenia mózgowego (CP)
Międzynarodowa definicja CP, opracowana w 2005 roku, jest następująca:
„Grupa trwałych zaburzeń rozwoju ruchu i postawy, powodujących ograniczenie aktywności, które przypisuje się nieprogresywnym zaburzeniom występującym w rozwijającym się mózgu płodu lub niemowlęcia. Zaburzeniom ruchowym w CP często towarzyszą zaburzenia czucia, percepcji, poznania, komunikacji i zachowania, padaczka i wtórne problemy mięśniowo-szkieletowe”21.
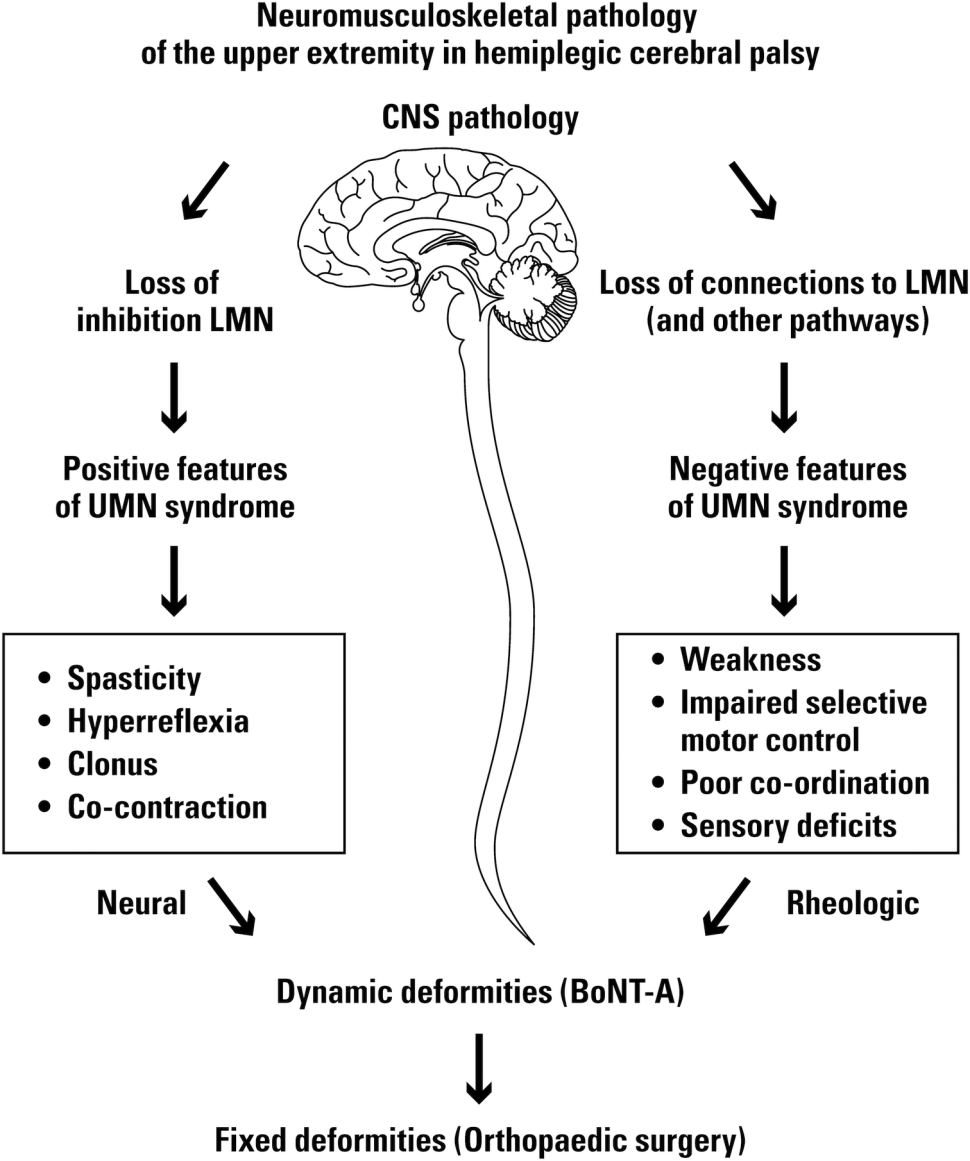
CP jest terminem zbiorczym obejmującym szeroki zakres zaburzeń mózgowych, ze wspólnym stwierdzeniem zaburzeń motorycznych, rozpoczynających się we wczesnym dzieciństwie22 (ryc. 1). Chociaż uszkodzenie mózgu jest statyczne, skutki zajęcia neurologicznego są dynamiczne i zmieniają się wraz z upływem czasu i rozwojem dziecka22,23 (ryc. 2). CP można zdefiniować jako „statyczną encefalopatię z postępującą patologią układu mięśniowo-szkieletowego”23,24. Progresja dynamicznego przykurczu do utrwalonego przykurczu jest podstawową kwestią leżącą u podstaw skutecznego stosowania BoNT-A 22,23 (ryc. 1 i 2). Mechanizmy, za pomocą których zmiany w OUN są wyrażane jako zaburzenia ruchowe, są złożone, podobnie jak mechanizmy leżące u podstaw progresji do utrwalonej deformacji układu mięśniowo-szkieletowego19,25. Większość mięśni u dzieci z CP wykazuje połączenie nadaktywności mięśni (dynamiczny przykurcz) z pewnym elementem stałego skrócenia. Deformacja mięśni może być bardziej związana z upośledzonym wzrostem mięśni i zmienioną adaptacją niż ze spastycznością25. Jednak w chwili obecnej dysponujemy interwencjami, które dotyczą nadmiernej aktywności mięśni (BoNT-A) oraz interwencjami w przypadku utrwalonego przykurczu, które obejmują wydłużenie ścięgien mięśni, stąd uproszczony schemat przedstawiony na ryc. 2. Pełniejszą dyskusję można znaleźć w hipotezach omówionych przez Gougha i Shortlanda oraz w przeglądzie morfologii mięśni w CP autorstwa Barretta i Lichtwarka25,26.
3 Klasyfikacja CP
3.1 Rozkład topograficzny
Najczęstszymi typami CP są hemiplegia (dotknięta jest jedna strona ciała), diplegia (dotknięte są obie kończyny dolne z drobnymi problemami motorycznymi ograniczonymi do kończyn górnych) i quadriplegia, w której dotknięte są wszystkie cztery kończyny19. Klasyfikacja topograficzna jest przydatna, ponieważ identyfikuje segmenty kończyn, w których może występować hipertonia wymagająca interwencji. Nie jest ona jednak zbyt wiarygodna, a precyzyjna klasyfikacja nie zawsze jest możliwa. Doprowadziło to kolegów w Europie do uproszczenia rozkładu topograficznego do „jednostronnego” i „obustronnego”27.
3.2 Funkcja motoryki dużej
Gross Motor Function Classification System (GMFCS) to pięciopoziomowy system klasyfikacji porządkowej oparty na ocenie samodzielnie inicjowanych ruchów, z naciskiem na funkcje podczas siedzenia, stania i chodzenia28. Wykazano, że jest to ważna, wiarygodna, stabilna i klinicznie istotna metoda klasyfikacji i przewidywania funkcji motorycznych u dzieci z CP w wieku od 2 do 18 lat. GMFCS jest ważny przy stosowaniu terapii BoNT-A, ponieważ wskazania i profil zdarzeń niepożądanych różnią się w zależności od poziomu GMFCS19.
3.3 Zaburzenia ruchowe
W ostatnich latach wykonano wiele pracy w celu ujednolicenia definicji zaburzeń ruchowych, a czytelnik jest odsyłany do tych monografii w celu uzyskania dalszych informacji29,30. U większości dzieci z CP występuje hipertonia, jako jedna z cech spastyczności19,30. Spastyczne MPD jest najczęstszym rodzajem zaburzeń ruchowych, stanowiącym około 60-85% wszystkich przypadków MPD w krajach rozwiniętych27,31. Powszechnie stosowaną definicją spastyczności jest „zależny od prędkości opór przed biernym ruchem stawu i związanej z nim muskulatury”. Historycznie termin ten obejmował wiele elementów całego zespołu górnego neuronu ruchowego (UMN)29,30,32. Spastyczność, wraz z innymi cechami zespołu UMN, prowadzi do utraty zdolności mięśnia do rozciągania się w stanie rozluźnienia, co z kolei może upośledzać podłużny wzrost mięśnia33. Dyskinetyczne CP dotyka od 10 do 25% dzieci i charakteryzuje się ruchami mimowolnymi, zmiennym napięciem mięśniowym oraz niezdolnością do dokładnego wykonywania i koordynowania prostych zadań. Dyskinetyczne zaburzenia ruchowe mogą być atetotyczne, dystoniczne lub pląsawicze30. CP z ataksją występuje stosunkowo rzadko, stanowiąc < 5% dzieci z CP19,31.
3.4 Międzynarodowa Klasyfikacja Funkcjonowania
Międzynarodowa Klasyfikacja Funkcjonowania (ICF) Światowej Organizacji Zdrowia (WHO) opisuje warunki zdrowotne w kilku domenach, w tym strukturę i funkcję ciała, aktywność i uczestnictwo, zmodyfikowane zarówno przez czynniki środowiskowe, jak i osobiste, jak wskazano na ryc. 334. Istnieje wiele narzędzi do pomiaru parametrów u dzieci z CP w domenach ICF, a nowe narzędzia pomiarowe są w trakcie opracowywania. Wiele tradycyjnych miar budowy i funkcji ciała pochodzi sprzed opracowania ICF, a klinicyści i badacze nie zawsze są zgodni co do tego, która miara należy do której domeny. Najnowsze narzędzia do pomiaru aktywności i uczestnictwa zostały zaprojektowane pod kątem adekwatności do zadań22,34.
3.5 Postępująca patologia układu mięśniowo-szkieletowego
Dzieci z CP nie mają przykurczów, zwichnięcia stawu biodrowego lub deformacji kręgosłupa po urodzeniu22. Utrwalona patologia układu mięśniowo-szkieletowego zwykle rozwija się w dzieciństwie19,23,24.
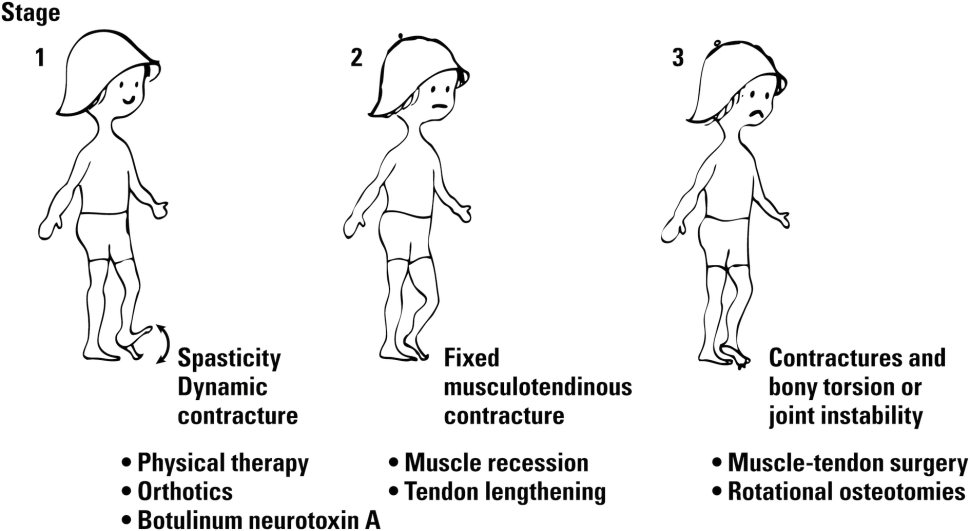
W literaturze można znaleźć wiele stwierdzeń łączących przykurcze ze spastycznością, ale patogeneza przykurczów mięśni jest bardziej skomplikowana niż obecność spastyczności25,26. Częste rozciąganie rozluźnionych mięśni szkieletowych jest warunkiem wstępnym prawidłowego wzrostu mięśni23. U dzieci z CP mięśnie szkieletowe są często hipertoniczne i nie rozluźniają się łatwo. Są one rzadziej rozciągane z powodu zmniejszonej aktywności fizycznej i współskurczu antagonistycznego19,26. Patologię kończyn można dla uproszczenia rozważyć w trzech etapach, ale w rzeczywistości etapy te nakładają się na siebie i stanowią złożone kontinuum (ryc. 2).
4 Skale pomiarowe i miary wyników
4.1 Pomiar spastyczności: Zmodyfikowane skale Ashwortha i Tardieu
Zmodyfikowana Skala Ashwortha (MAS) jest najczęściej stosowaną skalą do pomiaru spastyczności u dzieci z CP, pomimo problemów z jej trafnością i rzetelnością35,36. Konieczne jest uwzględnienie zarówno jej użyteczności, jak i ograniczeń w klinice oraz w zrozumieniu wyników badań19,35,36.
Zmodyfikowana Skala Tardieu (MTS) ocenia jakość reakcji mięśni na bierne rozciąganie i mierzy dynamiczny komponent spastyczności mięśni. Aby zmierzyć komponent dynamiczny, staw jest poruszany tak szybko, jak to możliwe w pełnym zakresie ruchu. Kąt, w którym mięśnie po raz pierwszy „łapią”, czyli gdy aktywowany jest odruch rozciągania, jest mierzony jako R1. Kąt pełnego pasywnego zakresu ruchu (ROM) to R2. Różnica między tymi kątami (R2-R1) odzwierciedla potencjalny zakres ruchu dostępny dla dziecka, gdyby można było wyeliminować spastyczność (składnik dynamiczny).
Uważa się, że MTS stanowi znaczną poprawę i jest bardziej użyteczny niż MAS37,38. Niemniej jednak, zarówno MAS, jak i MTS mają ograniczenia, zarówno w zakresie trafności, jak i rzetelności35-38. Z tego powodu kilka grup badawczych podjęło wysiłki w celu obiektywnego pomiaru spastyczności i ROM stawów przy użyciu metod biomechanicznych39,40.
Skale porządkowe, takie jak MAS, są podatne na stronniczość. W naszym pierwszym podwójnie ślepym, randomizowanym, kontrolowanym placebo badaniu (RCT) dotyczącym stosowania BoNT-A w kończynie górnej dzieci z hemiplegią, zawarliśmy pytanie do fizjoterapeutów i rodziców dzieci zapisanych do badania. Zapytaliśmy: „Czy uważasz, że Twojemu dziecku wstrzyknięto Botox lub placebo?”9. Większość terapeutów i rodziców prawidłowo określiła, czy ich dziecku wstrzyknięto aktywny lek czy placebo, pomimo starannych środków mających na celu zapewnienie, że zastrzyki były podawane w sposób podwójnie ślepy. Doświadczenie to zostało powtórzone w drugim RCT badającym potencjalną rolę wstrzyknięcia BoNT-A jako środka przeciwbólowego, z tym samym wynikiem41. Dlatego też, mimo że wiele badań klinicznych jest opisywanych jako badania z pojedynczą lub podwójnie ślepą próbą, zarówno klinicyści, jak i rodzice (którzy często wypełniają kwestionariusze) są w stanie określić na podstawie badania i obserwacji dziecka, czy dziecku wstrzyknięto aktywny lek, czy placebo. Sprawia to, że zaślepienie jest nieskuteczne, a także oznacza, że ryzyko stronniczości i efektu placebo w przypadku stosowania MAS, skal bólu lub pomiarów jakości życia (QoL) jest wysokie11,41.
4.2 Pasywny zakres ruchu za pomocą goniometrii
Pomiar ROM stawu jest powszechnie stosowaną miarą zastępczą długości ścięgien mięśni. Pomiar ROM stawu za pomocą goniometru jest stosowany w praktyce klinicznej i badaniach wyników stosowania BoNT-A 42. Dokładność i wiarygodność są poprawiane przez szkolenie i współpracę dwóch lekarzy, z których jeden stabilizuje staw, a drugi przykłada goniometr do rozpoznanych anatomicznych punktów orientacyjnych i odczytuje odpowiedni kąt. Wiarygodność pomiarów goniometrycznych można poprawić poprzez standaryzację przyłożonej siły i wykorzystanie cyfrowej fotografii anatomicznych punktów orientacyjnych, jak opisali Hastings-Ison i wsp.43.
4.3 Kanadyjskie skale pomiaru wydajności zawodowej i osiągania celów
Iniekcje BoNT-A są stosowane w celu osiągnięcia celów funkcjonalnych, które mają znaczenie dla dzieci z CP i ich rodziców. Z tych powodów różne formy Skali Osiągania Celów (Goal Attainment Scaling – GAS), jak również Kanadyjski Pomiar Wydajności Zawodowej (Canadian Occupational Performance Measure – COPM) zostały wykorzystane w celu dodania do MAS i MTS pomiaru wyników zgłaszanych przez pacjenta (PROM)44. COPM jest zindywidualizowaną miarą zaprojektowaną do wykrywania zmian w wydajności zawodowej w czasie44. GAS jest również stosowany jako zindywidualizowana miara wyników, szczególnie w przypadku atrybutów, dla których nie istnieje standardowa miara45. W idealnej sytuacji COPM jest wykorzystywany najpierw do identyfikacji celów funkcjonalnych dla GAS. Od trzech do pięciu celów interwencji jest wybieranych i skalowanych poprzez zastosowanie wyniku liczbowego. Zarówno COPM, jak i GAS są subiektywne, ale dają głos dziecku i rodzicowi lub opiekunowi. Biorąc jednak pod uwagę subiektywny charakter tych skal, należy je połączyć z obiektywnymi miarami wyników. Bez połączenia subiektywnych i obiektywnych miar wyników interpretacja zmian jest trudniejsza.
4.4 Ocena chodu dzieci poruszających się samodzielnie
Najczęstszym wskazaniem do stosowania terapii BoNT-A u dzieci z porażeniem mózgowym jest poprawa chodu1-6. U młodszych dzieci najczęstszą nieprawidłowością chodu jest chód na palcach, wtórny do spastycznego equinus19. U starszych dzieci najczęściej zgłaszanymi zaburzeniami chodu są zgięcie kolan (kucanie) i sztywność w okolicy kolan46,47. Złotym standardem oceny jest trójwymiarowa analiza chodu (3DGA), która dostarcza dokładnych, prawidłowych i wiarygodnych informacji dotyczących wzorca chodu dziecka19. Jest ona w stanie zidentyfikować zarówno odchylenia chodu, jak i odpowiedź na terapię BoNT-A 19,48. Jednak 3DGA ma ograniczoną dostępność i nie jest łatwe w użyciu u dzieci w wieku poniżej 3-4 lat lub poniżej jednego metra wzrostu. Biorąc pod uwagę, że terapia BoNT-A jest często stosowana u dzieci w wieku 2-4 lat, potrzebne są alternatywy dla 3-DGA1,2.
Opracowano wiele skal do oceny chodu u dzieci z CP, począwszy od Physician Rating Scale (PRS) opracowanej przez Komana i wsp. w 1994 roku49. Stwierdziliśmy jednak, że PRS ma słabą wiarygodność, co wymagało modyfikacji w badaniach klinicznych50. Od tego czasu obserwacyjna skala chodu (OGS) i Edynburska Wizualna Skala Chodu (EVGS) są szeroko stosowane i opisywane w literaturze51-53. Skale obserwacyjne najlepiej przeprowadzać przy użyciu dobrej jakości dwuwymiarowych nagrań wideo z opcją archiwizacji danych i odtwarzania wideo w zwolnionym tempie51-53. EVGS jest obecnie najlepszym dostępnym narzędziem obserwacyjnym do oceny chodu, gdy trójwymiarowa analiza chodu nie jest dostępna53. Wszystkie obserwacyjne skale chodu mają ograniczoną czułość w wykrywaniu niewielkich zmian po wstrzyknięciu BoNT-A i mają ograniczenia zarówno pod względem wiarygodności, jak i ważności. Ostatnie badania były w stanie wykryć zmiany w EVGS po terapii BoNT-A, ale nie potwierdziły klinicznie istotnej poprawy52.
Trójwymiarowa analiza chodu zapewnia obiektywną, prawidłową i wiarygodną dokumentację chodu u dzieci z CP19,45. Wcześniejsze badania wykorzystywały izolowane pomiary kinematyczne w kostce i kolanie i były w stanie wykryć poprawę po wstrzyknięciu BoNT-A 54. Niedawno zgłoszono również dynamiczną elektromiografię, kinetykę i statystyki podsumowujące chód, takie jak Gait Profile Score (GPS)55,56. Połączenie parametrów kinematycznych i podsumowującej statystyki ogólnego wzorca chodu (GPS) jest zalecane jako najwyższy poziom obiektywnej dokumentacji zmian w chodzie u dzieci z CP55,56.
4.5 Funkcja motoryki dużej
Złotym standardem pomiaru funkcji motoryki dużej jest pomiar funkcji motoryki dużej (GMFM), który okazał się ważny, wiarygodny i reagujący na klinicznie istotne zmiany57. GMFM wymaga około 1 godziny i jest przeprowadzany przez doświadczonych, przeszkolonych fizjoterapeutów. U dzieci, które potrafią chodzić, najbardziej istotne są wymiary D i E. Gdy GMFM jest stosowany jako podstawowa miara wyników w badaniach terapii BoNT-A, wyniki są mieszane58,59.
GMFCS jest ważny (oparty na GMFM), wiarygodny i stabilny u dzieci z porażeniem mózgowym60. Jest to ostateczne narzędzie do klasyfikacji obecnej funkcji dziecka i przewidywania przyszłej funkcji60. Nie był on przeznaczony do stosowania jako miara wyników i nie ma właściwości psychometrycznych, które pozwoliłyby na jego wykorzystanie w tym celu19.
4.6 Wskaźniki wyników dla dzieci nieobciążonych ambulatoryjnie
Terapia BoNT-A u niechodzących dzieci z CP została słabiej zbadana, a BoNT-A jest mniej odpowiednia u niechodzących dzieci niż u dzieci chodzących. Dzieci na poziomie IV i V GMFCS mają zazwyczaj mieszane zaburzenia ruchowe z uogólnioną hipertonią, która często jest ciężka i dotyczy wszystkich czterech kończyn, a także tułowia19,22. MAS, MTS, goniometrię i radiologię można połączyć w celu oceny kwestii związanych z hipertonią w domenach struktury ciała ICF22,34. Wiele dzieci niechodzących ma złożone choroby współistniejące19,22. Wstrzykiwanie wielu grup mięśni w sposób powtarzalny stwarza ryzyko poważnych zdarzeń niepożądanych, w tym poważnych zdarzeń oddechowych i śmiertelności61. W przypadku większości dzieci, które nie są ambulatoryjne, zarządzanie uogólnionym tonem może wymagać podawania leków doustnych lub procedury neurochirurgicznej, takiej jak wprowadzenie dożylnej pompy baklofenowej (ITB)62. U dzieci z GMFCS IV i V patologia układu mięśniowo-szkieletowego utrwala się z bardzo dużą częstością występowania przykurczów ścięgien mięśni, przykurczów stawów, zwichnięcia stawu biodrowego i deformacji kręgosłupa19,24. BoNT-A nie jest idealna jako standardowa terapia hipertonii u dzieci niechodzących, ponieważ tylko kilka z wielu hipertonicznych mięśni może być leczonych ze względu na ograniczenia całkowitej dawki BoNT-A1-6. Najbardziej przydatnymi miarami wyników w GMFCS IV i V mogą nie być miary struktury i funkcji ciała, w oderwaniu od siebie. Stan zdrowia, jakość życia związaną ze zdrowiem (HRQoL) i obciążenie opiekuna można wiarygodnie określić za pomocą kwestionariusza CPCHILD©63.
4.7 Pomiary wyników dla kończyny górnej
Funkcja kończyny górnej jest bardziej złożona niż funkcja chodu i w większym stopniu wpływa na nią upośledzenie czucia, propriocepcji i selektywnej kontroli motorycznej22. Odpowiednikiem systemu klasyfikacji GMFCS do klasyfikacji funkcji motoryki dużej kończyny górnej jest Manual Ability Classification System (MACS)64. Bardziej złożone systemy klasyfikacji, które mogą być również wykorzystywane jako miary wyników, obejmują klasyfikację House’a 65. Ogólne miary hipertonii i spastyczności, takie jak MAS i MTS, są szeroko stosowane w kończynach górnych u dzieci z CP35-37. COPM i GAS mają również zastosowanie, ponieważ mogą być zindywidualizowane do celów dziecka i rodziny i nie są specyficzne dla funkcji kończyn dolnych44,48. Specyficzne miary wyników o dobrych lub doskonałych właściwościach psychometrycznych dla kończyny górnej u dzieci z CP obejmują ABILHANDS-Kids, Assisting Hand Assessment (AHA), Melbourne Assessment of Unilateral Upper Limb Function (MUUL) i Shriners Hospitals for Children Upper Extremity Evaluation (SHUEE). Pomiary wyników dla kończyny górnej zostały szczegółowo omówione w innym miejscu66,67.
5 Interwencje w przypadku spastyczności i dystonii
Wybór interwencji w leczeniu zaburzeń ruchowych związanych z CP u dzieci jest szeroki19. Na pierwszy rzut oka może być trudno określić, na podstawie jakich kryteriów należy dokonać wyboru spośród wielu opcji. Niektórzy zauważyli, że o wyborze decyduje „bardziej szczęście niż osąd”68. Leki doustne są coraz częściej stosowane jako leki pierwszego rzutu w leczeniu spastyczności i dystonii u dzieci z CP. Leki te obejmują baklofen, diazepam, tizanidynę i rzadziej dantrolen69,70. Artan i l-dopa są obecnie testowane w leczeniu dystonii70. Większość leków doustnych jest ograniczona przez połączenie ograniczonych korzyści i wysokiej częstości występowania działań niepożądanych19,69,71. Leki stosowane zarówno w leczeniu spastyczności, jak i dystonii zostały szczegółowo omówione w innych miejscach i nie będą tu dalej omawiane69-72. W niektórych badaniach analizowano korzyści płynące ze stosowania doustnego leczenia spastyczności za pomocą tizanidyny lub baklofenu w połączeniu z ogniskowymi wstrzyknięciami neurolitycznymi BoNT-A do mięśni hipertonicznych73,74. Inni badali połączenie zastrzyków BoNT-A i fenolu75.
Zabiegi neurochirurgiczne w przypadku hipertonii obejmują selektywną rizotomię grzbietową (SDR) w przypadku spastyczności, wszczepienie ITB lub wszczepienie elektrod do głębokiej stymulacji mózgu (DBS) w przypadku różnych form hipertonii19,76,77.
Chemodenerwacja poprzez wstrzyknięcie środków neurolitycznych ma długą historię w leczeniu ogniskowej i regionalnej spastyczności. Neuroliza poprzez wstrzyknięcie fenolu i alkoholu była szeroko stosowana przed wprowadzeniem BoNT-A 75,78,79.
6 Farmakologia i mechanizm działania neurotoksyn botulinowych (BoNT)
Neurotoksyny botulinowe (BoNT) to duże białka o masie około 150 kilodaltonów (kDa), wytwarzane przez bakterie z rodziny Clostridia Botulinum. Efekty działania BoNT na poziomie molekularnym są tak precyzyjne, że BoNT opisano jako „cud projektowania białek” i „molekularną nanomaszynę”80. BoNT składa się z N-końcowego łańcucha lekkiego (LC, 50 kDa), który jest metaloproteazą, połączonego z C-końcowym łańcuchem ciężkim (HC, 100 kDa)18. Łańcuch ciężki składa się z dwóch głównych domen, części N-końcowej, która jest domeną translokacji, która bierze udział w uwalnianiu łańcucha lekkiego do cytozolu neuronu ruchowego, oraz części C-końcowej, która jest domeną wiążącą receptor, krytyczną dla wiązania i endocytozy BoNT-A do neuronu presynaptycznego18.
Chociaż istnieje siedem głównych serotypów BoNT (od BoNT-A do BoNT-G), istnieje ponad 40 podtypów BoNT, w tym kilka typów hybrydowych lub mozaikowych, a nowe odmiany są nadal identyfikowane przy użyciu technik immunologicznych18.
BoNT przede wszystkim hamuje uwalnianie acetylocholiny z zakończenia presynaptycznego. Regulacja fuzji pęcherzyka synaptycznego z błoną plazmatyczną obejmuje kompleks białek określanych zbiorczo jako SNARE (Soluble-N Ethylmaleimide, Sensitive Factor Attachment Protein Receptor) lub receptory SNAP. Do głównych białek SNARE należą VAMP/synapptobrewina, przedsynaptyczne białko błony plazmatycznej, syntaksyna i białko synaptosomalne, SNAP25. BoNT zakłóca normalną fuzję pęcherzyków z błoną w wieloetapowym procesie, zilustrowanym na ryc. 4. Ogólny efekt można opisać jako neuro-paraliż lub chemiczną denerwację mięśni80-82. BoNT nie przekracza bariery krew-mózg i chociaż wsteczny transfer do OUN z obwodowych miejsc wstrzyknięcia występuje w ograniczonym stopniu, istnieje niewiele dowodów na bezpośrednie działanie ośrodkowe. Wyjaśnieniem efektów ośrodkowych jest to, że obwodowa chemodenerwacja może prowadzić do ośrodkowej reorganizacji w wyniku neuroplastyczności18.
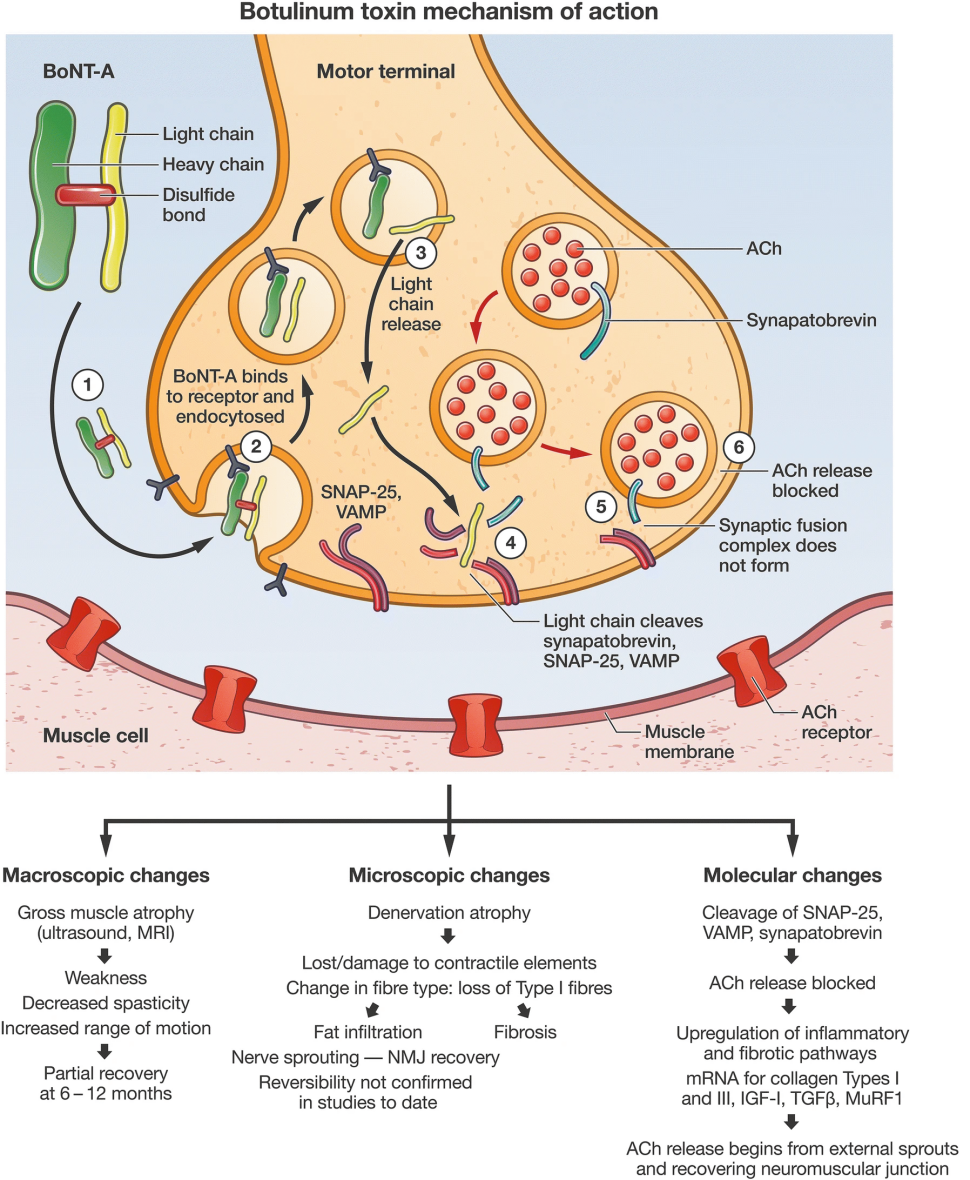
7 BoNT w CP
Spośród siedmiu głównych serotypów BoNT, tylko typy A i B były stosowane u dzieci z CP. BoNT typu B (BoNTB) ma krótszy czas działania niż BoNT-A i mniej zadowalający profil zdarzeń niepożądanych u dzieci z CP82.
Jedynym wskazaniem do stosowania BoNT-B jest oporność na BoNTA spowodowana obecnością przeciwciał neutralizujących. Zdecydowana większość badań klinicznych u dzieci z CP dotyczyła różnych preparatów BoNT-A, głównie toksyny onabotulinowej A (Botox®) i toksyny abobotulinowej A (Dysport®)1-5. Wstrzyknięcie BoNT-A powoduje zależną od dawki, częściowo odwracalną chemo-denerwację wstrzykniętego mięśnia poprzez blokowanie przedsynaptycznego uwalniania acetylocholiny na złączu nerwowo-mięśniowym18,80,81. Ze względu na szybkie i wysokie powinowactwo wiązania z receptorami na złączu nerwowo-mięśniowym mięśnia docelowego, dochodzi do niewielkiego ogólnoustrojowego rozprzestrzeniania się toksyny. Należy jednak zauważyć, że po każdym wstrzyknięciu dochodzi do pewnego ogólnoustrojowego rozprzestrzeniania się, które można wykryć w odległych miejscach za pomocą specjalistycznych technik18. Dyfuzja BoNT-A może być zmieniona przez zmiany w morfologii mięśni, takie jak zmniejszona objętość mięśni i zwiększona tkanka łączna7,25,26.
Neurotransmisja jest początkowo przywracana przez kiełkowanie nowych zakończeń nerwowych, ale są one eliminowane po około 3 miesiącach, gdy pierwotne zakończenia nerwowe odzyskują zdolność uwalniania acetylocholiny83. Siła mięśni jest zmniejszona z powodu ostrej atrofii mięśni z wtórnym efektem zmniejszenia spastyczności mięśni7. Efekty kliniczne utrzymują się od 3 do 6 miesięcy. Niektóre badania biomechaniczne i obrazowe wykazały efekty utrzymujące się przez > 12 miesięcy po pojedynczym wstrzyknięciu BoNT-A84,85. Czas działania należy zatem rozpatrywać nie tylko w kategoriach klinicznych, ale także w kategoriach biomechaniki mięśni i wpływu na mięśnie szkieletowe na poziomie makroskopowym, mikroskopowym i molekularnym7. Szczególnie niepokojące jest to, że działania niepożądane, takie jak zanik mięśni, trwają dłużej niż efekty kliniczne, takie jak rozluźnienie mięśni7,84.
Przewidywalne wzorce ruchowe i postawy charakterystyczne dla spastyczności umożliwiają opracowanie systematycznego uzasadnienia w celu określenia roli BoNT-A w leczeniu nadaktywności mięśni1-6. Leczenie dystonii za pomocą BoNTA jest bardziej złożone, a spastyczność i dystonia często występują w połączeniu, podobnie jak w mieszanych zaburzeniach ruchowych19,22,30. Chociaż zasada terapii BoNT-A u dzieci z CP jest niezwykle prosta, jej zastosowanie stanowi wyzwanie w obecności złożonych, zmieniających się zaburzeń ruchowych i podstępnego rozwoju utrwalonych przykurczów22 (ryc. 5).
7.1 BoNT u poruszającego się dziecka z zespołem Equinus
Najczęstszą deformacją dynamiczną u dzieci z CP jest equinus, który dotyka od 60 do 80% dzieci we wczesnym dzieciństwie1,2,19. Wstrzyknięcie do mięśnia brzuchatego łydki lub mięśnia brzuchatego podeszwy jest najczęstszym wskazaniem do terapii BoNTA u dzieci z CP1-6. Wynika to z dwóch głównych powodów. Wstrzyknięcie do mięśnia brzuchatego łydki jest umiarkowanie skuteczne u młodszych dzieci z dynamicznym stopniem końsko-szpotawym, a alternatywa w postaci operacji wydłużenia ścięgien mięśniowych jest nieprzewidywalna i często szkodliwa86. Odwrotna sytuacja ma jednak miejsce, gdy dziecko staje się starsze. Odpowiedź na BoNT-A jest ledwo wykrywalna, a chirurgiczne wydłużenie mięśnia brzuchatego łydki jest skuteczne i niezawodne87,88.
Aby ocenić dowody przemawiające za stosowaniem BoNT-A w stwardnieniu zanikowym bocznym, dokonaliśmy przeglądu licznych publikacji, które były głównie badaniami kohortowymi, w połączeniu z badaniami o wyższej jakości, które zostały wcześniej poddane przeglądowi systematycznemu i dowodom6,82. Większość badań stanowiły badania kohortowe, a więcej z nich opisano jako prospektywne niż retrospektywne. Jednak większość z nich była niekontrolowana, co ma niewielki wpływ na dowody dotyczące zmian w skalach w dziedzinie budowy ciała, takich jak MAS lub MTS. Brak kontroli podważa wiele twierdzeń dotyczących poprawy lub zmian w zakresie motoryki dużej. Większość zgłoszonych badań obejmowała pojedynczy cykl iniekcji, a średni okres obserwacji wynosił zwykle około 6 miesięcy.
Jeśli chodzi o narzędzia wynikowe, najczęściej stosowano MAS i MTS, które były używane w około trzech czwartych badań, a następnie ROM kostki w około połowie badań. Obserwacyjne skale chodu (PRS, OGS, EVGS) były używane z lub bez wideo w około jednej trzeciej badań, a jakaś forma instrumentalnej analizy chodu była używana w prawie połowie badań, ale używany sprzęt i niezawodność były słabo opisane.
Gdy MAS lub MTS były podstawową miarą wyniku, większość z nich wykazała statystycznie istotną poprawę, tj. zmniejszenie spastyczności. W większości badań wykorzystujących obserwacyjne skale chodu odnotowano poprawę, podobnie jak w badaniach wykorzystujących instrumentalną analizę chodu6,82. W większości badań, w których opisywano GMFM, odnotowano poprawę funkcji motoryki dużej, ale większość z tych badań była niekontrolowana, co utrudnia oddzielenie przyrostu GMFM w wyniku historii naturalnej od przyrostu w wyniku wstrzyknięcia BoNT-A 22. Zaobserwowano tendencję do zgłaszania mniejszej poprawy GMFM lub jej braku w lepszych badaniach58.
Niepokojąca była obserwacja, że zmiana w GMFCS została zgłoszona jako miara wyniku w wielu badaniach. Projekty badań były zróżnicowane, liczba uczestników na ogół niewielka, a średni okres obserwacji krótki. Mierniki wyników były często słabo opisane, a ich wiarygodność nie została podana. Niektóre miary były stosowane nieprawidłowo (np. GMFCS). W większości badań zgłaszano wyniki w domenie ICF struktury ciała, w mniejszej liczbie zgłaszano prawidłowe pomiary funkcji, a w bardzo niewielu zgłaszano wyniki w domenach aktywności i uczestnictwa34.
Stwierdzono, że istnieją mocne dowody na zmniejszenie spastyczności zginaczy podeszwowych kostki po wstrzyknięciu BoNT-A; istniały umiarkowane dowody na niewielką poprawę chodu z zastrzeżeniem, że obserwacyjne skale chodu mają ograniczenia51,52,89. Istniały słabe dowody na poprawę funkcji motorycznych, związane z brakiem kontroli i nieprawidłowym użyciem GMFCS6,82.
7.1.1 Przeglądy systematyczne i podsumowania dowodów
Istnieje kilka dobrej jakości badań RCT badających wyniki wstrzyknięcia BoNT-A w przypadku skrzywienia końsko-szpotawego z pozytywnymi wynikami przy użyciu obiektywnych miar wyników, takich jak 3-DGA, a także niższej jakości miar wyników, takich jak PRS, OGS, EVGS, MTS i MAS. Badania te zostały przeanalizowane i ocenione przez Simpsona i wsp. oraz ostatnio przez Love i wsp.6,82.
Należy zauważyć, że im wyższa jakość projektu badania i im bardziej obiektywna miara wyniku pod względem ważności i wiarygodności, tym mniejsza i mniej przewidywalna jest odpowiedź na terapię BoNT-A. Nawet w przypadku 3-DGA, wcześniejsze badania koncentrowały się na miarach wyników, takich jak zakres equinus w fazach stania i zamachu chodu50,54. Gdy zastosowano nowsze, bardziej globalne miary funkcji chodu, takie jak GPS, zauważono, że poprawa ogólnej funkcji chodu jest znacznie mniejsza lub nie występuje56.
Jedną z przyczyn tego paradoksu jest fakt, że wstrzyknięcie BoNT-A do żołądka i podeszwy u dzieci z diplegią spastyczną (obustronnym CP) odbywa się w kontekście uogólnionej spastyczności wpływającej na proksymalne grupy mięśni, w tym ścięgna podkolanowe i biodrowo-lędźwiowe19. Poprawa zgięcia grzbietowego w stawie skokowym może być kompensowana pogorszeniem wyprostu w stawie kolanowym lub biodrowym, co prowadzi do paradoksu poprawy na poziomie stawu skokowego z pogorszeniem na poziomach proksymalnych56. Większość klinicystów zdaje sobie sprawę, że w dłuższej perspektywie chód kucany (zwiększone zgięcie biodra i kolana) jest bardziej podstępnym i nieuleczalnym zaburzeniem chodu niż equinus, który jest łatwy do skorygowania chirurgicznie, gdy dziecko jest starsze, jako ostateczna procedura o niskim wskaźniku nawrotów87.
Większość badań wykazała, że poprawa po terapii BoNT-A u dzieci z powodu spastycznego kręczu końsko-szpotawego jest niewielka i krótkotrwała. Ponadto dzieci przestają reagować na wstrzyknięcie BoNT-A w młodszym wieku niż wcześniej sądzono52,56. Najbardziej znaczącą klinicznie poprawę obserwuje się w wieku poniżej 4 lat w przypadku porażenia końsko-szpotawego w hemiplegii spastycznej6. Odpowiedź zmniejsza się między 4 a 6 rokiem życia, a po 6 roku życia ostatnie badania obejmujące zarówno EVGS, jak i 3DGA potwierdzają niewielkie lub żadne korzyści z dalszego stosowania terapii BoNT-A52,56.
7.1.2 Dawkowanie i częstotliwość podawania
Dawki i rozcieńczenia BoNT-A w leczeniu equinus zależą od stosowanego preparatu i zostały opublikowane i omówione obszernie w innych miejscach1-6. Istnieje jedno kompleksowe badanie dotyczące zakresu dawek dla spastycznego equinus, które wyraźnie pokazuje krzywą dawka-odpowiedź90. Istnieją dwa badania RCT, w których zbadano i zgłoszono częstotliwość wstrzyknięć w przypadku spastycznego equinus. W obu badaniach porównano schemat iniekcji trzy razy w roku (co 4 miesiące) z iniekcjami raz w roku. Oba badania wykazały, że schemat iniekcji raz w roku był równie skuteczny i powodował mniej zdarzeń niepożądanych niż trzy razy w roku91,92. Pomimo tych dowodów na poziomie I, wielu lekarzy wykonuje zastrzyki w częstszych odstępach czasu. Harmonogram iniekcji raz na rok jest również zgodny z wynikami badań eksperymentalnych na modelach małych ssaków, w których częstsze iniekcje powodowały skumulowane szkody w postaci atrofii mięśni, osłabienia i utraty elementów kurczliwych oraz zwłóknienia7,93,94.
7.1.3 Celowanie w mięśnie
Identyfikacja mięśnia docelowego tradycyjnie opiera się na anatomicznych punktach orientacyjnych i badaniu palpacyjnym1,2. Dokładność iniekcji opartej na badaniu palpacyjnym jest niska, z wyjątkiem mięśnia brzuchatego łydki95. Elektromiografia, stymulacja elektryczna i ultrasonografia w czasie rzeczywistym poprawiły dokładność iniekcji mięśni docelowych u dzieci z CP13,95. Trudniej było określić, czy lepsza dokładność iniekcji poprawiła wyniki kliniczne. Obecnie dostępna jest obszerna literatura i atlasy w celu lepszego zrozumienia trójwymiarowej anatomii topograficznej w oparciu o wysokiej jakości ultrasonografię w czasie rzeczywistym. Stosowanie ultrasonografii jest zdecydowanie zalecane i wymaga specjalnego przeszkolenia i sprzętu13.
7.1.4 Wnioski
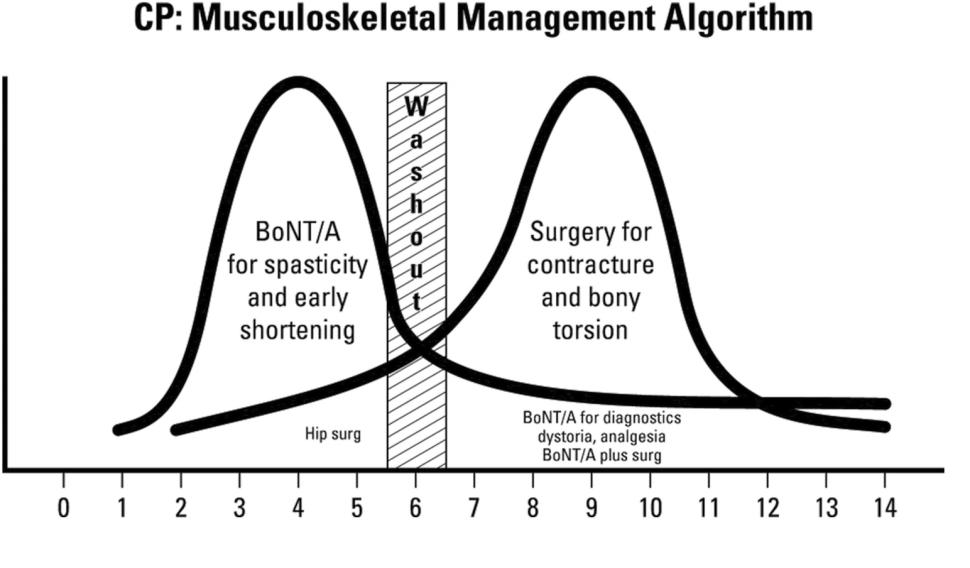
U młodszych dzieci bez utrwalonego przykurczu, wstrzyknięcie BoNT-A w przypadku stopy końsko-szpotawej zwiększa dynamiczną długość mięśnia brzuchatego łydki i powoduje poprawę wybranych parametrów chodu96. Istnieją również dowody na to, że odpowiednie stosowanie BoNT-A u młodszych dzieci może opóźnić wystąpienie utrwalonego equinus w niewielkim, ale istotnym stopniu, umożliwiając późniejsze wykorzystanie chirurgii ortopedycznej w optymalnym wieku19,56. Ogólnie rzecz biorąc, oznacza to bardziej przewidywalny wynik chirurgicznego leczenia stopy końsko-szpotawej i mniejszą potrzebę powtórnej operacji87,88. Jednak prawie 100% dzieci, które potrzebują zastrzyków z BoNT-A w leczeniu spastycznego mięśnia równobocznego, będzie również wymagało chirurgicznego wydłużenia mięśnia brzuchatego łydki.
Optymizm dotyczący zapobiegania przykurczom wygenerowany w badaniu na spastycznych myszach nigdy nie został przełożony na sytuację kliniczną33. W rzeczywistości istnieje coraz więcej dowodów na to, że wstrzyknięcie BoNT-A może powodować utratę elementów kurczliwych i zwiększone zwłóknienie, co może prowadzić do zwiększenia przykurczu7,93,94; stąd potrzeba stałego dialogu między klinicystami w wielodyscyplinarnym zespole, którzy praktykują zarówno nieoperacyjne, jak i operacyjne leczenie dzieci z CP6. Krótkoterminowe zyski w osiąganiu „płaskiej stopy” mogą być kompensowane przez długoterminowe uszkodzenie kompleksu mięśniowego, który jest kluczem do długoterminowej funkcji chodu i niezależności7,17,22-24. Stąd pilna potrzeba badań długoterminowych, obejmujących wiele cykli iniekcji (ryc. 6).
7.2 Wstrzyknięcie do mięśni proksymalnych kończyny dolnej
Wskazania, techniki i wyniki ostrzykiwania ścięgien podkolanowych i mięśni przywodzicieli zostały po raz pierwszy opisane przez Cosgrove i wsp. oraz Corry i wsp. a następnie przez innych97,98. Nadaktywność mięśni ścięgien podkolanowych i mięśni przywodzicieli jest bardziej powszechna u ciężej chorych dzieci z obustronnym zajęciem. Może to skutkować postawą nożycową i zgiętym, sztywnym chodem. Iniekcja ścięgien podkolanowych może być połączona z iniekcją mięśnia brzuchatego łydki u wysoko funkcjonujących dzieci z diplegią96,97. Większość doświadczonych klinicystów uważa, że wstrzyknięcie do czterech dużych grup mięśni podczas jednej sesji może być odpowiednie i ogólnie bezpieczne, jeśli stosowane są ograniczenia dawki i odpowiednie techniki3-6. Wstrzyknięcie więcej niż czterech dużych grup mięśni zwiększa ryzyko ogólnoustrojowego rozprzestrzeniania się oraz miejscowych i ogólnoustrojowych zdarzeń niepożądanych19,61.
7.3 Zastrzyki wielopoziomowe w kończyny dolne
Molenaers i wsp. w Leuven w Belgii są pionierami zintegrowanego, wielopoziomowego leczenia spastyczności BoNT-A u dzieci z CP, podobnego do koncepcji wielopoziomowej chirurgii pojedynczego zdarzenia45,99. Odchylenia chodu są identyfikowane za pomocą 3DGA, nadaktywność mięśni jest identyfikowana za pomocą kombinacji 3DGA, elektromiografii i instrumentalnych pomiarów spastyczności. Następnie dla każdego dziecka opracowywany jest indywidualny program składający się z ukierunkowanych zastrzyków do mięśni spastycznych, seryjnych gipsów, ortez do stosowania w ciągu dnia, szyn nocnych i intensywnej fizjoterapii po wstrzyknięciu.
Grupa Leuven odnotowała poprawę chodu i funkcji w kilku badaniach, w stopniu i na poziomie, które rzadko były osiągane w innych ośrodkach45,56,99. Być może integracja wszystkich elementów ich podejścia jest wymagana dla uzyskania optymalnych wyników45. Jednak połączenie tak wielu medycznych, fizycznych i terapeutycznych elementów programu sprawia, że bardzo trudno jest wyodrębnić wkład każdego z nich w ogólny wynik45.
W przeciwieństwie do filozofii Leuven, Bakheit twierdzi, że zastrzyki BoNT-A mogą być skuteczne jako samodzielna interwencja, gdy pomocnicze leczenie nie jest dostępne100. Baza dowodowa przemawiająca za lub przeciw interwencjom pomocniczym jest słaba, ponieważ bardzo trudno jest wyodrębnić części składowe multimodalnej strategii interwencji i poddać je RCT o odpowiedniej mocy.
7.4 BoNT u dziecka nieleczonego farmakologicznie
Przemieszczenie biodra może dotyczyć do 90% dzieci na poziomie V GMFCS19. W przeszłości za główną przyczynę przemieszczenia stawu biodrowego uważano spastyczne przywodzenie, a leczeniu spastyczności i przykurczów przywodzicieli poświęcano wiele uwagi19. Obecnie wiadomo, że przemieszczenie stawu biodrowego u niechodzącego dziecka jest znacznie bardziej związane z ograniczoną funkcją odwodzicieli stawu biodrowego niż spastycznością przywodzicieli stawu biodrowego.
Graham i wsp. przeprowadzili 3-letnie badanie RCT badające wyniki 6-miesięcznych zastrzyków BoNT-A w przywodziciele i ścięgna podkolanowe u dzieci z CP, w połączeniu z ortezą odwodzącą biodro. Wyniki tego badania były negatywne. Funkcja motoryki dużej określona przez GMFM nie uległa poprawie w grupie leczonej w porównaniu z grupą kontrolną101. Nie udało się zapobiec przemieszczeniu stawu biodrowego, a dzieci z obu grup wymagały takiej samej liczby operacji ortopedycznych z powodu przemieszczenia stawu biodrowego, z takimi samymi wynikami w zakresie morfologii stawu biodrowego i bólu po 10 latach obserwacji102,103.
Chociaż mniejsze badania z krótkoterminową obserwacją sugerują bardziej optymistyczne wyniki, waga dowodów sugeruje, że funkcja motoryczna nie ulega poprawie, a przemieszczenie biodra i potrzeba operacji ortopedycznej nie są unikane przez wstrzyknięcie przywodzicieli biodra u niechodzących dzieci z CP101-103.
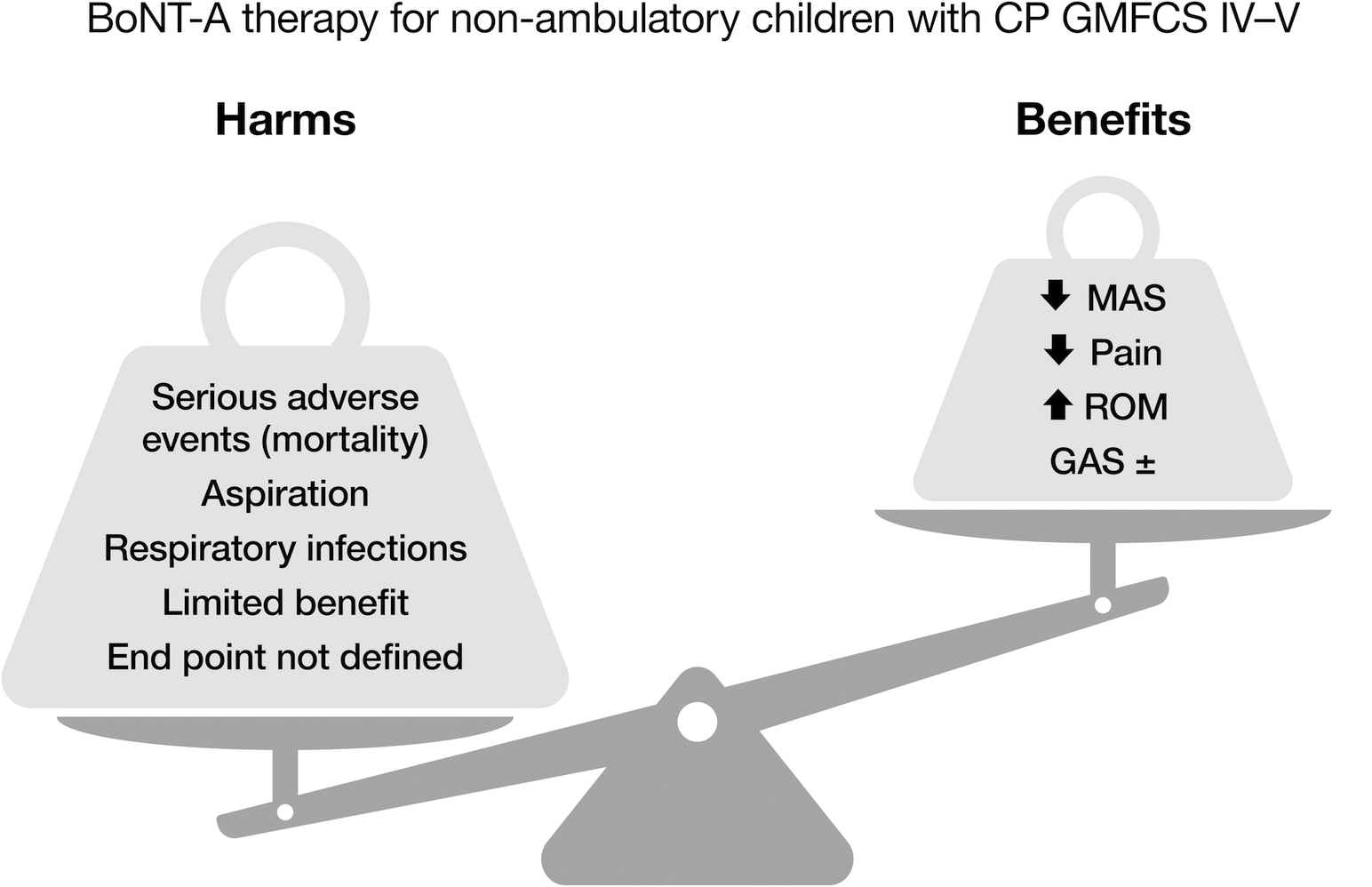
Copeland i wsp. przedstawili wyniki badania RCT dotyczącego stosowania BoNT-A u 41 nieambulatoryjnych dzieci z CP w różnych wskazaniach, opisanych jako „opieka i komfort”11. Opisali oni stosowanie wstrzyknięć pozorowanych jako kontroli i zgłosili znaczące korzyści w COPM jako podstawowej miary wyniku. Badanie to było słabe metodologicznie, ponieważ nie utrzymano zaślepienia, a 77% rodziców prawidłowo zidentyfikowało przydział do grupy po 4 tygodniach od wstrzyknięcia11. Połączenie niedoskonałego zaślepienia i subiektywnych miar wyników podważa wiarygodność wniosków. Chociaż nie odnotowano wzrostu liczby poważnych zdarzeń niepożądanych w grupie leczonej w porównaniu z grupą kontrolną, może to nie mieć miejsca w przypadku stosowania BoNT-A u dzieci nieambulatoryjnych w warunkach innych niż RCT, gdy zgłaszano poważne zdarzenia niepożądane i zgony61,104. Ponadto ci, którzy opowiadają się za wstrzyknięciami BoNT-A u dzieci niechodzących, rzadko omawiają strategię wyjścia lub zakończenia stosowania BoNT-A. W przypadku dzieci poruszających się, logicznym punktem końcowym terapii BoNT-A dla większości dzieci jest operacja ortopedyczna z powodu utrwalonego przykurczu87,88. W przypadku dzieci niechodzących punkt końcowy nie jest jasny, a każdy cykl iniekcji naraża dziecko na większe ryzyko poważnych zdarzeń niepożądanych niż w przypadku dzieci chodzących19,104,105 (ryc. 7). Spastyczność przywodziciela biodra jest skuteczniej leczona przez fenolizację nerwu obturatora niż przez wstrzyknięcie BoNT-A, zwłaszcza w połączeniu z operacją uwolnienia przywodziciela78.
Istnieje niewielka rola leczenia ogniskowego spastyczności u niechodzących dzieci w celu osiągnięcia określonych celów funkcjonalnych11,22. W przypadku kończyny górnej obejmują one poprawę zasięgu i chwytu w celu ułatwienia sterowania wózkiem inwalidzkim z napędem. W przypadku kończyny dolnej bardzo przydatnym wskazaniem jest złagodzenie bolesnego zwichnięcia stawu biodrowego u dziecka, które jest zbyt słabe, aby rozważyć operację ortopedyczną106. Jednak zapobieganie zwichnięciu stawu biodrowego poprzez nadzór nad stawem biodrowym i wczesną operację jest zdecydowanie lepszą opcją.
7.4.1 Ryzyko związane ze stosowaniem BoNT u dzieci nieleczonych immunosupresyjnie
U dzieci niechodzących globalne leczenie spastyczności za pomocą leków doustnych i, w stosownych przypadkach, dooponowej pompy baklofenowej jest zarówno skuteczniejsze, jak i bezpieczniejsze niż regularne wstrzykiwanie dużych dawek BoNT-A do wielu mięśni76. To właśnie w grupie niechodzących dzieci z chorobami współistniejącymi doszło do większości wypadków śmiertelnych po wstrzyknięciu BoNT-A, co skłoniło FDA w Stanach Zjednoczonych do nalegania na „ostrzeżenie w czarnej skrzynce” dla wszystkich produktów toksyny botulinowej18. Pomimo ograniczonych korzyści i słabej bazy dowodowej, terapia BoNT-A jest nadal szeroko stosowana u dzieci nieambulatoryjnych. W Australii w ostatnich latach doszło do czterech zgonów przypisywanych stosowaniu terapii BoNT-A u nieambulatoryjnych dzieci z CP, a profil ryzyka do korzyści jest niski102,107. Jednym z wyjątków może być stosowanie BoNT-A w celu łagodzenia bólu, który jest tak powszechny w tej populacji106,108.
7.5 Zastrzyki w kończynę górną: Uszkodzenia i interwencje
Dysfunkcja kończyn górnych jest częstą funkcjonalną i kosmetyczną konsekwencją CP, szczególnie u dzieci z niedowładem połowiczym22. Przyjęto wiele różnych strategii postępowania, a baza dowodowa została poddana przeglądowi przez Boyda i wsp. oraz ostatnio przez Sakzewskiego i wsp.109,110.
Konwencjonalne postępowanie terapeutyczne w przypadku nadpobudliwości kończyn górnych u dzieci z CP obejmowało stosowanie szynowania i gipsowania oraz biernego rozciągania, ułatwiania postawy i ruchu, leków, a czasem operacji ortopedycznych lub plastycznych109. W niedawnej metaanalizie wysokiej jakości Sakzewski i wsp. odnotowali umiarkowane do silnych efekty BoNT-A i terapii zajęciowej w celu poprawy wyników w porównaniu z samą terapią zajęciową. Terapia ruchowa indukowana ograniczeniami osiągnęła umiarkowane do silnych efekty leczenia w zakresie poprawy jakości ruchu i sprawności upośledzonej kończyny górnej w porównaniu ze zwykłą opieką110.
Upośledzenie funkcji kończyny górnej może mieć wpływ na umiejętności samoopieki, codzienne czynności życiowe, edukację, zajęcia rekreacyjne i wyniki zawodowe (uczestnictwo)22. Dzieci mogą nie być w stanie sięgać po przedmioty, manipulować zabawkami, sprawnie się odżywiać lub korzystać z urządzeń wspomagających komunikację22,109,110. Niewielka poprawa funkcji sięgania może być korzystna. Różne mięśnie rozwijają utrwalony przykurcz w różnym tempie. Mięsień pronator teres jest niezmiennie pierwszym mięśniem w kończynie górnej z porażeniem połowiczym, w którym rozwija się przykurcz22.
7.5.1 BoNT-A w kończynie górnej: Przegląd
Stosowanie BoNT-A w kończynach dolnych dzieci z CP jest dobrze ugruntowane, a badania RCT przeprowadzono również w kończynach górnych, wkrótce po wprowadzeniu BoNT-A do praktyki klinicznej9,10. Głównym celem leczenia za pomocą BoNT-A w kończynie górnej dzieci z CP jest poprawa funkcji poprzez umożliwienie dzieciom korzystania z leczonego ramienia i wykonywania codziennych czynności w sposób bardziej wydajny i skuteczny9,10,22. Dodatkowym celem jest zmniejszenie napięcia i zwiększenie zakresu ruchu, aby zapobiec przykurczom i opóźnić potrzebę operacji9,10,22,110,111. Niezmiennie to niedominujące ramię wymaga leczenia, z wyjątkiem dzieci z porażeniem czterokończynowym, kiedy dominujące ramię może odnieść korzyści z interwencji w celu poprawy chwytu i uwolnienia w czynnościach takich jak kierowanie wózkiem inwalidzkim111. W przypadku kończyny górnej jeszcze ważniejsze jest, aby terapia BoNT-A była ukierunkowana na cel w kontekście multidyscyplinarnego programu obejmującego szynowanie i terapię zajęciową22,110.
Dodatkowe problemy w kończynie górnej będą związane z większą częstością występowania dystonii, osłabienia, zaburzeń czucia i upośledzenia selektywnej kontroli motorycznej19,22. Te negatywne cechy mogą przyćmić wszelkie korzyści uzyskane z iniekcji BoNT-A i prowadzić do bardziej ograniczonych wyników o krótszym czasie trwania9. Odpowiedni kandydat do terapii BoNT-A w kończynie górnej powinien być w stanie zainicjować aktywne ruchy palców oraz aktywować i wzmocnić mięśnie antagonistyczne, aby wykorzystać tymczasowy niedowład BoNT-A agonistów10. Dzieci powinny mieć dobrą siłę chwytu, ponieważ dobra siła chwytu może być zmniejszona przez wstrzyknięcie BoNT-A 9,10,111. Zidentyfikowane przez rodzinę ograniczenia, problemy i cele powinny być szczegółowo przeanalizowane112,113.
W typowej postawie hemiplegicznej najczęstszymi mięśniami docelowymi są biceps, mięsień ramienny, pronator teres, zginacz łokciowy nadgarstka, zginacz promieniowy nadgarstka i przywodziciel pollicis22,111. Iniekcje zginaczy długich palców powinny być ograniczone do minimum, aby uniknąć osłabienia siły chwytu9,10. Jednak u niechodzących dzieci z ciężką dystonią spastyczną oraz u niektórych dzieci z niedowładem połowiczym, jeśli celem jest poprawa higieny dłoni, wymagane jest wstrzyknięcie zginaczy długich palców w połączeniu z seryjnym gipsowaniem111. Większe mięśnie są wstrzykiwane w jednym lub dwóch miejscach, a mniejsze mięśnie w jednym miejscu. Zaleca się iniekcje o małej objętości i wysokim stężeniu, przy użyciu kontroli ultradźwiękowej, aby uniknąć wstrzyknięcia niepożądanych mięśni i dyfuzji do innych grup mięśni112,114.
7.5.2 BoNT-A w kończynie górnej: Dowody
Corry i wsp. przeprowadzili pierwsze podwójnie zaślepione, kontrolowane placebo badanie obejmujące wielokrotne wstrzyknięcia w spastyczną kończynę górną u dzieci z CP9. Podobnie jak w przypadku wielu badań, wykazano zmniejszenie pomiarów spastyczności, ale poprawa funkcji była znacznie trudniejsza do osiągnięcia9. Fehlings i wsp. przeprowadzili randomizowane badanie z pojedynczą ślepą próbą z udziałem 30 dzieci z porażeniem połowiczym10. Odnotowano znaczącą poprawę funkcji w grupie BoNT-A mierzoną za pomocą testu jakości umiejętności kończyn górnych (QUEST) po 1 miesiącu, ale korzyści nie były znaczące w dłuższym okresie obserwacji.
Wallen i wsp. wykazali, że dynamiczne zakresy stawów w kończynie górnej reagują na wstrzyknięcie BoNT-A i że nastąpiła znaczna poprawa aktywności i uczestnictwa w 3 i 6 miesiącach po wstrzyknięciu112. Olesch i wsp. wykazali bezpieczeństwo wielokrotnych wstrzyknięć do kończyny górnej113.
W 2005 r. Speth i wsp. zgłosili wysokiej jakości RCT badające dodanie zastrzyków BoNT-A z intensywną terapią do samej intensywnej terapii114. Podobnie jak w pierwszym badaniu RCT dotyczącym kończyny górnej przeprowadzonym przez Corry’ego i wsp. w 1997 r., Speth i wsp. stwierdzili zmniejszenie nadaktywności mięśni, z pewnym wzrostem ROM, ale bardzo ograniczonymi dowodami na zmiany w funkcji lub uczestnictwie9,114.
Obiektywna ocena funkcji kończyny górnej przy użyciu znormalizowanego, zwalidowanego narzędzia jest zdecydowanie zalecana w celu udokumentowania funkcji wyjściowej, a także oceny zmian po leczeniu. Istnieje wiele uznanych narzędzi, które można wykorzystać jako mierniki wyników oceny kończyny górnej, w tym QUEST, Melbourne Assessment of Unilateral Upper Limb Function (Melbourne Assessment) i Assisting Hand Assessment (AHA). W badaniach wykorzystujących te ważne, wiarygodne i obiektywne miary, trudno było zidentyfikować trwałą poprawę funkcji115. Podobnie jak w przypadku kończyny dolnej, stosowanie interwencji wspomagających sprawia, że interpretacja efektów leczenia jest problematyczna115. Podobnie jak w przypadku kończyny dolnej, u dzieci z zajęciem kończyny górnej należy rozważyć ostateczną operację ortopedyczną, gdy odpowiedź na wstrzyknięcia BoNT-A ustąpi, zwłaszcza gdy utrwalone przykurcze postępują i upośledzają funkcję110. W pierwszym RCT, w którym porównywano wstrzyknięcia BoNT-A, operację przeniesienia ścięgna i zwykłą terapię, grupa chirurgiczna miała lepsze wyniki116.
7.6 BoNT-A jako środek przeciwbólowy
Przeciwbólowa rola BoNT-A jest złożona i podlega ciągłej ocenie zarówno w modelach zwierzęcych, jak i w badaniach klinicznych41,117. W jednym z najnowszych przeglądów opartych na dowodach stwierdzono, że istnieją dowody poziomu B na poparcie stosowania BoNT-A w różnych nerwobólach117. Ból mięśniowo-szkieletowy jest głównym problemem klinicznym u wielu dzieci z CP i wydaje się nasilać w drugiej dekadzie życia i jest bardzo powszechny u młodych dorosłych118. Hipertonia nasila ból i często występuje „błędne koło” bólu i skurczu, w którym ból wywołuje skurcz mięśni, co dodatkowo zwiększa ból41. Cykl ból-skurcz może być czasami przerwany przez wstrzyknięcie BoNT-A.
W jednym małym badaniu RCT wstrzyknięcie BoNT-A zmniejszyło zapotrzebowanie na opiaty i spowodowało krótszy pobyt w szpitalu u dzieci po uwolnieniu przywodzicieli niż w grupie kontrolnej41. Jednak w niedawnym, większym i wyższej jakości badaniu, wyniki te nie zostały powtórzone u dzieci poddanych operacji rekonstrukcyjnej stawu biodrowego119. Sugeruje to, że BoNT-A jest bardziej skuteczna w przypadku bolesnych skurczów niż bólu mięśniowo-szkieletowego41,119.
7.7 Działania niepożądane BoNT-A
Wstrzyknięcie BoNT-A u poruszających się dzieci z porażeniem mózgowym, które są sprawne fizycznie i mają niewiele chorób współistniejących, jest ogólnie bezpieczne1-6. Drobne zdarzenia niepożądane, w tym ból w miejscu wstrzyknięcia, osłabienie wstrzykniętego mięśnia lub pobliskich mięśni, upadek, potknięcie się, choroba przypominająca flulę i krótkotrwałe pogorszenie funkcjonowania, zostały zgłoszone w badaniach, od małych badań kohortowych i RCT po przeglądy oparte na dowodach1-6, 9, 16, 82.
Ogólnoustrojowe zdarzenia niepożądane występują u dzieci ambulatoryjnych z częstością od 1 do 5%1-6. Zdarzenia takie obejmują przemijające nietrzymanie stolca, pęcherza moczowego lub obu3,6. Wynika to z faktu, że w cholinergicznej funkcji zwieracza pośredniczy acetylocholina, a zatem może na nią wpływać ogólnoustrojowe rozprzestrzenianie się BoNT-A 3. Zwieracz krtani i dolny zwieracz przełyku są również kontrolowane przez mięśnie gładkie o unerwieniu cholinergicznym. Najpoważniejszym zdarzeniem niepożądanym, skutkującym śmiertelnością, jest paraliż zwieracza gardła lub dolnej części przełyku, umożliwiający aspirację treści żołądkowej do dróg oddechowych z niedotlenieniem, zapaleniem płuc, a w skrajnych przypadkach zatrzymaniem akcji serca i śmiercią3.
Paradoksalnie, badania RCT mogą nie być optymalnym źródłem do określenia rzeczywistej częstości występowania zdarzeń niepożądanych, zwłaszcza poważnych zdarzeń niepożądanych. Badania RCT są prowadzone przez doświadczonych klinicystów, a dawka, rozcieńczenie i celowanie w mięśnie są dokładnie określone i zatwierdzone przez komisję etyczną. Pacjenci włączeni do badań RCT i prospektywnych badań kohortowych są ściśle monitorowani i mają częsty kontakt z klinicystami9, 16, 45, 96-98.
Zdarzenia niepożądane w ogólnej praktyce klinicznej odzwierciedlają większą różnorodność technik, dawkowania, rozcieńczania, technik celowania i doświadczenia klinicystów w szerokim zakresie warunków praktyki105, 120-122. Naidu i wsp. przeprowadzili retrospektywne badanie dużej liczby iniekcji u dzieci z CP, GMFCS I-V. Stwierdzili silny związek między poważnymi zdarzeniami niepożądanymi wymagającymi hospitalizacji a poziomem GMFCS104. Zalecono, aby nie oferować zastrzyków dzieciom niechodzącym na poziomach GMFCS IV i V104. W badaniu o solidniejszej metodologii, wykorzystującym prospektywną bazę danych iniekcji, O’Flaherty i wsp. odnotowali podobną częstość występowania zdarzeń niepożądanych u niechodzących dzieci z CP w miesiącu poprzedzającym iniekcję, jak w miesiącu po iniekcji122. W badaniu O’Flaherty’ego uczestniczyła ograniczona liczba doświadczonych wstrzykiwaczy o wysokim poziomie wyszkolenia i doświadczenia122.
7.7.1 Kliniczne zdarzenia niepożądane i badania nadzoru nad bezpieczeństwem farmakoterapii
Biorąc pod uwagę znaczenie doświadczenia i nadzoru, badania nadzoru nad bezpieczeństwem farmakoterapii mogą być ważnym źródłem informacji na temat częstości występowania poważnych zdarzeń niepożądanych w środowisku społecznym105. W 2016 roku opublikowano badanie na podstawie danych z globalnej bazy danych WHO Individual Case Safety Report (ICSR), VigiBase®. W latach 1995-2015 w bazie VigiBase® zarejestrowano 162 ICSR. Najczęstszym zdarzeniem niepożądanym była dysfagia (n = 27, 17%), a następnie osłabienie (n = 25, 16%). Odnotowano 19 zgonów po wstrzyknięciu BoNT-A, a śmiertelność występowała częściej u dzieci niż u dorosłych105. Zgony i poważne zdarzenia niepożądane były rzadko zgłaszane w badaniach RCT i wskazują na potrzebę ciągłego rejestrowania i monitorowania poważnych zdarzeń niepożądanych w środowisku społecznym102,105.
Uważamy, że stosunek ryzyka do korzyści w przypadku stosowania zastrzyków BoNT-A w dużych grupach mięśni u niechodzących dzieci z CP może być nie do przyjęcia (ryc. 7). W Australii doszło do co najmniej czterech zgonów niechodzących dzieci z porażeniem mózgowym po wstrzyknięciu BoNT-A, a inne zdarzenia nie zostały zgłoszone lub zostały zgłoszone w niewystarczającym stopniu102,105,107.
7.7.2 Zdarzenia niepożądane BoNT-A w mięśniach poddanych iniekcji
W literaturze dotyczącej bezpieczeństwa BoNT-A słusznie skupiono się na bezpieczeństwie dziecka z CP i częstości występowania zdarzeń niepożądanych61,121,122. Jednak w ciągu ostatnich 15 lat pojawiło się coraz więcej literatury opisującej szkodliwe skutki wstrzyknięcia BoNT-A na poziomie wstrzykniętego mięśnia7,93,94. Te części literatury rzadko się przecinają, a większość przeglądów BoNT-A nie wspomina o ryzyku atrofii mięśni i zwłóknienia3,7,81. We wcześniejszej literaturze uważano, że wstrzyknięcie BoNT-A jest całkowicie odwracalne, a jeśli wstrzyknięcie nie poprawi chodu i funkcji, przynajmniej nie zaszkodzi (ryc. 8)83.
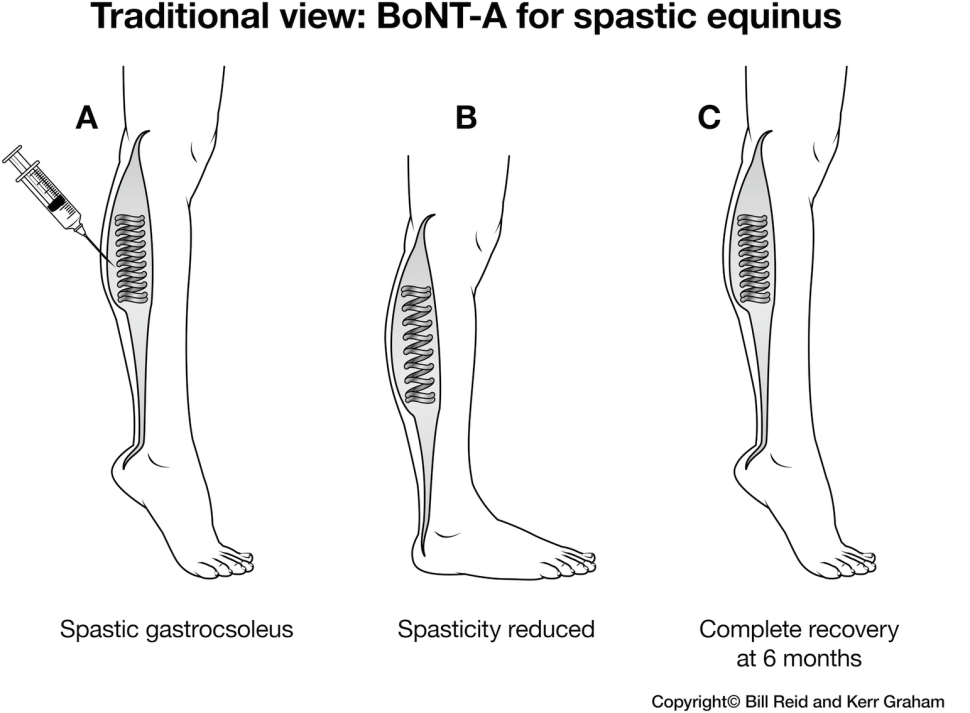
Wstrzyknięcie BoNT-A powoduje chemo-denerwację mięśni szkieletowych, a po denerwacji następuje ostry zanik mięśni7,84,85,106,123. Zmniejszenie spastyczności nie jest efektem pierwotnym, ale wtórnym do zaniku mięśni7 (ryc. 9). W okresie zaniku mięśni kurczliwe elementy mięśni są częściowo zastępowane przez tłuszcz i tkankę łączną7,85,123. Po ustąpieniu skutków wstrzyknięcia dochodzi do częściowego przywrócenia morfologii i funkcji mięśni, ale dowody u ochotników i zwierząt doświadczalnych sugerują, że powrót do zdrowia jest niepełny po 12 miesiącach od wstrzyknięcia7,85,123. Do tej pory nie przeprowadzono badań, które trwałyby dłużej niż 12 miesięcy7,84,85. W chwili obecnej stopień regeneracji mięśni nie jest znany, podobnie jak nie wiadomo, czy mięśnie szkieletowe kiedykolwiek w pełni zregenerują się po pojedynczym wstrzyknięciu BoNT-A. Jeśli występuje nawet niewielki deficyt w 6-12 miesięcy po pierwszym wstrzyknięciu, możliwe jest, że deficyty w morfologii i funkcji mięśni szkieletowych mogą się kumulować w czasie, z każdym cyklem wstrzyknięć94. Konsekwencje będą się różnić w zależności od wstrzykniętego mięśnia i jego funkcji. Jest mało prawdopodobne, aby zwłóknienie mięśni pomogło w funkcjonowaniu mięśni w jakimkolwiek obszarze ciała, ale może mieć poważniejsze konsekwencje w antygrawitacji, mięśniach kończyn dolnych u dzieci chodzących niż w mięśniach kończyn górnych lub być może w mięśniach dzieci niechodzących. Wszystkie te pomysły muszą zostać zbadane i przetestowane.
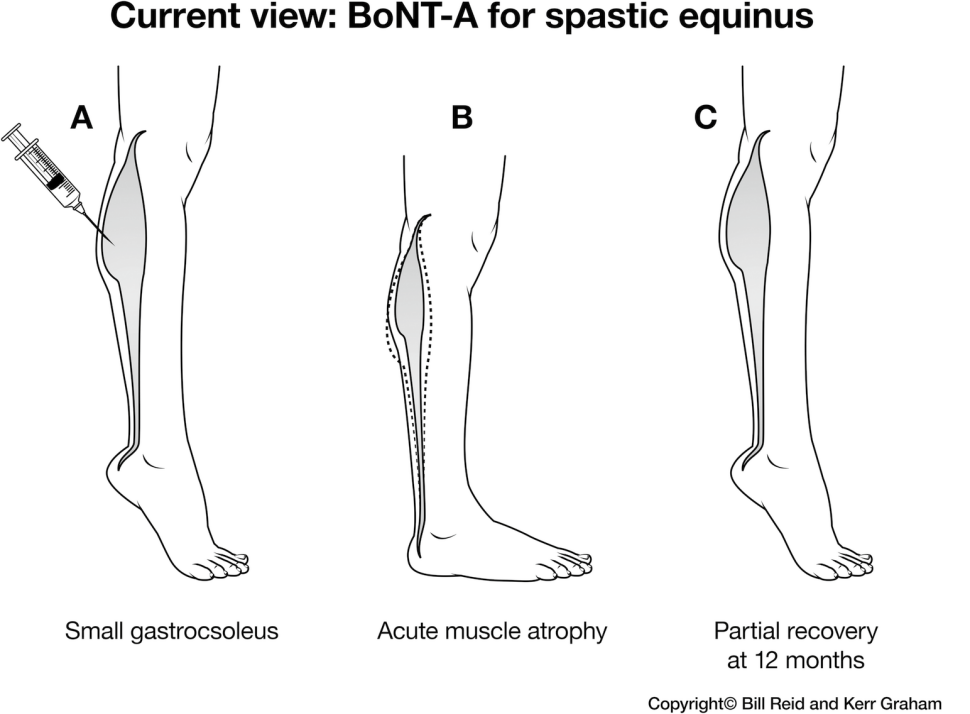
Grupy z Leuven i Perth przodują w mierzeniu zmian objętości i morfologii mięśni po wstrzyknięciu BoNT-A, przy użyciu seryjnego MRI lub 3DUS124,125. Zgłosili oni mniejsze zmniejszenie objętości mięśni niż zgłoszono w badaniach na zwierzętach, co jest zachęcające124,125. Zmiany objętości mięśni mogą być związane ze stanem mięśni przed wstrzyknięciem. Oczekuje się, że atrofia i regeneracja mięśni będą się różnić u dzieci z CP, typowo rozwijających się ochotników i zwierząt doświadczalnych. Ostatnio odnotowano zmiany w intensywności echa w mięśniach dzieci z CP na początku i po wstrzyknięciu BoNT-A 25,26,124,126. Należy wziąć pod uwagę jakość mięśni, a także ich objętość, w szczególności wpływ wstrzyknięć BoNT-A zarówno na elementy kurczliwe, jak i niekurczliwe mięśni szkieletowych93,94. Zmniejszenie objętości mięśni w połączeniu ze wzrostem intensywności echa może sygnalizować podwójny uraz związany z zanikiem i zwłóknieniem mięśni126. Istnieje pilna potrzeba nieinwazyjnego monitorowania struktury i funkcji mięśni podczas leczenia BoNT-A.
8 Wnioski
Biorąc pod uwagę, że dwa badania RCT sugerują, że wstrzyknięcie raz na 12 miesięcy jest tak samo skuteczne jak wstrzyknięcie co 4 miesiące, sugerujemy zmniejszenie częstotliwości wstrzykiwania BoNT-A, aby dopasować się do tych dowodów. Byłoby to również zgodne z dowodami z badań na modelach zwierzęcych91-94. Proponujemy, aby pomiar objętości mięśni był wykonywany przed wstrzyknięciem BoNT-A i w regularnych odstępach czasu podczas fazy leczenia, aby w jak największym stopniu ograniczyć jatrogenny zanik mięśni i zwłóknienie.
Sugerujemy, aby obiektywna ocena każdego cyklu iniekcji była przeprowadzana ze świadomością, że istnieje „prawo malejących zysków” w przypadku powtarzania iniekcji, szczególnie w przypadku mięśnia brzuchatego łydki (ryc. 5). Zaprzestanie wstrzykiwania, gdy mięsień przestaje reagować, jest nie tylko akceptowalne, ale także dobrym lekarstwem, nawet jeśli dziecko i rodzina nie są gotowi na ostateczną operację (ryc. 5). Wiedza o tym, kiedy przestać, zależy w dużej mierze od rozpoznania progresji od przykurczu dynamicznego do utrwalonego (ryc. 3). Lepsza komunikacja między osobami wstrzykującymi BoNT-A a chirurgami ułatwiłaby ten proces.
Jest jeszcze wiele do zrobienia, aby poprawić bezpieczeństwo iniekcji BoNT-A poprzez zmianę protokołów iniekcji i zastosowanie środków pomocniczych, takich jak wzmocnienie mięśni w celu złagodzenia skutków atrofii wywołanej BoNT-A22,124-126.
Żródło: Pediatric Drugs (2019) 21:261–281
© 2019 The Authors
Adaptacja: Wiesław Marciniak
Na podstawie licencji CC BY
(http://creativecommons.org/licenses/by/4.0/)
- Koman LA, Mooney JF 3rd, Smith B, Goodman A, Mulvaney T. Management of cerebral palsy with botulinum-A toxin: preliminary investigation. J Pediatr Orthop. 1993;13(4):489–95.
- Cosgrove AP, Corry IS, Graham HK. Botulinum toxin in the management of the lower limb in cerebral palsy. Dev Med Child Neurol. 1994;36(5):386–96.
- Graham HK, Aoki KR, Autti-Ramo I, Boyd RN, Delgado MR, Gaebler-Spira DJ, et al. Recommendations for the use of botulinum toxin type A in the management of cerebral palsy. Gait Posture. 2000;11(1):67–79.
- Heinen F, Molenaers G, Fairhurst C, Carr LJ, Desloovere K, Chaleat Valayer E, et al. European consensus table 2006 on botulinum toxin for children with cerebral palsy. Eur J Paediatr Neurol. 2006;10(5–6):215–25.
- Heinen F, Desloovere K, Schroeder AS, Berweck S, Borggraefe I, van Campenhout A, et al. The updated European Consensus 2009 on the use of botulinum toxin for children with cerebral palsy. Eur J Paediatr Neurol. 2010;14(1):45–66.
- Love SC, Novak I, Kentish M, Desloovere K, Heinen F, Molenaers G, et al. Botulinum toxin assessment, intervention and aftercare for lower limb spasticity in children with cerebral palsy: international consensus statement. Eur J Neurol. 2010;17(Suppl. 2):9–37.
- Multani I, Manji J, Tang MJ, Howard J, Graham HK. Sarcopenia, botulinum toxin A and cerebral palsy. J Bone Jt Surg Am. 2019. (in press).
- Gough M, Fairhurst C, Shortland AP. Botulinum toxin and cerebral palsy: time for reflection? Dev Med Child Neurol. 2005;47(10):709–12.
- Corry IS, Cosgrove AP, Walsh EG, McClean D, Graham HK. Botulinum toxin A in the hemiplegic upper limb: a double-blind trial. Dev Med Child Neurol. 1997;39(3):185–93.
- Fehlings D, Rang M, Glazier J, Steele C. An evaluation of botulinum-A toxin injections to improve upper extremity function in children with hemiplegic cerebral palsy. J Pediatr. 2000;137(3):331–7.
- Copeland L, Edwards P, Thorley M, Donaghey S, Gascoigne- Pees L, Kentish M, et al. Botulinum toxin A for nonambulatory children with cerebral palsy: a double blind randomized controlled trial. J Pediatr. 2014;165(1):140–46.e4.
- Pin TW, Elmasry J, Lewis J. Efficacy of botulinum toxin A in children with cerebral palsy in gross motor function classification system levels IV and V: a systematic review. Dev Med Child Neurol. 2013;55(4):304–13.
- Berweck S, Schroeder AS, Fietzek UM, Heinen F. Sonographyguided injection of botulinum toxin in children with cerebral palsy. Lancet. 2004;363(9404):249–50.
- Barber L, Hastings-Ison T, Baker R, Barrett R, Lichtwark G. Medial gastrocnemius muscle volume and fascicle length in children aged 2 to 5 years with cerebral palsy. Dev Med Child Neurol. 2011;53(6):543–8.
- Fry NR, Gough M, Shortland AP. Three-dimensional realisation of muscle morphology and architecture using ultrasound. Gait Posture. 2004;20(2):177–82.
- Fehlings D, Novak I, Berweck S, Hoare B, Stott NS, Russo RN, et al. Botulinum toxin assessment, intervention and follow-up for paediatric upper limb hypertonicity: international consensus statement. Eur J Neurol. 2010;17(Suppl. 2):38–56.
- Nahm NJ, Graham HK, Gormley ME Jr, Georgiadis AG. Management of hypertonia in cerebral palsy. Curr Opin Pediatr. 2018;30(1):57–64.
- Jankovic J. Botulinum toxin: state of the art. Mov Disord. 2017;32(8):1131–8.
- Graham HK, Rosenbaum P, Paneth N, Dan B, Lin JP, Damiano DL, et al. Cerebral palsy. Nat Rev Dis Primers. 2016;2:15082.
- Albanese A. Terminology for preparations of botulinum neurotoxins: what a difference a name makes. JAMA. 2011;305(1):89–90.
- Rosenbaum P, Paneth N, Leviton A, Goldstein M, Bax M, Damiano D, et al. A report: the definition and classification of cerebral palsy April 2006. Dev Med Child Neurol Suppl. 2007;109:8–14.
- Leonard J, Graham H. Treatment of motor disorders in cerebral palsy with botulinum neurotoxin. In: Jankovic J, Albanese A, Atassi MZ, Dolly JO, Hallett M, Mayer NH, editors. Botulinum toxin: therapeutic clinical practice and science. Philadelphia: Saunders Elsevier; 2009. p. 172–91.
- Graham HK, Selber P. Musculoskeletal aspects of cerebral palsy. J Bone Jt Surg Br. 2003;85(2):157–66.
- Graham HK, Thomason PNTF. Cerebral palsy. In: Weinstein SL, Ponseti IVJM, editors. Lovell and Winter’s pediatric orthopaedics. 7th ed. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins; 2014. p. 484–554.
- Gough M, Shortland AP. Could muscle deformity in children with spastic cerebral palsy be related to an impairment of muscle growth and altered adaptation? Dev Med Child Neurol. 2012;54(6):495–9.
- Barrett RS, Lichtwark GA. Gross muscle morphology and structure in spastic cerebral palsy: a systematic review. Dev Med Child Neurol. 2010;52(9):794–804.
- Cans C. Surveillance of cerebral palsy in Europe: a collaboration of cerebral palsy surveys and registers. Dev Med Child Neurol. 2000;42(12):816–24.
- Palisano R, Rosenbaum P, Walter S, Russell D, Wood E, Galuppi B. Development and reliability of a system to classify gross motor function in children with cerebral palsy. Dev Med Child Neurol. 1997;39(4):214–23.
- Lin JP. The contribution of spasticity to the movement disorder of cerebral palsy using pathway analysis: does spasticity matter? Dev Med Child Neurol. 2011;53(1):7–9.
- Sanger TD, Chen D, Fehlings DL, Hallett M, Lang AE, Mink JW, et al. Definition and classification of hyperkinetic movements in childhood. Mov Disord. 2010;25(11):1538–49.
- Howard J, Soo B, Graham HK, Boyd RN, Reid S, Lanigan A, et al. Cerebral palsy in Victoria: motor types, topography and gross motor function. J Paediatr Child Health. 2005;41(9–10):479–83.
- Pandyan AD, Gregoric M, Barnes MP, Wood D, Van Wijck F, Burridge J, et al. Spasticity: clinical perceptions, neurological realities and meaningful measurement. Disabil Rehabil. 2005;27(1–2):2–6.
- Cosgrove AP, Graham HK. Botulinum toxin A prevents the development of contractures in the hereditary spastic mouse. Dev Med Child Neurol. 1994;36(5):379–85.
- Schiariti V, Selb M, Cieza A, O’Donnell M. International classification of functioning, disability and Health core sets for children and youth with cerebral palsy: a consensus meeting. Dev Med Child Neurol. 2015;57(2):149–58.
- Mutlu A, Livanelioglu A, Gunel MK. Reliability of Ashworth and Modified Ashworth scales in children with spastic cerebral palsy. BMC Musculoskelet Disord. 2008;9:44.
- Yam WK, Leung MS. Interrater reliability of Modified Ashworth Scale and Modified Tardieu Scale in children with spastic cerebral palsy. J Child Neurol. 2006;21(12):1031–5.
- Gracies JM, Burke K, Clegg NJ, Browne R, Rushing C, Fehlings D, et al. Reliability of the Tardieu Scale for assessing spasticity in children with cerebral palsy. Arch Phys Med Rehabil. 2010;91(3):421–8.
- Haugh AB, Pandyan AD, Johnson GR. A systematic review of the Tardieu Scale for the measurement of spasticity. Disabil Rehabil. 2006;28(15):899–907.
- Bar-On L, Aertbelien E, Molenaers G, Dan B, Desloovere K. Manually controlled instrumented spasticity assessments: a systematic review of psychometric properties. Dev Med Child Neurol. 2014;56(10):932–50.
- Wood DE, Burridge JH, van Wijck FM, McFadden C, Hitchcock RA, Pandyan AD, et al. Biomechanical approaches applied to the lower and upper limb for the measurement of spasticity: a systematic review of the literature. Disabil Rehabil. 2005;27(1–2):19–32.
- Barwood S, Baillieu C, Boyd R, Brereton K, Low J, Nattrass G, et al. Analgesic effects of botulinum toxin A: a randomized, placebo-controlled clinical trial. Dev Med Child Neurol. 2000;42(2):116–21.
- Thomason P, Willoughby K, Graham HK. Orthopaedic assessment. In: Dan B, Paneth N, Rosenbloom L, editors. Cerebral palsy: science and clinical practice. London: Mac Keith Press; 2014. p. 287–312.
- Hastings-Ison T, Blackburn C, Opie NL, Graham HK, Rawicki B, Wolfe R, et al. Reproducibility of an instrumented measure for passive ankle dorsiflexion in conscious and anaesthetized children with cerebral palsy. Dev Med Child Neurol. 2014;56(4):378–85.
- Law M, Cooper B, Strong S, Stewart D, Rigby P, Letts L. The person-environment-occupation model: a transactive approach to occupational performance. Can J Occup Ther. 1996;63(1):9–23.
- Molenaers G, Desloovere K, Eyssen M, Decat J, Jonkers I, De Cock P. Botulinum toxin type A treatment of cerebral palsy: an integrated approach. Eur J Neurol. 1999;6(Suppl 4):51-S7.
- Rethlefsen SA, Blumstein G, Kay RM, Dorey F, Wren TA. Prevalence of specific gait abnormalities in children with cerebral palsy revisited: influence of age, prior surgery, and Gross Motor Function Classification System level. Dev Med Child Neurol. 2017;59(1):79–88.
- Wren TA, Rethlefsen S, Kay RM. Prevalence of specific gait abnormalities in children with cerebral palsy: influence of cerebral palsy subtype, age, and previous surgery. J Pediatr Orthop. 2005;25(1):79–83.
- Molenaers G, Fagard K, Van Campenhout A, Desloovere K. Botulinum toxin A treatment of the lower extremities in children with cerebral palsy. J Child Orthop. 2013;7(5):383–7.
- Koman LA, Mooney JF 3rd, Smith BP, Goodman A, Mulvaney T. Management of spasticity in cerebral palsy with botulinum-A toxin: report of a preliminary, randomized, double-blind trial. J Pediatr Orthop. 1994;14(3):299–303.
- Corry IS, Cosgrove AP, Duffy CM, McNeill S, Taylor TC, Graham HK. Botulinum toxin A compared with stretching casts in the treatment of spastic equinus: a randomised prospective trial. J Pediatr Orthop. 1998;18(3):304–11.
- Mackey AH, Lobb GL, Walt SE, Stott NS. Reliability and validity of the Observational Gait Scale in children with spastic diplegia. Dev Med Child Neurol. 2003;45(1):4–11.
- Read FA, Boyd RN, Barber LA. Longitudinal assessment of gait quality in children with bilateral cerebral palsy following repeated lower limb intramuscular botulinum toxin-A injections. Res Dev Disabil. 2017;68:35–41.
- Read HS, Hazlewood ME, Hillman SJ, Prescott RJ, Robb JE. Edinburgh visual gait score for use in cerebral palsy. J Pediatr Orthop. 2003;23(3):296–301.
- Sutherland DH, Kaufman KR, Wyatt MP, Chambers HG, Mubarak SJ. Double-blind study of botulinum A toxin injections into the gastrocnemius muscle in patients with cerebral palsy. Gait Posture. 1999;10(1):1–9.
- Baker R, McGinley JL, Schwartz MH, Beynon S, Rozumalski A, Graham HK, et al. The gait profile score and movement analysis profile. Gait Posture. 2009;30(3):265–9.
- Hastings-Ison T, Sangeux M, Thomason P, Rawicki B, Fahey M, Graham HK. Onabotulinum toxin-A (Botox) for spastic equinus in cerebral palsy: a prospective kinematic study. J Child Orthop. 2018;12(4):390–7.
- Russell DJ, Rosenbaum PL, Wright M, Avery LM. Gross motor function measure (GMFM-66 & GMFM-88) user’s manual. 3rd ed. London: Mac Keith Press; 2002.
- Reddihough DS, King JA, Coleman GJ, Fosang A, McCoy AT, Thomason P, et al. Functional outcome of botulinum toxin A injections to the lower limbs in cerebral palsy. Dev Med Child Neurol. 2002;44(12):820–7.
- Scholtes VA, Dallmeijer AJ, Knol DL, Speth LA, Maathuis CG, Jongerius PH. The combined effect of lower-limb multilevel Botulinum Toxin A and comprehensive rehabiliation on mobility in children with cerebral palsy: a randomised clinical trial. Arch Phys Med Rehabil. 2006;87(12):1551–8.
- Palisano RJ, Cameron D, Rosenbaum PL, Walter SD, Russell D. Stability of the gross motor function classification system. Dev Med Child Neurol. 2006;48(6):424–8.
- Howell K, Selber P, Graham HK, Reddihough D. Botulinum neurotoxin A: an unusual systemic effect. J Paediatr Child Health. 2007;43(6):499–501.
- Albright AL, Cervi A, Singletary J. Intrathecal baclofen for spasticity in cerebral palsy. JAMA. 1991;265(11):1418–22.
- Narayanan UG, Fehlings D, Weir S, Knights S, Kiran S, Campbell K. Initial development and validation of the Caregiver Priorities and Child Health Index of Life with Disabilities (CPCHILD). Dev Med Child Neurol. 2006;48(10):804–12.
- Eliasson AC, Krumlinde-Sundholm L, Rosblad B, Beckung E, Arner M, Ohrvall AM, et al. The Manual Ability Classification System (MACS) for children with cerebral palsy: scale development and evidence of validity and reliability. Dev Med Child Neurol. 2006;48(7):549–54.
- House JH, Gwathmey FW, Fidler MO. A dynamic approach to the thumb-in palm deformity in cerebral palsy. J Bone Jt Surg Am. 1981;63(2):216–25.
- Klingels K, De Cock P, Molenaers G, Desloovere K, Huenaerts C, Jaspers E, et al. Upper limb motor and sensory impairments in children with hemiplegic cerebral palsy. Can they be measured reliably? Disabil Rehabil. 2010;32(5):409–16.
- Wagner LV, Davids JR. Assessment tools and classification systems used for the upper extremity in children with cerebral palsy. Clin Orthop Relat Res. 2012;470(5):1257–71.
- Patrick JH, Roberts AP, Cole GF. Therapeutic choices in the locomotor management of the child with cerebral palsy—more luck than judgement? Arch Dis Child. 2001;85(4):275–9.
- Delgado MR, Hirtz D, Aisen M, Ashwal S, Fehlings DL, McLaughlin J, et al. Practice parameter: pharmacologic treatment of spasticity in children and adolescents with cerebral palsy (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology and the Practice Committee of the Child Neurology Society. Neurology. 2010;74(4):336–43.
- Verrotti A, Greco R, Spalice A, Chiarelli F, Iannetti P. Pharmacotherapy of spasticity in children with cerebral palsy. Pediatr Neurol. 2006;34(1):1–6.
- Masson R, Pagliano E, Baranello G. Efficacy of oral pharmacological treatments in dyskinetic cerebral palsy: a systematic review. Dev Med Child Neurol. 2017;59(12):1237–48.
- Albright AL. Spasticity and movement disorders in cerebral palsy. J Child Neurol. 1996;11(Suppl. 1):1–4.
- Dai AI, Aksoy SN, Demiryurek AT. Comparison of efficacy and side effects of oral baclofen versus tizanidine therapy with adjuvant botulinum toxin type A in children with cerebral palsy and spastic equinus foot deformity. J Child Neurol. 2016;31(2):184–9.
- 15 Dai AI, Wasay M, Awan S. Botulinum toxin type A with oral baclofen versus oral tizanidine: a nonrandomized pilot comparison in patients with cerebral palsy and spastic equinus foot deformity. J Child Neurol. 2008;23(12):1464–6.
- Gooch JL, Patton CP. Combining botulinum toxin and phenol to manage spasticity in children. Arch Phys Med Rehabil. 2004;85(7):1121–4.
- Buizer AI, Martens BHM, van Ravenhorst GC, Schoonmade LJ, Becher JG, Vermeulen RJ. Effect of continuous intrathecal baclofen therapy in children: a systematic review. Dev Med Child Neurol. 2019;61(2):128–34.
- Vidailhet M, Yelnik J, Lagrange C, Fraix V, Grabli D, Thobois S, et al. Bilateral pallidal deep brain stimulation for the treatment of patients with dystonia-choreoathetosis cerebral palsy: a prospective pilot study. Lancet Neurol. 2009;8(8):709–17.
- Khot A, Sloan S, Desai S, Harvey A, Wolfe R, Graham HK. Adductor release and chemodenervation in children with cerebral palsy: a pilot study in 16 children. J Child Orthop. 2008;2(4):293–9.
- Koman LA, Mooney JF 3rd, Smith BP. Neuromuscular blockade in the management of cerebral palsy. J Child Neurol. 1996;11(Suppl. 1):23–8.
- Montal M. Botulinum neurotoxin: a marvel of protein design. Annu Rev Biochem. 2010;79:591–617.
- Cocco A, Albanese A. Recent developments in clinical trials of botulinum neurotoxins. Toxicon. 2018;147:77–83.
- Simpson DM, Gracies JM, Graham HK, Miyasaki JM, Naumann M, Russman B, et al. Assessment: botulinum neurotoxin for the treatment of spasticity (an evidence-based review): report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. Neurology. 2008;70(19):1691–8.
- de Paiva A, Meunier FA, Molgo J, Aoki KR, Dolly JO. Functional repair of motor endplates after botulinum neurotoxin type A poisoning: biphasic switch of synaptic activity between nerve sprouts and their parent terminals. Proc Natl Acad Sci USA. 1999;96(6):3200–5.
- Koerte IK, Schroeder AS, Fietzek UM, Borggraefe I, Kerscher M, Berweck S, et al. Muscle atrophy beyond the clinical effect after a single dose of OnabotulinumtoxinA injected in the procerus muscle: a study with magnetic resonance imaging. Dermatol Surg. 2013;39(5):761–5.
- Schroeder AS, Ertl-Wagner B, Britsch S, Schroder JM, Nikolin S, Weis J, et al. Muscle biopsy substantiates long-term MRI alterations one year after a single dose of botulinum toxin injected into the lateral gastrocnemius muscle of healthy volunteers. Mov Disord. 2009;24(10):1494–503.
- Borton DC, Walker K, Pirpiris M, Nattrass GR, Graham HK. Isolated calf lengthening in cerebral palsy. Outcome analysis of risk factors. J Bone Jt Surg Br. 2001;83(3):364–70.
- Firth GB, Passmore E, Sangeux M, Thomason P, Rodda J, Donath S, et al. Multilevel surgery for equinus gait in children with spastic diplegic cerebral palsy: medium-term follow-up with gait analysis. J Bone Jt Surg Am. 2013;95(10):931–8.
- Thomason P, Baker R, Dodd K, Taylor N, Selber P, Wolfe R, et al. Single-event multilevel surgery in children with spastic diplegia: a pilot randomized controlled trial. J Bone Jt Surg Am. 2011;93(5):451–60.
- Boyd RN, Graham HK. Objective measurement of clinical findings in the use of botulinum toxin type A for the management of children with cerebral palsy. Eur J Neurol. 1999;6(Suppl. 4):23–35.
- Baker R, Jasinski M, Maciag-Tymecka I, Michalowska-Mrozek J, Bonikowski M, Carr L, et al. Botulinum toxin treatment of spasticity in diplegic cerebral palsy: a randomized, double-blind, placebo-controlled, dose-ranging study. Dev Med Child Neurol. 2002;44(10):666–75.
- Kanovsky P, Bares M, Severa S, Richardson A, Dysport Paediatric Limb Spasticity Study G. Long-term efficacy and tolerability of 4-monthly versus yearly botulinum toxin type A treatment for lower-limb spasticity in children with cerebral palsy. Dev Med Child Neurol. 2009;51(6):436–45.
- Hastings-Ison T, Blackburn C, Rawicki B, Fahey M, Simpson P, Baker R, et al. Injection frequency of botulinum toxin A for spastic equinus: a randomized clinical trial. Dev Med Child Neurol. 2016;58(7):750–7.
- Fortuna R, Vaz MA, Youssef AR, Longino D, Herzog W. Changes in contractile properties of muscles receiving repeat injections of botulinum toxin (Botox). J Biomech. 2011;44(1):39–44.
- Minamoto VB, Suzuki KP, Bremner SN, Lieber RL, Ward SR. Dramatic changes in muscle contractile and structural properties after 2 botulinum toxin injections. Muscle Nerve. 2015;52(4):649–57.
- Chin TY, Nattrass GR, Selber P, Graham HK. Accuracy of intramuscular injection of botulinum toxin A in juvenile cerebral palsy: a comparison between manual needle placement and placement guided by electrical stimulation. J Pediatr Orthop. 2005;25(3):286–91.
- Eames NW, Baker R, Hill N, Graham K, Taylor T, Cosgrove A. The effect of botulinum toxin A on gastrocnemius length: magnitude and duration of response. Dev Med Child Neurol. 1999;41(4):226–32.
- Corry IS, Cosgrove AP, Duffy CM, Taylor TC, Graham HK. Botulinum toxin A in hamstring spasticity. Gait Posture. 1999;10(3):206–10.
- Thompson NS, Baker RJ, Cosgrove AP, Corry IS, Graham HK. Musculoskeletal modelling in determining the effect of botulinum toxin on the hamstrings of patients with crouch gait. Dev Med Child Neurol. 1998;40(9):622–5.
- Desloovere K, Molenaers G, Jonkers I, De Cat J, De Borre L, Nijs J, et al. A randomized study of combined botulinum toxin type A and casting in the ambulant child with cerebral palsy using objective outcome measures. Eur J Neurol. 2001;8(Suppl. 5):75–87.
- Bakheit AMO. Botulinum toxin as a stand-alone treatment for muscle spasticity: review of the evidence. J Neurol Disord. 2013;1(1):109.
- Boyd RN, Dobson F, Parrott J, Love S, Oates J, Larson A, et al. The effect of botulinum toxin type A and a variable hip abduction orthosis on gross motor function: a randomized controlled trial. Eur J Neurol. 2001;8(Suppl. 5):109–19.
- Graham HK, Boyd R, Carlin JB, Dobson F, Lowe K, Nattrass G, et al. Does botulinum toxin a combined with bracing prevent hip displacement in children with cerebral palsy and “hips at risk”? A randomized, controlled trial. J Bone Jt Surg Am. 2008;90(1):23–33.
- Willoughby K, Ang SG, Thomason P, Graham HK. The impact of botulinum toxin A and abduction bracing on long-term hip development in children with cerebral palsy. Dev Med Child Neurol. 2012;54(8):743–7.
- Naidu K, Smith K, Sheedy M, Adair B, Yu X, Graham HK. Systemic adverse events following botulinum toxin A therapy in children with cerebral palsy. Dev Med Child Neurol. 2010;52(2):139–44.
- Montastruc J, Marque P, Moulis F, Bourg V, Lambert V, Durrieu G, et al. Adverse drug reactions of botulinum neurotoxin type A in children with cerebral palsy: a pharmaco-epidemiological study in VigiBase. Dev Med Child Neurol. 2017;59(3):329–34.
- Lundy CT, Doherty GM, Fairhurst CB. Botulinum toxin type A injections can be an effective treatment for pain in children with hip spasms and cerebral palsy. Dev Med Child Neurol. 2009;51(9):705–10.
- Graham HK. Unpublished data. 2019.
- Ostojic K, Paget SP, Morrow AM. Management of pain in children and adolescents with cerebral palsy: a systematic review. Dev Med Child Neurol. 2019;61(3):315–21.
- Boyd RN, Morris ME, Graham HK. Management of upper limb dysfunction in children with cerebral palsy: a systematic review. Eur J Neurol. 2001;8(Suppl. 5):150–66.
- Sakzewski L, Ziviani J, Boyd RN. Efficacy of upper limb therapies for unilateral cerebral palsy: a meta-analysis. Pediatrics. 2014;133(1):e175–204.
- Chin TY, Duncan JA, Johnstone BR, Graham HK. Management of the upper limb in cerebral palsy. J Pediatr Orthop B. 2005;14(6):389–404.
- Wallen M, O’Flaherty SJ, Waugh MC. Functional outcomes of intramuscular botulinum toxin type a and occupational therapy in the upper limbs of children with cerebral palsy: a randomized controlled trial. Arch Phys Med Rehabil. 2007;88(1):1–10.
- Olesch CA, Greaves S, Imms C, Reid SM, Graham HK. Repeat botulinum toxin-A injections in the upper limb of children with hemiplegia: a randomized controlled trial. Dev Med Child Neurol. 2010;52(1):79–86.
- Speth LA, Leffers P, Janssen-Potten YJ, Vles JS. Botulinum toxin A and upper limb functional skills in hemiparetic cerebral palsy: a randomized trial in children receiving intensive therapy. Dev Med Child Neurol. 2005;47(7):468–73.
- Hoare BJ, Imms C. Upper-limb injections of botulinum toxin-A in children with cerebral palsy: a critical review of the literature and clinical implications for occupational therapists. Am J Occup Ther. 2004;58(4):389–97.
- Van Heest AE, Bagley A, Molitor F, James MA. Tendon transfer surgery in upper-extremity cerebral palsy is more effective than botulinum toxin injections or regular, ongoing therapy. J Bone Jt Surg Am. 2015;97(7):529–36.
- Safarpour Y, Jabbari B. Botulinum toxin treatment of pain syndromes – an evidence based review. Toxicon. 2018;147:120–8.
- Parkinson KN, Gibson L, Dickinson HO, Colver AF. Pain in children with cerebral palsy: a cross-sectional multicentre European study. Acta Paediatr. 2010;99(3):446–51.
- Will E, Magill N, Arnold R, Davies M, Doherty G, Fairhurst C, et al. Preoperative botulinum neurotoxin A for children with bilateral cerebral palsy undergoing major hip surgery: a randomized double-blind placebo-controlled trial. Dev Med Child Neurol. 2019;. https ://doi.org/10.1111/dmcn.14145 .
- Crowner BE, Brunstrom JE, Racette BA. Iatrogenic botulism due to therapeutic botulinum toxin a injection in a pediatric patient. Clin Neuropharmacol. 2007;30(5):310–3.
- Roche N, Schnitzler A, Genet FF, Durand MC, Bensmail D. Undesirable distant effects following botulinum toxin type a injection. Clin Neuropharmacol. 2008;31(5):272–80.
- O’Flaherty SJ, Janakan V, Morrow AM, Scheinberg AM, Waugh MC. Adverse events and health status following botulinum toxin type A injections in children with cerebral palsy. Dev Med Child Neurol. 2011;53(2):125–30.
- Fortuna R, Horisberger M, Vaz MA, Herzog W. Do skeletal muscle properties recover following repeat onabotulinum toxin A injections? J Biomech. 2013;46(14):2426–33.
- Alexander C, Elliott C, Valentine J, Stannage K, Bear N, Donnelly CJ, et al. Muscle volume alterations after first botulinum neurotoxin A treatment in children with cerebral palsy: a 6-month prospective cohort study. Dev Med Child Neurol. 2018;60(11):1165–71.
- Williams SA, Reid S, Elliott C, Shipman P, Valentine J. Muscle volume alterations in spastic muscles immediately following botulinum toxin type-A treatment in children with cerebral palsy. Dev Med Child Neurol. 2013;55(9):813–20.
- Schless SH, Cenni F, Bar-On L, Hanssen B, Kalkman B, O’Brien T, et al. Medial gastrocnemius volume and echo-intensity after botulinum neurotoxin A interventions in children with spastic cerebral palsy. Dev Med Child Neurol. 2019;61(7):783–90. https ://doi.org/10.1111/dmcn.14056 .