Wprowadzenie
Stosowanie neuromodulacji w leczeniu objawów pęcherza nadreaktywnego, zatrzymania moczu i nietrzymania stolca u dzieci opornych na leczenie farmakologiczne jest dobrze udokumentowane. Zwykle stosowaną opcją terapeutyczną jest neuromodulacja krzyżowa, czyli zabieg chirurgiczny podczas którego elektroda umieszczana jest w otworze krzyżowym S3 lub poprzez przezskórną stymulację nerwu piszczelowego tylnego (percutaneous electrical nerve stimulation - PENS) podczas cotygodniowych sesji. U dzieci, jedna seria neuromodulacji krzyżowej wydaje się być bardziej skuteczna w leczeniu pęcherza nadreaktywnego od stymulacji nerwu piszczelowego tylnego, ale daje podobne rezultaty terapeutyczne w przypadku nietrzymania moczu1.
Przezskórna elektryczna stymulacja nerwów (TENS) jest mniej inwazyjną i bardziej dostępną formą neuromodulacji zaaprobowaną przez FDA.
Skutki uboczne stosowania TENS są rzadkie i należą do nich ból i podrażnienie skóry, które mogą być łagodzone poprzez odpowiednią higienę a także mniejszą częstotliwość wymiany czy usuwania podkładek elektrodowych2,3. Badania na kotach pokazują, że przezskórna stymulacja elektryczna nerwów (TENS) w obrębie łapy hamuje odruchową aktywność pęcherza4, Z kolei małe badanie kohortowe prowadzone z udziałem ludzi wskazało na pozytywne działanie TENS z podkładką umieszczoną w dolnej części stopy na opóźnienie uczucia wypełnienia pęcherza i zwiększenia pojemności pęcherza bez wywoływania odruchu opróżnienia5. U dzieci z objawami dolnych dróg moczowych, TENS z elektrodami umieszczonymi nad kością krzyżową daje obiecujące wyniki, kiedy stymulacja odbywa się wiele razy tygodniowo6,7,8. Z kolei, Bouali i wsp. wykazali, że stymulacja nerwu piszczelowego tylnego za pomocą TENS wpływa na lepszą kontrolę oddawania moczu w czasie dnia i nocy9.
Pierwotne, jednoobjawowe moczenie nocne jest częstym problemem zdrowotnym dzieci mającym wiele przyczyn. Kiedy początkowe strategie terapii behawioralnej (takie jak modyfikacja diety, ilości wypijanych płynów) zawodzą, zakładane są alarmy wybudzeniowe lub stosowana jest farmakoterapia. Jednak metody te nie są skuteczne u znacznego odsetka chorych. Neuromodulacja nie została dokładnie przebadana u dzieci z opornym na leczenie NE. Elektroakupunktura natomiast wydaje się być skuteczną formą terapii gdy stosowana jest przez długi czas10,11. Lordello oceniał działanie TENS z elektrodami umieszczonymi w obszarze kości krzyżowej u pacjentów z moczeniem niejednoobjawowym i stwierdził poprawę lub ustąpienie moczenia nocnego u większości pacjentów, ale 30%-40% pacjentów nie doświadczyło pełnego wyleczenia12. Oliveira zastosował ten sam protokół w przypadku moczenia jednoobjawowego i pomimo zmniejszenia liczby „mokrych nocy”, żaden pacjent nie został całkowicie wyleczony13. Protokoły opisywane w lietaraturze są wykonywane w warunkach klinicznych, co może być niekomfortowe dla pacjenta i negatywnie wpływać na przestrzeganie zaleceń. W 2017 roku
Ferroni badał wpływ TENS wykonywanej w nocy z elektrodami umieszczonymi na stopie przez okres dwóch tygodni i zauważył niewielki wzrost liczby „suchych nocy”, z trwałą poprawą 2 tygodnie po leczeniu bez wystąpienia działań niepożądanych14.
Projekt badania i kryteria wyboru pacjentów
Przeprowadzono randomizowane badanie kliniczne w celu oceny skuteczności TENS w leczeniu jednoobjawowego NE u dzieci i młodzieży.
Kryteria włączenia obejmowały wiek 5-18 lat z jednoobjawowym NE występującym co najmniej dwa razy w tygodniu, nieudaną terapię behawioralną lub farmakologiczną oraz spełnienie wymagań badawczych.
Kryteria wykluczenia obejmowały pacjentów leczonych w ciągu ostatnich 30 dni środkami farmakologicznymi, alarmem wybudzeniowym lub inną alternatywną terapią, zgłaszanie objawów dolnych dróg moczowych w ciągu dnia lub objawy nietrzymania moczu, przyjmowanie leków mogących spowodować dysfunkcję pęcherza moczowego (np. lit, leki psychotropowe), inne zaburzenia predysponujące do zaburzeń mikcji (np. przepuklina oponowo-rdzeniowa, występowanie zastawki cewki tylnej, śródmiąższowe zapalenie pęcherza moczowego), przeciwwskazania do stosowania TENS (choroba serca, wszczepiony rozrusznik serca lub inne urządzenie, obrzęk limfatyczny, ciąża, nowotwór złośliwy) lub wcześniejsze zastosowanie terapii neuromodulacyjnej.
Projekt badania
Dzień 0: rozpoczęto terapię behawioralną, w tym ograniczenie wieczornego picia na dwie godziny przed snem, zwiększenie spożycia płynów w ciągu dnia, aby zapobiec odwodnieniu w nocy, ograniczenie spożycia substancji podrażniających pęcherz, takich jak kofeina i cukier, ograniczenie wieczornego spożycia soli, oddawanie moczu w regularnych odstępach czasu, kontrolowanie uczucia niepełnego wypróżnienia pęcherza, szczególnie przed snem, zapobieganie zaparciom w razie potrzeby i praca nad czynnikami lęku społecznego. Pacjenci i opiekunowie wypełnili Kwestionariusz Pediatrycznego Nietrzymania Moczu (PIN-Q) w celu oceny jakości życia (QoL) dzieci z dysfunkcją pęcherza15. Poproszono również o wypełnianie dziennika nocnego oddawania moczu (miesiąc 1), rejestrując epizody nocnego nietrzymania moczu, subiektywną ocenę „mokrych prześcieradeł” (0-3: suche, wilgotne, mokre, przemoczone), wszelkie epizody nietrzymania moczu w ciągu dnia, wypróżnienia przez 30 dni z rzędu po włączeniu do badania.
Po 30 dniach, pacjenci lub ich opiekunowie zostali ponownie poproszeni o wypełnienie Kwestionariusza PIN-Q. Jeśli pacjenci prowadzili dziennik mikcji i nadal spełniali kryteria włączenia, zostali losowo przydzieleni do jednej z trzech grup zróżnicowanych w oparciu o umiejscowienie podkładki elektrodowej: 1. nadłonowe (Suprapubic - SP), z obiema elektrodami umieszczonymi na brzuchu bezpośrednio nad pęcherzem; 2. okolica kości krzyżowej (Parasacral - PS), z elektrodami umieszczonymi na poziomie S3 i 3. nerw piszczelowy tylny (Posteriol Tibial - PT), z elektrodami umieszczonymi na spodzie stopy i nad tylną częścią kostki przyśrodkowej. Sesje TENS wykonywano przez 15 minut każdej nocy przed snem, przestrzegając terapii behawioralnej przez 30 kolejnych dni. Dzienniki mikcji prowadzone w miesiącu 2 były aktualizowane co noc, dodatkowo zapisując ustawienia TENS, czas trwania terapii i wszelkie niepożądane reakcje lub nasilone objawy, które wiązały się z zakończeniem badania i niepowodzeniem leczenia.
Dzień 60: Pacjenci lub ich opiekunowie ponownie wypełnili Kwestionariusze PIN-Q, otrzymali dziennik mikcji na kolejny miesiąc i zostali poproszeni o kontynuowanie terapii behawioralnej. Wrócili w dniu 90, aby ocenić trwałość efektów leczenia, dostarczając dziennik mikcji z miesiąca 3, wypełniając PIN-Q, i zostali zapytani, czy ponownie wybraliby terapię TENS. Jeśli pacjent nadal miał epizody NE, kontynuowano leczenie TENS w tej samej lub innej lokalizacji lub oferowano inną metodę leczenia NE.
Wyniki
90 pacjentów zostało losowo przydzielonych do jednej z trzech grup zróżnicowanych w oparciu o umiejscowienie podkładki elektrodowej (miesiąc 1). W ciągu pierwszego miesiąca badań 72 pacjentów spełniło wszystkie wymagania proceduralne (miesiąc 2), a w ciągu drugiego miesiąca - 45 (miesiąc 3).
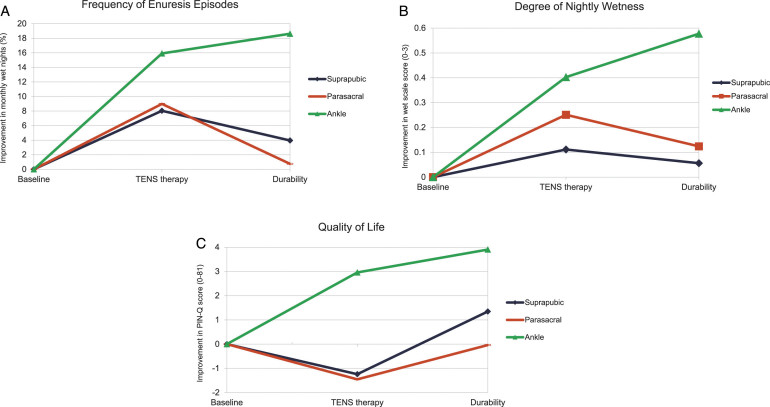
Podczas terapii TENS wszystkie grupy wykazały poprawę zarówno w częstotliwości, jak i nasileniu moczenia nocnego w porównaniu do wartości wyjściowej, przy czym grupa PT wykazała najlepsze wyniki (Ryc. 1A i B). Jakość życia pacjentów uległa poprawie tylko w grupie PT, podczas gdy pacjenci w grupach SP i PS zgłaszali pogorszenie jakości życia (Rys. 1C). W czasie trwania badania nie stwierdzono występowania działań niepożądanych związanych z terapią TENS.
Po zakończeniu terapii TENS, efekty leczenia wykazywały dalszą poprawę w zakresie częstotliwości i nasilenia moczenia a także jakości życia dla grupy PT. Podczas gdy QoL poprawiła się po zaprzestaniu leczenia TENS w grupach SP i PS, częstotliwość i nasilenie moczenia wróciły do wartości wyjściowej (Ryc. 1). Po zakończeniu badania, u 24% pacjentów wystąpiła co najmniej częściowa odpowiedź (2% pełna odpowiedź, 4% dobra odpowiedź, 18% częściowa odpowiedź) na terapię TENS zgodnie z definicją ICCS. Grupa PT wykazała najlepsze wyniki we wszystkich badanych aspektach, jednak jedyną statystycznie istotną różnicą w porównaniu z innymi grupami były wyniki PIN-Q. Ogólnie rzecz biorąc, 41 z 45 pacjentów, którzy dotrwali do 90 dnia badania, wyraziło chęć ponownego skorzystania z terapii TENS. Podczas gdy zadowolenie z terapii wyrażono we wszystkich grupach, było ono jednomyślne wśród osób z grupy PT.
Dyskusja
Jednoobjawowe NE jest częstym problemem występującym w populacji pediatrycznej, w którym strategie postępowania terapeutycznego są bardzo ograniczone. Pierwotna NE występuje u około 15% pięcioletnich dzieci, a częstość występowania zmniejsza się do 1% - 2% w wieku 15 lat. Terapia behawioralna i motywacyjna może prowadzić do znacznej poprawy (>80% poprawa w suchych nocach) u 70% pacjentów z 5% wskaźnikiem nawrotów. Alarmy wybudzeniowe powstrzymują moczenie nocne w 50% przypadków, ale wymagają stosowania przez co najmniej 3-4 miesiące i mają 30% wskaźnik przerwania. Desmopresyna jest najczęściej stosowanym środkiem farmakologicznym i ma 30% wskaźnik skuteczności, ale także 60% - 70% wskaźnik nawrotu objawów po odstawieniu. Imipramina ma 20% wskaźnik skuteczności, ale wyższy wskaźnik nawrotu objawów (96%) po odstawieniu wraz z ryzykiem wystąpienia działań niepożądanych ze strony układu sercowo-naczyniowego17.
Biorąc pod uwagę wyniki niniejszego badania, jedynym parametrem, dla którego osiągnięto istotną klinicznie poprawę była jakość życia pacjentów z grupy PT. Umiejscowienie nakładek w okolicy nerwu piszczelowo-tylnego było jedyną lokalizacją, która zapewniała ciągłą poprawę jakości życia oraz zmniejszenie częstotliwości i nasilenia NE u dzieci zarówno podczas, jak i po terapii TENS. Pod koniec badania pacjenci z grupy PT mieli 18,6% spadek częstości moczenia (w porównaniu do grup SP i PS, gdzie zaobserwowano odpowiednio 4,0% i 0,7% spadek częstotliwości moczenia). Pomimo tego, że poprawa była niewielka, rodziny pacjentów mogły zaobserwować 1-2 dodatkowe prania tygodniowo mniej, a także mniejsze potencjalne zakłopotanie pacjenta. W tej chwili TENS nie może być stosowany jako monoterapią, ale oferuje obietnicę jako leczenie wspomagające, które można bezpiecznie i wygodnie stosować u dzieci.
Nerw piszczelowy tylny był także celem innych badań naukowych. Stwierdzono, że refleksologia stóp eliminuje NE u 8-letniego dziecka z zespołem nadpobudliwości psychoruchowej z deficytem uwagi19. Wykazano również, że bardziej ukierunkowana, cotygodniowa, PENS w obrębie nerwów PT w 78,6% przypadków dała częściową lub pełną odpowiedź u pacjentów opornych na leczenie z jednoobjawowym NE po 12 tygodniach terapii20. Mimo tego, PENS jest inwazyjną procedurą i nie sprawdza się w przypadku dzieci. Terapia TENS ukierunkowana na ten sam obszar jest łatwiejsza do zrealizowania, a impulsy elektryczne mogą dobrze przenikać do nerwu PT z powodu cieńszej skóry w tym obszarze ciała.
Nerw PT leży wzdłuż dolnej części kanału nerkowego, a elektroda TENS umieszczona jest tuż przy punkcie akupunkturowym KI-3, który jest stosowany w protokołach akupunktury i elektroakupunktury w leczeniu moczenia. Inne typowe punkty akupunkturowe w leczeniu zaburzeń mikcji wzdłuż nerwu PT to KI-7, KI-10, SP-3 i SP-6. Punkty CV-2-4 są także powszechnie używane i znajdują się w tym samym obszarze, co elektrody TENS w grupie SP, która również miała dobre wyniki w niniejszym badaniu. Punkty BL-23 i BL-28 są również wykorzystywane i znajdują się w regionie PS21,22.
Połączenie terapii behawioralnej z treningiem mięśni dna miednicy i biofeedbackiem przyniosło niewielki sukces w leczeniu zaburzeń oddawania moczu, a elektryczna stymulacja mięśni odbytu wykazała opóźnioną, ale częściową odpowiedź w 86,7% przypadków i całkowitą odpowiedź w 13,3% przypadków 3 miesiące po leczeniu23. Stwierdzono nawet, że elektrostymulacja przynosi korzyści w leczeniu nietrzymania stolca u pacjentów z przepukliną oponowo-rdzeniową i neuropatią przewodu pokarmowego.
W większości badań opublikowanych dotychczas w literaturze, region PS był najczęstszym wyborem miejsca umieszczenia elektrod12,13, jednak niniejsze badanie nie wykazało, że PS jest optymalną lokalizacją. Można tłumaczyć to niezdolnością elektrod do odpowiedniej stymulacji nerwu przez kość krzyżową, w przeciwieństwie do precyzyjnego działania igły podczas wykonywania neuromodulacji krzyżowej. Również samodzielne umieszczenie podkładek we właściwym miejscu może być trudne, a pacjent często wymaga innej osoby, aby je umieścić, co może być kłopotliwe dla osób starszych.
Ograniczenia tego badania związane są głównie z rezygnacją dużej liczby osób przed zakończeniem trzymiesięcznej analizy (50% pacjentów). Wynikało to częściowo z wykonywania badania w czasie pandemii COVID-19, która uniemożliwiała pacjentom wizyty w klinice. Pozyskiwanie danych od niektórych pacjentów odbywało się drogą telefoniczną, ponieważ wielu pacjentów nie wysłało arkuszy danych pomimo wielokrotnych prób ich uzyskania przez zespół badawczy. Gdyby obserwacja pacjentów była bardziej spójna, możliwe jest, że istotność statystyczna mogłaby zostać osiągnięta w przypadku zmniejszenia częstości i nasilenia moczenia po zastosowaniu terapii TENS. Dłuższy czas trwania terapii TENS (przez ponad miesiąc) mogłoby również ujawnić więcej korzyści. Inne wyniki badania mogłyby być także osiągnięte, kiedy zostałaby zrekrutowana większa liczba pacjentów z nocną poliurią niż z małą zdolnością do gromadzenia moczu jako powód ich NE (nie ustalono na początku badania). Nie wiadomo również, czy wszyscy pacjenci prawidłowo umieszczali podkładki elektrodowe i wykonywali terapię TENS w miesiącu 2.
Mocne strony badania obejmują przeprowadzenie randomizowanego badania klinicznego, porównującego wiele parametrów między grupami i ujawniającego poprawę jakości życia, przestrzeganie zaleceń terapeutycznych, zadowolenie pacjenta i bezpieczeństwo terapii TENS przeprowadzanej w obszarze stawu skokowego bez wystąpienia działań niepożądanych. Nasze badanie obejmowało również bezpośrednie porównanie skuteczności terapii TENS w leczeniu NE zależności od różnych lokalizacji elektrod. Udało się opracować protokół bezpiecznej i łatwej w użyciu terapii domowej, którą można stosować przed snem, co jest wygodne dla pacjentów i bez użycia leków.
Wnioski
Zastosowanie TENS w połączeniu z technikami behawioralnymi może być łatwym i bezpiecznym narzędziem, które można stosować w domu, aby wspomóc leczenie NE, jednak potrzebne są dalsze badania w celu optymalizacji protokołu leczenia, aby wykazać klinicznie istotną poprawę.
Źródło: Continence, 2022, December, vol 4, pp 100519
Copyright: ©2021 The Authors
Adaptacja: Dorota Kacprzak
Na podstawie licencji CCBY (http://creativecommons.org/licenses/by/4.0/)
- Barroso U. Jr., Viterbo W., Bittencourt J., Farias T., Lordêlo P. Posterior tibial nerve stimulation vs parasacral transcutaneous neuromodulation for overactive bladder in children J. Urol., 190 (2) (2013), pp. 673-677
- Rennie S. Electrophysical agents - contraindications and precautions: An evidence-based approach to clinical decision making in physical therapy Physiother. Can., 62 (5) (2010), pp. 1-80
- Vance C.G., Rakel B.A., Blodgett N.P., DeSantana J.M., Amendola A., Zimmerman M.B., Walsh D.M., Sluka K.A. Effects of transcutaneous electrical nerve stimulation on pain, pain sensitivity, and function in people with knee osteoarthritis: a randomized controlled trial Phys. Ther., 92 (7) (2012), pp. 898-910
- Tai C., Shen B., Chen M., Wang J., Liu H., Roppolo J.R., de Groat W.C. Suppression of bladder overactivity by activation of somatic afferent nerves in the foot BJU Int., 107 (2) (2011), pp. 303-309
- Chen M.L., Chermansky C.J., Shen B., Roppolo J.R., de Groat W.C., Tai C. Electrical stimulation of somatic afferent nerves in the foot increases bladder capacity in healthy human subjects J. Urol., 191 (4) (2014), pp. 1009-1013
- Alcantara A.C., Mello M.J., Silva E.J., Silva B.B., Ribeiro Neto J.P. Transcutaneous electrical neural stimulation for the treatment of urinary urgency or urge-incontinence in children and adolescents: a phase II clinical trial J. Bras. Nefrol., 37 (3) (2015), pp. 422-426
- Barroso U. Jr., Lordêlo P., Lopes A.A., Andrade J., Macedo A. Jr., Ortiz V. Nonpharmacological treatment of lower urinary tract dysfunction using biofeedback and transcutaneous electrical stimulation: a pilot study BJU Int., 98 (1) (2006), pp. 166-171
- Lordêlo P., Teles A., Veiga M.L., Correia L.C., Barroso U. Jr. Transcutaneous electrical nerve stimulation in children with overactive bladder: a randomized clinical trial J. Urol., 184 (2) (2010), pp. 683-689
- Bouali O., Even L., Mouttalib S., Moscovici J., Galinier P., Game X. Tibial nerve transcutaneous stimulation for refractory idiopathic overactive bladder in children and adolescents. Prog. Urol., 25 (11) (2015), pp. 665-672
- Björkström G1., Hellström A.L., Andersson S. Electro-acupuncture in the treatment of children with monosymptomatic nocturnal enuresis Scand. J. Urol. Nephrol., 34 (1) (2000), pp. 21-26
- Chen Y.J., Zhou G.Y., Jin J.H. Transcutaneous electrical acupoint stimulation combined with auricular acupoint sticking for treatment of primary nocturnal enuresis Zhongguo Zhen Jiu., 30 (5) (2010), pp. 371-374
- Lordêlo P., Benevides I., Kerner E.G., Teles A., Lordêlo M., Barroso U. Jr. Treatment of non-monosymptomatic nocturnal enuresis by transcutaneous parasacral electrical nerve stimulation J. Pediatr. Urol., 6 (5) (2010), pp. 486-489
- Oliveira L.F., Oliveira D.M., Silva de Paula L.I., Figueiredo A.A., Bessa J. Jr., Sá C.A., Bastos Netto J.M. Transcutaneous parasacral electrical neural stimulation in children with primary monosymptomatic enuresis: a prospective randomized clinical trial J. Urol., 190 (4) (2013), pp. 1359-1363
- Ferroni M.C., Chaudhry R., Shen R., et al. Transcutaneous electrical nerve stimulation of the foot: Results of a novel at-home, noninvasive treatment for nocturnal enuresis in children Urology, 101 (2017), pp. 80-84
- Bower W.F., Wong E.M., Yeung C.K. Development of a validated quality of life tool specific to children with bladder dysfunction Neurourol. Urodyn., 25 (3) (2006), pp. 221-227
- Neveus T., von Gontard A., Hoebeke P., et al. The standardization of terminology of lower urinary tract function in children and adolescents: report from the standardization committee of the international children’s continence society J. Urol., 176 (1) (2006), pp. 314-324
- Tu N.D., Baskin L.S. Nocturnal enuresis in children: management (2018) Torchia MM (Dep Ed). UpToDate. Access date: 2019 Apr. https://www-uptodate-com.elibrary.amc.edu/contents/nocturnal-enuresis-in-children management?search=nocturnal%20enuresis&source=search_result&selectedTitle=1~42&usage_type=default&display_rank=1
- Lv L., Deng H., Li X. Afferent pathway dysfunction in children with primary nocturnal enuresis Int. J. Urol., 17 (2010), pp. 182-186
- Dane S., Welcome M.O. A case study: Effects of foot reflexotherapy on ADHD symptoms and enuresis nocturia in a child with ADHD and enuresis nocturia Complement Ther. Clin. Pract., 33 (2018), pp. 139-141
- Raheem A.A., Farahat Y., El-Gamal O., et al. Role of posterior tibial nerve stimulation in the treatment of refractory monosymptomatic nocturnal enuresis: a pilot study J. Urol., 189 (4) (2013), pp. 1514-1518
- Chace C. Urinary disturbances. Birch S. (Ed.), Shonishin: Japanese Pediatric Acupuncture, Thieme Verlagsgruppe, New York (2011), pp. 164-176 Chapter 22
- Hemler R. Chinese research on the treatment of pediatric enuresis Treating Pediatric Bed-Wetting with Acupuncture & Chinese Medicine, Blue Poppy Press, Boulder (2006), pp. 178-181 Chapter 8
- Abd El-Moghny S.M., El-Din M.S., El Shemy S.A. Effectiveness of intra-anal biofeedback and electrical stimulation in the treatment of children with refractory monosymptomatic nocturnal enuresis: A comparative randomized controlled trial Int. Neurourol. J., 22 (4) (2018), pp. 295-304
- Palmer L.S., Richards I., Kaplan W.E. Transrectal electrostimulation therapy for neuropathic bowel dysfunction in children with myelomeningocele J. Urol., 157 (4) (2017), pp. 1449-1452