Streszczenie:
Spastyczność, będąca następstwem zaburzenia neurologicznego, jakim jest mózgowe porażenie dziecięce (MPD), opisuje stan patologiczny, którego główną cechą jest mimowolny i przedłużony skurcz mięśni. Utrzymujący się opór mięśni spastycznych na rozciąganie często prowadzi do zmian strukturalnych i mechanicznych w muskulaturze. Prowadzi to do ograniczeń funkcjonalnych w danym stawie. Ogniskowe wstrzyknięcie toksyny botulinowej typu A (BTX-A) jest skutecznie stosowane w leczeniu spastyczności i poprawie jakości życia pacjentów. Blokując uwalnianie acetylocholiny na złączu nerwowo-mięśniowym i powodując tymczasowy paraliż mięśni, BTX-A ma na celu zmniejszenie spastyczności, a tym samym poprawę funkcji stawów. Ostatnie badania wykazały jednak pewne sprzeczne efekty, takie jak zwiększona sztywność mięśni lub węższy zakres aktywnej generacji siły. Potencjał tych zmian związanych z toksyną i atrofią w pogarszaniu stanu mięśni spastycznych, które już podlegają zmianom, powinien być dalej badany i określany ilościowo. Skupiając się na wpływie BTX-A na biomechanikę mięśni i ogólną funkcję u dzieci z CP, niniejszy przegląd dotyczy tego, które z tych celów zostały osiągnięte i w jakim stopniu oraz co może nas czekać w przyszłości.
1. Wprowadzenie
Najbardziej oczywistymi skutkami wstrzyknięcia BTX-A na poziomie mięśni są osłabienie i atrofia1,2. Co ważne, nadmierne osłabienie jako jedno z najczęściej zgłaszanych działań niepożądanych3,4 stanowi niezależny czynnik ryzyka zwyrodnienia stawów, co z kolei może prowadzić do choroby zwyrodnieniowej stawów5,6. Co najważniejsze, ponieważ dzieci ze spastycznym porażeniem mózgowym (SCP) mają już wady mięśni (tj. osłabienie), leczenie, które potencjalnie prowadzi do dalszego osłabienia, jest już niepokojące7. Niektóre badania8,9 sugerują, że upośledzony wzrost mięśni, a nie nadaktywność spastyczna, może wpływać na rozwój przykurczów, a ekspozycja na BTX-A może przynieść więcej szkody niż pożytku. Dlatego też nie tylko funkcjonalne efekty BTX-A obserwowane w praktyce klinicznej, ale jego biomechaniczny wpływ na struktury mięśniowe, muszą być brane pod uwagę w czasie trwania terapii.
Niniejsze badanie przedstawia ogólne zrozumienie spastyczności wywołanej CP i technik stosowanych w jej leczeniu, przegląd przewidywanych i sprzecznych skutków podawania BTX-A na funkcję i strukturę mięśni oraz łączy najnowsze odkrycia, aby rzucić światło na jego przyszłe zastosowanie.
2. Spastyczność wywołana porażeniem mózgowym i techniki jej leczenia
Mięsień szkieletowy jest silnikiem, który generuje ruch i utrzymuje postawę poprzez wywieranie sił. Mięsień ma napięcie nawet w spoczynku ze względu na obecność kilku kurczących się jednostek motorycznych10. Gdy mięsień rozciąga się, a aktywne skurcze osiągają napięcie wystarczające do wykonania ruchu, układ nerwowo-mięśniowy może zareagować zmianą napięcia mięśniowego11. Istnieją komponenty kurczliwe i lepkosprężyste (tj. komponenty aktywne i pasywne, odpowiednio) napięcia mięśniowego, które są matematycznie wyrażone jako zmiany oporu lub siły na przemieszczenie tkanki i biologicznie utrzymywane przez złożoną interakcję mechanizmów rdzeniowych i nadrdzeniowych12. Pasywne komponenty napięcia mięśniowego są niezależne od aktywności neuronalnej, ale zależą od czynników takich jak tkanka łączna i sarkomeryczne białka niekurczliwe, takie jak titina; tak więc składnik aktywny wynika z aktywacji jednostek motorycznych12-14. Dlatego kluczem do działania skurczu mięśni jest regulacja odruchów rozciągowych, nad którymi kontrolę sprawuje ośrodkowy układ nerwowy. Wraz z aktywacją odruchów rozciągowych, generowanie napięcia mięśniowego jest wykonywane przez wrzeciona mięśniowe w oparciu o skurcz włókien wewnątrz – i zewnątrzpochodnych zgodnie z poleceniami z mózgu do rdzenia kręgowego15. Spastyczność, mimowolny i powtarzający się skurcz mięśni szkieletowych, może pojawić się w następstwie zespołu górnego neuronu ruchowego. Jest to stan, w którym odruchy rozciągania są wyolbrzymione z powodu zmniejszonego hamowania w bardziej zauważalny sposób przy szybszych ruchach16. Skutkuje to współwystępowaniem niepożądanej aktywacji mięśni, która jest uważana za spowodowaną utratą kontroli nad neuronami ruchowymi i może dodatkowo przyczyniać się do hipertonii mięśniowej10,11,17. Hipertonia związana ze spastycznością prowadzi do przedłużonego skurczu mięśni, tj. utrzymującego się zwiększonego oporu na rozciąganie18, co zmniejsza zdolność mięśni do wydłużania się i upośledza ich wzrost19,20.
Utrzymujący się stan skrócenia mięśnia spastycznego może powodować przykurcz21,22 i rozwój deformacji kostnych, co może dalej skutkować zwiększoną sztywnością stawów i mięśni21,24-27 oraz ograniczonym biernym i czynnym zakresem ruchu stawu (ROM)28-30. W związku z tym nieprawidłowości w kontroli motorycznej w spastyczności zakłócają dobrowolną aktywację mięśni szkieletowych, prowadząc do patologii układu mięśniowo-szkieletowego i ograniczeń funkcjonalnych.
Spastyczność może mieć wiele przyczyn17, w tym CP, które opisuje grupę trwałych zaburzeń motorycznych przypisywanych uszkodzeniu centralnego układu sterowania w rozwijającym się mózgu płodu lub niemowlęcia31,32. Chociaż uszkodzenia mózgu powodujące stany neurologiczne nie postępują, wtórna patologia mięśni wynikająca z nieprawidłowej kontroli motorycznej utrzymuje się i postępuje przez całe życie33.
Obecnie CP jest najbardziej rozpowszechnioną ze wszystkich dziecięcych niepełnosprawności ruchowych, występującą w 3 i 3,6 przypadkach na 1000 żywych urodzeń odpowiednio w Europie34 i USA35.
Jedną z cech spastyczności33,36 u większości dzieci z CP jest hipertonia. Spastyczny typ CP stanowi 77-86% wszystkich przypadków, a mięśnie spastyczne pacjentów różnią się od mięśni osób rozwijających się typowo (TD) pod względem morfologicznym, biomechanicznym, a tym samym funkcjonalnym.
2.1. Mięsień spastyczny
Zmniejszenie objętości mięśni w spastycznych29,38-46, a nawet w niedowładnych kończynach29,40 jest konsekwentnie zgłaszane u osób z SCP w porównaniu z osobami z TD. Deficyty objętości mięśni jako wskaźnik ogólnego wzrostu mięśni47 obserwuje się w mięśniach spastycznych dzieci z CP już w wieku 15 miesięcy48.
Grubość mięśni i pole przekroju poprzecznego również uległy zmniejszeniu, podobnie jak inne nieprawidłowości związane z SCP29,33,46,47,49-52. Fizjologiczne pole przekroju poprzecznego (PCSA) reprezentuje sumę pól przekroju poprzecznego wszystkich włókien mięśniowych i może być oszacowane jako stosunek objętość mięśnia do długości powięzi i skorygowane o kąt pennacji53. W związku z tym długość i kąt powięzi są dodatkowymi parametrami morfologicznymi, które należy uwzględnić w obliczeniach PCSA. Jednak porównania długości i kąta powięzi między mięśniami niedowładnymi i nie niedowładnymi dały niespójne wyniki51,54,55. Biorąc pod uwagę, że różnice w objętości mięśni są zwykle bardziej wyraźne niż różnice obserwowane w długości powięzi mięśni, sugeruje się, że głównym czynnikiem determinującym zmniejszoną PCSA, a tym samym zdolność mięśni do wytwarzania siły, jest zmniejszona objętość mięśni47.
Długość jednostki mięśniowo-ścięgnistej jest również zaburzona w SCP, oprócz wyżej wymienionych parametrów. Kilka badań wykazało, że spastyczny mięsień brzuchaty łydki ma krótszy brzusiec mięśniowy w porównaniu ze stroną niedowładną40 lub u osób z TD39,56. Krótszy mięsień jest jednym ze wskaźników powstawania przykurczów57. Jednak zdolność mięśnia do generowania siły zależy między innymi nie tylko od cech mięśniowych, ale także od morfologii i architektury odpowiedniego ścięgna58. Badanie zmian długości w jednostce mięśniowo-ścięgnistej spastycznego mięśnia brzuchatego łydki ujawniło dłuższe niż normalnie ścięgno Achillesa u pacjentów59,60. Wykazano, że dzieci z CP, nawet bez przykurczu mięśni i które nie są ograniczone w wykonywaniu codziennych zadań, wykazują zmiany morfologiczne jednostki mięśniowo-ścięgnistej zginacza podeszwowego61, co zostało zasugerowane jako czynnik przyczyniający się do deficytów funkcjonalnych, takich jak osłabienie mięśni.
Osłabienie mięśni, upośledzenie zdolności do generowania lub utrzymywania wymaganego poziomu siły62, jest częstym objawem klinicznym u dzieci z SCP29,63 i jest uważane za główny czynnik zakłócający chód64. Zmniejszony rozmiar mięśni prowadzi do zmiany siły mięśni w stawie u dzieci z SCP w porównaniu z dziećmi z TD. Jednak udział deficytów w wielkości mięśni w osłabieniu mięśni nie jest stały; raczej wykazuje znaczną heterogeniczność między ruchami stawów i między badanymi65.
Dlatego ma to głównie podłoże neuronalne. Badania kwestionowały związek między osłabieniem mięśni kończyn dolnych a zgłaszanymi patologicznymi parametrami chodu, na przykład, że osłabienie zginaczy grzbietowych i podeszwowych u dzieci z CP w porównaniu z dziećmi z TD było związane odpowiednio z opóźnionym i zmniejszonym kątem zgięcia kolana podczas wymachu66. W szczególności w przypadku jednostronnych i obustronnych grup SCP stwierdzono istotne korelacje między połączonym ruchem strzałkowym miednicy, stawów biodrowych, kolanowych i skokowych a złożonymi wynikami osłabienia wszystkich zaangażowanych mięśni, odpowiednio dla większości i całego zakresu cyklu chodu67.
Oprócz podstaw neuronalnych, zmieniająca się wewnętrzna pojemność mięśnia również modyfikuje jego siłę29,63. Elder i wsp wyjaśnili osłabienie zginaczy podeszwowych stawu skokowego u dzieci z hemiplegią spastyczną mniejszym przekrojem poprzecznym i niezdolnością do pełnej aktywacji mięśni, a także współaktywacją antagonistów. Późniejsze odkrycia dotyczące mięśnia czworogłowego uda i mięśnia trójgłowego ramienia68 potwierdziły, że osłabieniu mięśni towarzyszy zmniejszona dobrowolna aktywacja mięśni agonistów, a także większa współaktywacja antagonistów.
Od ponad 20 lat wiadomo, że współaktywacja antagonistów jest bardziej wyraźna u pacjentów z CP69,70 i jest uważana za niezbędną dla stabilności stawów, ponieważ pacjenci mają poważne problemy z koordynacją ruchową. Może ona jednak również powodować utrudnienia w ruchu z powodu zwiększonej sztywności stawów. Ostatnie eksperymenty śródoperacyjne71-74 wykazały, że współaktywacja mięśni antagonistycznych może niekorzystnie wpływać na charakterystykę siły mięśnia spastycznego, co jest zgodne z patologicznym stanem stawu kolanowego u pacjentów z SCP. Wykazano również, że sztywność mięśni i tkanki łącznej jest zwiększona z powodu SCP.
Na przykład Vaz i wsp.75 stwierdzili, że słabe wyniki w zakresie funkcji ręki u dzieci z hemiplegicznym SCP były skorelowane z osłabieniem mięśni nadgarstka i sztywnością zginaczy. W przypadku mięśni zginaczy nadgarstka de Bruin i wsp.25 wykazali znaczne pogrubienie trzeciorzędowego perimysium, co sugeruje podwyższoną sztywność tkanki łącznej. Korzystając z technik obrazowania76-78 lub przeprowadzając analizę biopsji mięśni i określając ilościowo zmiany w śródmięśniowych tkankach łącznych27,79, wiele innych badań ujawniło również zwiększoną sztywność różnych mięśni, takich jak brzuchaty łydki, smukły, półścięgnisty i obszerny boczny u pacjentów z SCP w porównaniu z osobami zdrowymi. Dlatego też zwiększona sztywność mięśni odzwierciedla zmiany zarówno w mechanicznych, jak i biologicznych właściwościach mięśni, co oznacza, że wszystkie wewnętrzne właściwości mięśni (np. sztywność miofibryli)80 oraz ilość i orientacja struktur tkanki łącznej wpływają na sztywność mięśni, a nie są tylko i całkowicie związane ze zmianami wielkości mięśni (tj. deficytami w przekroju poprzecznym lub długości mięśni) obserwowanymi w SCP.
2.2. Zarządzanie spastycznością
W CP nie ma dostępnego lekarstwa na uszkodzenie mózgu, co prowadzi do problemów motorycznych charakterystycznych dla tej choroby. W związku z tym niepełnosprawność ruchowa utrzymuje się przez całe życie i zmienia się w czasie ze względu na normalny rozwój i proces starzenia się81.
Wszystkie interwencje stanowią techniki postępowania, z których każda ma na celu złagodzenie określonego upośledzenia, przy założeniu, że poprawa funkcjonalna zakończy się sukcesem. Głównym czynnikiem decydującym o wyborze technik postępowania w spastyczności jest skupienie się na objawie i czynniku leżącym u jego podstaw. Ze względu na osłabienie mięśni, wielu pacjentów próbuje utrzymać postawę i ruch za pomocą nadmiernego napięcia mięśniowego. Zmniejszenie tego napięcia i umożliwienie rozciągnięcia mięśnia docelowego ma na celu zminimalizowanie rozwoju przykurczów mięśni.
Oczekuje się, że ostatecznie poszerzy się zakres ruchu stawów i ułatwi niezależne poruszanie się w życiu codziennym. Stosowane techniki należy porównać pod względem ryzyka (np. ograniczone korzyści, zanik mięśni, osłabienie mięśni i działania niepożądane) i korzyści (np. zmniejszenie spastyczności, poprawa zakresu ruchu i zmniejszenie sztywności) oraz zoptymalizować przy użyciu zintegrowanego podejścia w celu uzyskania wysoce skutecznego leczenia u każdego pacjenta19,82. Chociaż rozkład i nasilenie objawów różnią się znacznie u osób z CP, obecne metody leczenia niepełnosprawności ruchowej obejmują głównie terapie niefarmakologiczne, medyczne i chirurgiczne i są stosowane w celu poprawy ROM stawów, a tym samym funkcji motorycznych, poprzez normalizację napięcia mięśniowego, hamowanie nieprawidłowych odruchów i / lub spastycznych mięśni agonistycznych oraz wzmacnianie słabych mięśni.
Niefarmakologiczne metody terapii są dostępne dla ambulatoryjnych dzieci z SCP. Powszechnie stosowane interwencje fizykoterapeutyczne można określić jako terapię neurorozwojową i konwencjonalną fizykoterapię. Wykorzystanie terapii wspomagających, takich jak stymulacja elektryczna i kinesiotapin4, w połączeniu z fizykoterapią, przyciąga uwagę w celu poprawy kontroli postawy85,86 i siedzenia87 u pacjentów z SCP. Różne techniki, takie jak rozciąganie mięśni88, trening siły mięśniowej89,90, trening ćwiczeń i chodu, seryjne odlewy93 oraz stosowanie ortez i urządzeń wspomagających94, pamiętając, że stosowanie któregokolwiek z nich samodzielnie może ogólnie nie być bardzo skuteczne w zmniejszaniu napięcia mięśniowego lub sztywności lub poprawie parametrów chodu95-99.
Selektywna rizotomia grzbietowa (SDR) jest interwencją chirurgiczną mającą na celu zmniejszenie spastyczności kończyn dolnych100, która, jak donoszono, zapewnia zwiększony zakres ruchu, któremu towarzyszy umiarkowana poprawa struktury i funkcji ciała oraz codziennych czynności życiowych, nawet po 20 latach od operacji101-104. W przeciwieństwie do klinicznie istotnych efektów105, niektóre grupy przedstawiły wyniki sugerujące, że długoterminowe korzyści są wątpliwe. Na przykład praca Tedroffa i wsp.106 prospektywnie badająca dzieci z SCP przez 10 lat po SDR wykazała, że wystąpił niewielki nawrót spastyczności w stawach kolanowych i skokowych, a ROM stawów i mediana stanu ambulatoryjnego były najlepsze 3 lata po SDR, a następnie spadły; w związku z tym zasugerowali, że samo SDR nie zapobiega rozwojowi przykurczów w perspektywie długoterminowej.
Operacje ortopedyczne są rozważane w przypadku SCP, jeśli występuje znaczny stały przykurcz w stawie, który powoduje problemy z rotacją, jeśli pacjent ma skrzywienie kręgosłupa, które powoduje problemy z siadaniem lub chodzeniem, lub jeśli występuje ból lub problemy higieniczne wtórne do któregokolwiek z powyższych81. Neurektomia, tenotomia, osteotomia, wydłużanie mięśni, transfery mięśni i ścięgien, uwalnianie ścięgien i artrodeza to główne rodzaje operacji ortopedycznych wykonywanych u dzieci z CP81,107. Operacje chirurgiczne są jednak nieodwracalne, a powrót do zdrowia może trwać długo i może być bolesny, a wyniki są zmienne108; dlatego opóźnienie konieczności operacji jest ważne w leczeniu spastyczności.
W tym celu na pierwszy plan wysuwają się opcje farmakologiczne. Spośród licznych leków doustnych, takich jak tizanidyna, diazepam, klonidyna i dantrolen, najczęściej stosowanym w hipertonii jest baklofen107,109,110. Jednak wszystkie te leki mają różne mechanizmy działania i skutki uboczne, zwłaszcza sedację, która nie jest dobrze tolerowana u dzieci110,111. Wykazano, że dokanałowe podawanie baklofenu zamiast podawania doustnego zmniejsza spastyczność u dzieci z CP przy znacznie niższych dawkach wymaganych doustnie i mniejszej liczbie działań niepożądanych110,112,113. Jednak ze względu na krótki okres półtrwania leku, musi on być podawany w sposób ciągły, a kryteria identyfikacji pacjenta odpowiedniego do takiej terapii nie są do końca jasne.
Wstrzyknięcia domięśniowe są stosowane w celu wywołania blokady nerwowomięśniowej. Stwierdzono, że wstrzyknięcia środków neurolitycznych, alkoholu (45–100%) i/lub fenolu (3-7%) zmniejszają spastyczność na dłuższy czas107,114. Ponieważ jednak istnieje ryzyko trwałego zwłóknienia mięśni i bolesnych dysestezji, lokalizacja punktu motorycznego musi być dokładnie określona110,115,116.
W przypadku spastyczności ogniskowej najczęściej i najskuteczniej stosowaną metodą leczenia j e s t domięśniowe wstrzyknięcie toksyny botulinowej.
W przypadku spastyczności ogniskowej najczęściej i najskuteczniej stosowaną metodą leczenia j e s t domięśniowe wstrzyknięcie toksyny botulinowej. W porównaniu z zastrzykami fenolu, terapia toksyną zapewnia lepszą poprawę funkcjonalną117 i wiąże się z mniejszą liczbą powikłań, ponieważ efekty są selektywne i odwracalne118. W latach 90. wprowadzono toksynę botulinową w leczeniu spastyczności obserwowanej u dzieci z CP. Koman i wsp.119 przedstawili skuteczną iniekcję toksyny jako potencjalnie cenne narzędzie, które może opóźnić interwencję chirurgiczną do czasu, gdy dziecko będzie starsze i mniej narażone na możliwe powikłania, w tym konieczność powtarzania operacji. Od tego czasu kliniczne zastosowanie toksyny w CP wzrosło w bardzo krótkim czasie i szybko, podobnie jak publikacje i rozpowszechnianie konsensusów120–123. Istnieje uzasadnienie, że wstrzyknięcie toksyny botulinowej, z jej efektem zmniejszenia spastyczności, otwiera „okno terapeutyczne” dla leczenia w ogóle, które może wspierać, na przykład, ułatwienie terapii rozciągania mięśni lub dopasowanie ortez i gipsów124. Podawanie toksyny ma zatem na celu zapobieganie powstawaniu przykurczów, poprawę zdolności motorycznych, poprawę postawy i umiejętności funkcjonalnych, takich jak samoopieka, oraz zapewnienie lepszej kontroli bólu82,125,126.
Ból, jako stan zdrowia, dotyka większość pacjentów z CP i jest powiązany z ich zdrowiem psychicznym i jakością życia (np. mniejsza uwaga i udział w codziennym życiu oraz problemy ze snem)127-129. Dickinson i wsp.130 wyjaśnili, że zgłaszany przez pacjentów ból przede wszystkim determinuje obniżoną jakość ich życia, co powoduje do 7% różnic w leczeniu ich schorzenia. Każda interwencja u pacjentów z SCP powinna być ukierunkowana na określone cele, które można ogólnie pogrupować jako poprawę postawy i funkcji, ułatwienie opieki i leczenie bólu82, a to, jakie są główne potrzeby pacjenta w zakresie leczenia, jest bardzo zmiennym tematem, który wymaga starannego podejmowania decyzji. Warto zatem rozważyć wpływ toksyny botulinowej na łagodzenie bólu związanego ze spastycznością. Na przykład wykazano, że przedoperacyjne wstrzyknięcie toksyny do mięśnia operowanego zmniejsza ból pooperacyjny po operacji uwolnienia przywodziciela biodra u pacjentów z SCP131. Efekt ten był tak duży, że zmniejszył zapotrzebowanie na leki przeciwbólowe o 50% i średnią ocenę bólu o 74%. W niedawnym badaniu132 oceniano pacjentów z SCP, którzy odczuwali co najmniej umiarkowany ból podczas biernego zakresu ruchu przed i po pojedynczym wstrzyknięciu domięśniowym toksyny w kończynę dolną z częstymi przerwami. Stwierdzono, że interwencja spowodowała znaczące i klinicznie istotne zmniejszenie miejscowego i codziennego bólu przez 28 tygodni. Pośredniczyło to również w poprawie funkcji, tak że cele funkcjonalne oceniane za pomocą skali osiągania celów (SMART GAS132,133) zostały znacząco osiągnięte, co przyniosło oczywisty krótkoterminowy wpływ na jakość życia. Skuteczność przeciwbólowa toksyny botulinowej u dzieci z SCP różni się jednak w zależności od poziomu klasyfikacji funkcji motoryki dużej (GMFCS), a do ostatecznego wnioskowania wymagana jest rygorystyczna jakość metodologiczna127,134. Pomijając takie parametry aktywności i uczestnictwa, które są zwykle monitorowane klinicznie za pomocą kwestionariuszy i skal klinicznych, ale oczywiście mają ogromne znaczenie dla stanu zdrowia pacjentów, niniejszy przegląd koncentruje się na ilościowych zmianach właściwości strukturalnych i funkcjonalnych, które występują po ogniskowym wstrzyknięciu toksyny botulinowej.
Podstawowym kryterium identyfikacji pacjentów odpowiednich do wstrzyknięcia toksyny jest obecność uporczywej lub dynamicznej hipertonii, przy braku znaczącej stałej deformacji.
Rozważając toksynę botulinową jako opcję leczenia, kluczowy jest dobór pacjentów i czas leczenia. Podstawowym kryterium identyfikacji pacjentów odpowiednich do wstrzyknięcia toksyny jest obecność uporczywej lub dynamicznej hipertonii, przy braku znaczącej stałej deformacji135. Ogniskowe wskazania do wstrzyknięcia toksyny botulinowej zostały dobrze rozpoznane i opisane120, takie jak dynamiczny equinus lub dynamiczny kąt zgięcia kolana utrzymujący się przez cały cykl chodu w kończynie dolnej lub utrzymujący się kciuk w dłoni lub przywodzenie kciuka w kończynie górnej. Jednak w każdym z nich należy zauważyć i odpowiednio ocenić, że względne osłabienie mięśni może być przeciwwskazaniem do terapii toksyną.
Chociaż większość dzieci leczonych toksyną botulinową będzie ostatecznie wymagać operacji korekcyjnej, opóźnienie konieczności operacji do 6-12 roku życia ma wyraźną zaletę, pozwalając na mniejszą liczbę i bardziej precyzyjne interwencje chirurgiczne136.
W związku z tym, aby uzyskać maksymalny wynik i długotrwałe efekty, które można podjąć tylko przed rozwojem jakichkolwiek utrwalonych i ciężkich przykurczów, preferowane są wczesne wstrzyknięcia u młodszych dzieci. Wczesna terapia zmniejsza i może zapobiegać powstawaniu przykurczów, a tym samym opóźniać operację, podczas gdy nie ma to miejsca w przypadku starszych dzieci, które wykazują ograniczoną i krótkotrwałą odpowiedź ze względu na obecność utrwalonych przykurczów137-139. Optymalny moment rozpoczęcia leczenia jest zatem zalecany w wieku od 2 do 5 lat, co jest zakresem uzgodnionym przez większość naukowców, kiedy dynamiczny rozwój motoryczny jest kontynuowany, a wzorce chodu są elastyczne, więc nadal istnieje szansa na modyfikację przebiegu choroby136,137,140,141. Należy również zauważyć, że zmienność w zakresie odpowiedzi na leczenie BTX-A różni się między pacjentami i w ich obrębie. Definiując skalę osiągania celów w celu oceny leczenia, Desloovere i wsp.142 poszukiwali cech określających powodzenie i niepowodzenie leczenia, w wyniku czego 7,1% pacjentów nie uzyskało odpowiedzi na leczenie, co oznacza, że nie osiągnęli oni określonych celów na podstawie oceny chodu lub kończyny górnej, badania klinicznego i innych parametrów, takich jak higiena i ból, w porównaniu z oceną przed i po leczeniu. Brak odpowiedzi mógł być spowodowany zarówno wiekiem pacjenta (starsi pacjenci z niską reaktywnością), jak i poziomem iniekcji (dzieci z niską reaktywnością otrzymują więcej zastrzyków BTX-A w proksymalnych częściach kończyny dolnej i mniej zastrzyków wielopoziomowych w porównaniu z dziećmi z wysoką reaktywnością) lub terapią (tj. gipsowaniem) stosowaną w połączeniu z leczeniem BTX-A . Koncentrując się na wpływie toksyny botulinowej na biomechanikę mięśni i ogólną funkcję u dzieci z CP, niniejszy przegląd dotyczy tego, które z tych celów zostały osiągnięte i w jakim stopniu oraz co może nas czekać w przyszłości.
3. Mechanizm podawania toksyny botulinowej
Toksyny botulinowe są białkowymi produktami egzotoksyn bakterii Clostridium botulinum143. Spośród siedmiu głównych serotypów toksyny botulinowej (od A do G) o różnych właściwościach (np. skuteczność osłabiania mięśni, czas działania i białko docelowe), toksyna botulinowa typu A (BTX-A) została wprowadzona jako optymalna do długotrwałego stosowania klinicznego144,145. Mechanizm aktywacji BTX-A opiera się na jej wpływie na proces zwany egzocytozą, który umożliwia uwalnianie acetylocholiny do szczeliny synaptycznej w złączu nerwowo-mięśniowym i wymaga zaangażowania kilku specyficznych białek. Proces ten ostatecznie powoduje skurcz włókien mięśniowych z powodu zmiany potencjału elektrycznego błony146. Dlatego każda interwencja zapobiegająca uwalnianiu pęcherzyków zawierających acetylocholinę w złączu nerwowo-mięśniowym, a mianowicie zapobieganie egzocytozie, powoduje presynaptyczne zablokowanie transmisji sygnału, a tym samym powoduje paraliż mięśni146-151. Bez uwalniania acetylocholiny włókna mięśniowe nie mogą być fizjologicznie aktywowane. Tak właśnie dzieje się w przypadku ogniskowych wstrzyknięć BTX-A i jest on stosowany jako taki, aby pomóc przeciwdziałać patologicznie zmienionym obwodom pobudzającym i hamującym kręgosłupa, prowadzącym do zwiększonego pobudzenia i zmniejszonego hamowania obserwowanego w spastyczności.
Z biegiem czasu dochodzi do tworzenia nowych kiełków aksonalnych, a recykling pęcherzyków zachodzi w tych kiełkach, ale nie w macierzystych zakończeniach nerwowych. Funkcja pierwotnych terminali jest przywracana na dłuższą metę, a paraliż ostatecznie znika. Tak więc działanie BTX-A (tj. paraliż mięśni) jest odwracalne. Stopień paraliżu mięśni zależy zatem od liczby dotkniętych synaps, która jest również oparta na zastosowanej dawce i objętości toksyny7,120,153. Przywrócenie funkcjonalnych macierzystych zakończeń nerwowych rozpoczyna się 4 tygodnie po wstrzyknięciu BTXA152. Po około 3 miesiącach kiełkowanie nowych zakończeń nerwowych zaangażowanych w początkową regenerację neurotransmisji zanika, ponieważ pierwotne zakończenia nerwowe odzyskują zdolność uwalniania acetylocholiny152. W praktyce klinicznej efekt relaksacyjny BTX-A trwa u większości pacjentów od 12 do 16 tygodni135. Precyzyjnie zastosowana procedura iniekcji ma kluczowe znaczenie dla uzyskania lepszych wyników leczenia przez dłuższy czas i zmniejszenia skutków ubocznych, takich jak rozprzestrzenianie się toksyny.
4. Skutki podania BTX-A
4.1. Aktywne właściwości mięśni w odniesieniu do ruchu
Głównym celem leczenia BTX-A jest zmniejszenie nadmiernego napięcia mięśniowego i nadaktywnych odruchów rozciągowych obserwowanych u pacjentów z CP, a tym samym poprawa funkcji stawów. Osiąga się to głównie poprzez zmniejszenie produkcji siły czynnej mięśni narażonych na działanie BTX-A158-161.
Ostre i krótkoterminowe zmiany: Poprzednie badania wykazały, że wiele parametrów kinematycznych i kinetycznych mierzonych u pacjentów z CP zbliżyło się do chodu osoby zdrowej w około 1,5 miesiąca po wstrzyknięciu BTX-A do mięśni łydki138,163,166,168. BTX-A wstrzyknięta do mięśnia brzuchatego łydki poprawia ruchy kostki i kolana 5 dni po wstrzyknięciu. Należy zauważyć, że nie tylko dystalne stawy są bezpośrednio związane z wstrzykniętym mięśniem, ale może to również dotyczyć stawów proksymalnych. Na przykład po wstrzyknięciu do mięśnia brzuchatego łydki odnotowano ostre pogorszenie ruchomości stawu biodrowego163. Obserwowane początkowo nadmierne zgięcie biodra miało na celu skompensowanie lepszej pozycji kolana i uzyskanie lepszej stabilności. Siła biodra i pochylenie miednicy również uległy pogorszeniu. Zgodnie z tymi ustaleniami, w innym badaniu BTX-A wstrzyknięty do mięśnia brzuchatego łydki zwiększył ROM kolana podczas cyklu chodu, ale ROM biodra pogorszył się, a moc stawu biodrowego znacznie wzrosła166.
Zauważono, że staw kolanowy prawdopodobnie zaczął to robić, aby wzmocnić zmniejszoną zdolność odepchnięcia po wstrzyknięciu BTX-A 166. Jednakże, ogólna poprawa ogólnego wzorca chodu została wykazana po drugiej iniekcji przez około rok, ponieważ ROM stawu biodrowego i kolanowego wzrosły podczas chodu, a moc stawu biodrowego w fazie wykroku zmniejszyła się z powodu zmniejszonego zgięcia stawu biodrowego.
Zmieniając mechanikę stawów mięśni kończyn dolnych, BTX-A dodatkowo zmienia ruchy tułowia, tak że stwierdzono większe wychylenia tułowia w płaszczyźnie poprzecznej 4 miesiące po leczeniu BTX-A 164. Czas ten ma znaczenie kliniczne, ponieważ zmniejszonej spastyczności spowodowanej BTX-A towarzyszy poprawa kąta kostki przy początkowym kontakcie, maksymalne i średnie zgięcie grzbietowe kostki w fazie wykroku i wymachu, wraz ze znacznym zmniejszeniem maksymalnego zgięcia podeszwowego kostki przy odepchnięciu162. Dynamiczne pomiary nacisku na stopę wykazały, że wzór kontaktu stopy (np. powierzchnia kontaktu stopy oraz długość i szerokość kontaktu tylnej części stopy) i rozkład nacisku podeszwowego również uległy poprawie, co sugeruje lepszy kontakt pięty. Jednak w odniesieniu do progresji stopy nie stwierdzono znaczących zmian w średniej i maksymalnej rotacji wewnętrznej podczas całego cyklu chodu.
Badając funkcję chodu w czasie po leczeniu BTX-A, Matsuda i wsp.168 stwierdzili, że maksymalna poprawa funkcji chodu nie występuje na wczesnym etapie, ale około 2 miesiące po leczeniu. Ostatnie badanie169 wykazało znaczącą poprawę kinematyki chodu w stawie skokowym po wstrzyknięciu BTX-A do mięśnia brzuchatego łydki i/lub półścięgnistego, bez znaczącej poprawy kinematyki kolana w płaszczyźnie strzałkowej. Stwierdzono jednak, że wynik profilu chodu zmniejszył się po leczeniu, co sugeruje poprawę ogólnej patologii chodu. W swoim badaniu podłużnym Löwing i wsp.167 wykazali, że poprawa chodu zapewniona przez wstrzyknięcie BTX-A w połączeniu z fizjoterapią ukierunkowaną na cel była znacząca, ale klinicznie niewielka.
Ocena kliniczna wykazała, że spastyczność zginaczy podeszwowych zmniejszyła się po 3 miesiącach i pozostała stabilna, podczas gdy bierne zgięcie grzbietowe kostki zwiększyło się po 3 miesiącach, ale nieznacznie zmniejszyło się po 12 miesiącach. Osiąganie celów stopniowo wzrastało, osiągając najwyższy poziom po 12 miesiącach i utrzymując się na tym poziomie po 24 miesiącach. Zidentyfikowany efekt zmniejszenia spastyczności BTX-A nie miał jednak pozytywnego wpływu na poprawę chodu lub osiąganie celów. Dlatego znaczenie kliniczne poprawy chodu pozostało niejasne. W innym badaniu podłużnym Eek i Himmelman165 wykazali, że 6 miesięcy po wstrzyknięciu uzyskano niewielką poprawę wyprostu kolana przy pierwszym kontakcie, ale nie stwierdzono zmian kąta kostki w analizie chodu. Jeśli chodzi o dobrowolną siłę mięśniową, stwierdzono, że dobrowolne wytwarzanie siły w mięśniach zginaczy podeszwowych nie zmniejszyło się po BTX-A w 6 tygodni po wstrzyknięciu; zamiast tego zaobserwowano tendencję do zwiększania siły mięśniowej podczas obserwacji. Zgodnie z innymi badaniami173, można to wytłumaczyć tym, że blokowanie mimowolnych impulsów nerwowych prowadzi do możliwości używania i trenowania mięśni z dobrowolną kontrolą. Warto zauważyć, że wyniki dotyczące chodu różniły się od wcześniejszych doniesień o poprawie szczytowego zgięcia grzbietowego kostki w pozycji stojącej po BTX-A. Wzorzec chodu poprawił się w odniesieniu do wyprostu kolana przy początkowym kontakcie nóg z leczeniem BTX-A w mięśniu brzuchatym łydki, ale nie było zmian w kącie kostki w analizie chodu.
Z drugiej strony, z dostępnej literatury wynika, że po BTX-A nie następuje poprawa parametrów przestrzenno-ruchowych (tj. długości kroku, długości kroku, kadencji, prędkości chodu), niezależnie od czasu, jaki upłynął od leczenia138,165,166,171. Jednakże, oprócz wpływu na spastyczność mięśni i jej możliwe reperkusje funkcjonalne, leczenie BTX-A jest dobrą opcją do testowania perspektyw chirurgicznych. Efekt osłabienia mięśni po wstrzyknięciu BTX-A można wykorzystać do określenia, czy funkcja pacjenta zależy od siły konkretnego mięśnia docelowego, a tym samym do zaplanowania jego chirurgicznego wydłużenia, unikając złych wyników. Staranny dobór pacjentów ma zasadnicze znaczenie dla operacji chirurgicznych, ponieważ zgłaszano występowanie znaczących skutków ubocznych174. Stosując przedoperacyjne iniekcje BTX-A, Rutz i wsp.170 wykazali, że 20,9% pacjentów było zagrożonych pogorszeniem funkcjonalnym (tj. nadmiernym zgięciem grzbietowym stawu skokowego w końcowej fazie cyklu chodu, utratą wyprostu kolana w środkowej i końcowej fazie chodu i/lub zwiększonym przodopochyleniem miednicy podczas całego cyklu chodu) w przypadku osłabienia mięśni. Odsetek ten jest zgodny z wynikami historycznego badania kohortowego, w którym przeanalizowano wcześniejsze wyniki chirurgiczne i wykazano pogorszenie u 18% pacjentów po operacjach wydłużania ścięgien podkolanowych i Achillesa. Dlatego zastrzyki BTX-A mogą być stosowane jako niezawodne narzędzie do filtrowania pacjentów, którzy są narażeni na pogorszenie po operacji wydłużania.
Zastrzyki BTX-A mogą być stosowane jako niezawodne narzędzie do filtrowania pacjentów, którzy są narażeni na pogorszenie po operacji wydłużania.
Efekty długoterminowe: Wzorzec chodu w płaszczyźnie strzałkowej u dzieci leczonych wielopoziomowo BTX-A przez średnio 1 rok i 10 miesięcy po pierwszej iniekcji wykazuje bardziej prawidłowe przodopochylenie miednicy, wraz z poprawą kinematyki biodra i kolana na końcu kroku oraz bardziej znormalizowanym ruchem kostki138. Wskazuje to, że wzorzec chodu jest mniej zdefiniowany przez przykurcze mięśni na poziomie biodra, kolana i kostki. W płaszczyźnie poprzecznej odchylenia chodu (tj. wewnętrzna rotacja biodra przy początkowym kontakcie, zejściu z palców i w połowie zamachu) były bardziej wyraźne w grupie kontrolnej, która nie była leczona BTX-A. Sugeruje to, że dzieci leczone BTX-A mają wzorzec chodu, który jest mniej zdefiniowany przez deformacje kostne, powszechne w SCP. Dlatego też, w oparciu o te wyniki, wstrzyknięcie BTX-A można zasugerować jako technikę zmniejszającą możliwość wystąpienia wtórnych problemów we wczesnym wieku i minimalizującą potrzebę skomplikowanej operacji w późniejszym wieku. Jednakże inne długoterminowe badania obserwacyjne donoszą o sprzecznych wynikach138,172,175. Tedroff i wsp.175 wskazali, że przykurcze nadal rozwijają się w długim okresie pomimo zmniejszenia napięcia mięśniowego wywołanego przez BTX-A. W późniejszym badaniu172 dwie grupy dzieci z CP otrzymały codzienny program rozciągania, a dzieci z grupy BTX-A dodatkowo otrzymały dwa zastrzyki w mięsień brzuchaty łydki w odstępie 6 miesięcy. Po rocznej fazie leczenia w badaniu, dalsze leczenie każdego dziecka zostało pragmatycznie i indywidualnie zaprojektowane (w tym dodatkowe wstrzyknięcia BTX-A do mięśni dzieci w obu grupach). Stwierdzono, że napięcie mięśni zginaczy podeszwowych w grupie BTX-A uległo znacznemu zmniejszeniu po 3,5 roku, podczas gdy napięcie mięśni kostki i kolana w grupie kontrolnej pozostało niezmienione.
Zakres ruchu w stawie kolanowym był znacząco zwiększony po 1 roku w grupie BTX-A, ale zmniejszony w stawie kolanowym i skokowym w grupie kontrolnej po 3,5 roku. Nie stwierdzono różnic między grupami w zakresie analizy chodu, GMFM-66 lub PEDI. Autorzy doszli do wniosku, że wczesne leczenie BTX-A w ciągu 1 roku u małych dzieci z CP zmniejsza napięcie mięśniowe i zatrzymuje postęp przykurczów w porównaniu z grupą kontrolną. Jednak długoterminowy efekt funkcjonalny jest mniej jasny.
Warto zauważyć, że wpływ seryjnych domięśniowych wstrzyknięć BTX-A w kończyny dolne na jakość chodu dzieci z obustronnym SCP, które na początku nie otrzymywały BTX-A, oceniano za pomocą Edinburgh Visual Gait Score; wyniki wykazały, że poprawa jakości chodu po pierwszym wstrzyknięciu została utrzymana po drugim i trzecim cyklu wstrzyknięć176. Podobnie, w innym badaniu podłużnym177 testującym skuteczność wielokrotnej terapii BTX-A u pacjentów z SCP przez maksymalnie osiem sesji iniekcji, stwierdzono, że zysk z leczenia był najwyższy do 3 miesięcy po wstrzyknięciu, a liczba wstrzyknięć nie miała wpływu na skuteczność. W związku z tym skuteczność powtarzanych wstrzyknięć BTX-A, które powinny skutkować poprawą funkcjonalną poprzez wpływ na mechanikę mięśni, powinna zostać ponownie dokładnie rozważona. Dlatego też diagnostyka i monitorowanie parametrów poziomu mięśni, w przypadku których zmiany funkcjonalne u pacjentów mogły mieć fundamentalne znaczenie, są bardzo potrzebne.
Wczesne leczenie BTX-A w ciągu 1 roku u małych dzieci z CP zmniejsza napięcie mięśniowe i zatrzymuje postęp przykurczów.
4.2. Pasywne właściwości mięśni
Wstrzyknięcie toksyny wpływa na bierne odruchy rozciągania i powoduje zmianę aktywnych i biernych właściwości biomechanicznych mięśni. Wpływ BTX-A na bierne właściwości wstrzykniętych mięśni został oceniony w różnych badaniach. Przegląd tych badań zawiera oryginalna publikacja Autorów. W tej polskiej adaptacji artykułu pominięto ten fragment.
5. Najnowsze odkrycia dotyczące wpływu BTX-A
W tym punkcie artykuł oryginalny zawiera przegląd badań na zwierzętach. W polskiej adaptacji artykułu oryginalnego pominięto ten fragment.
6. Wnioski i przyszłość stosowania BTX-A w CP
U pacjentów z SCP głównym celem leczenia BTX-A jest poprawa funkcji stawów poprzez zmniejszenie hipertonii mięśniowej związanej ze spastycznością. Istnieją liczne badania wykazujące, że prawidłowo prowadzona terapia BTX-A prowadzi do skutecznej poprawy przy ograniczonych skutkach ubocznych. Kluczowe znaczenie ma jednak zarządzanie zmianami właściwości mechanicznych mięśni (np. siły i sztywności) w wyniku ekspozycji na BTX-A w trakcie leczenia. Należy dokładnie rozważyć sprzeczne efekty, które pogarszają stan mięśni już poddanych zmianom wynikającym z SCP (Tabela 1). Jednak wiele badań koncentruje się na określonych parametrach (tj. uzyskanych poprzez zbadanie aktywnych i/lub pasywnych cech mięśni lub skupienie się wyłącznie na morfologii, a n i e funkcji), a zatem brakuje rozstrzygających dowodów na bezpośrednie powiązanie całościowych efektów leczenia na poziomie mięśni i mechanicznego działania zaangażowanych stawów. Sprzeczne wyniki w literaturze wskazują na ten problem. Ogólna poprawa wzorca chodu pacjentów jest jednym z głównych wyzwań w praktyce klinicznej, co wymaga uwzględnienia wielu cech jednocześnie, ponieważ BTXA powoduje zmiany parametrów kinetycznych i kinematycznych w stawach nie tylko po dystalnej, ale także po proksymalnej stronie wstrzykniętego mięśnia.
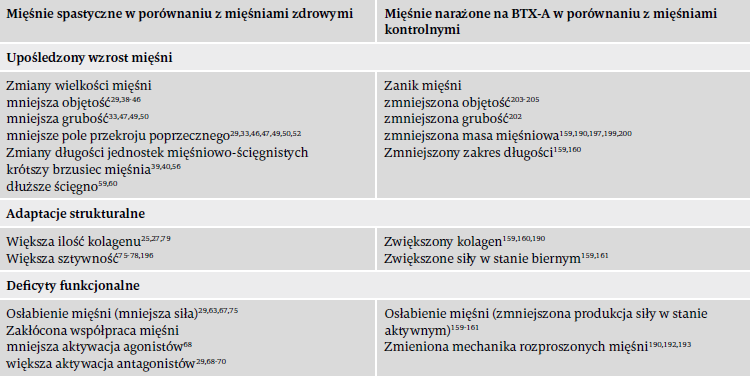
W przypadku odpowiednich grup pacjentów BTX-A zmniejsza rozwój trwałych przykurczów i związanych z nimi pogorszeń strukturalnych; dlatego może odroczyć potrzebę interwencji chirurgicznych. Jednak ostatnie wyniki badań na mięśniach zwierząt są sprzeczne z doświadczeniami klinicznymi. Konsekwentnie wykazywanym przeciwwskazaniem jest to, że BTX-A nie poszerza zakresu długości siły wywieranej przez mięśnie i nie zmniejsza biernej sztywności mięśni, mimo że ma dużą skuteczność w zmniejszaniu napięcia mięśniowego w warunkach dynamicznych.
Kontynuując czerpanie korzyści z przewidywanych efektów interwencji BTX-A, ważne jest, aby w jakiś sposób zminimalizować lub nawet wyeliminować jej niekorzystne skutki, które prawdopodobnie wynikają ze zmian strukturalnych, takich jak podwyższona ilość kolagenu w mięśniach narażonych na BTX-A w porównaniu z mięśniami kontrolnymi. Konieczne są dalsze badania w celu ustalenia, w jaki sposób niekorzystny wpływ na mechanikę mięśni i struktury tkanki łącznej spowodowany podawaniem BTXA, który został wcześniej ujawniony w badaniach na zwierzętach, zmienia się bezpośrednio u ludzi wybiórczo, a także gdy jednocześnie stosowane są określone terapie skojarzone. Zbadanie takich zmian wywołanych przez BTX-A umożliwi dokładniejsze planowanie terapii uzupełniających (np. ćwiczeń, stymulacji elektrycznej, ortez, seryjnych gipsów, tapingu itp.)235-238 stosowanych w leczeniu spastyczności w CP. Wymaga to bardziej szczegółowych badań na ludziach, które jednocześnie badałyby zmiany mięśniowe z funkcją stawów, a ostatecznie zapewniłyby możliwy rozwój farmakologiczny terapii BTX-A w oparciu o nowo uzyskane wyniki.
Bibliografia
Bibliografię zawierającą 238 pozycji można znaleźć w artykule źródłowym pod adresem https://www.mdpi. com/2072-6651/14/11/772
Żródło: Toxins 2022, 14(11), 772
(C) 2022 by The Authors
Adaptacja: Wiesław Marciniak
Na podstawie licencji CC BY
(http://creativecommons.org/licenses/by/4.0/)