Termin "porażenie mózgowe" był często używany zamiennie z nazwą "choroba Little’a" – od nazwiska brytyjskiego chirurga ortopedy, który opisał paraplegię spastyczną, uważaną przez niego za powikłania porodowe (Little, 1862)1.
Sigmund Freud, neuropatolog z Wiednia (który został wybitnym psychiatrą i znany jest dziś bardziej ze swojego wkładu w rozwój psychiatrii i psychoanalizy), jako pierwszy opisał dziecięce porażenie mózgowe jako kategorię nozologiczną, łączącą różne deficyty motoryczne pochodzenia mózgowego, ujawniającą się już w wieku dziecięcym (Freud, 1868)2,3.
Z biegiem czasu z różnych powodów należało ponownie rozważyć definicję i klasyfikację porażenia mózgowego. Nowoczesne techniki obrazowania mózgu rzuciły nowe światło na naturę leżących u podstaw tej jednostki chorobowej uszkodzeń mózgu, a badania nad neurobiologią i patologią związaną z rozwojem mózgu pozwoliły dokładniej zbadać jej mechanizmy etiologiczne.
Aby podkreślić fakt, że kompleksowe podejście do mózgowego porażenia dziecięcego musi być wielowymiarowe, a leczenie pacjentów prawie zawsze wymaga wielodyscyplinarnego podejścia, w zmienionej definicji uwzględniono klasy zaburzeń powszechnie towarzyszących mózgowemu porażeniu dziecięcemu.
Dziecięce porażenie mózgowe - definicja
Porażenie mózgowe jest to grupa trwałych zaburzeń rozwoju ruchowego i posturalnego powodujących ograniczenie aktywności, przypisywanych niepostępującym zaburzeniom, które wystąpiły w rozwijającym się mózgu płodu lub niemowlęcia.
Zaburzeniom motorycznym często towarzyszą zaburzenia czucia, percepcji, poznawcze, komunikacji i behawioralne, a także epilepsja i wtórne problemy mięśniowo-szkieletowe4.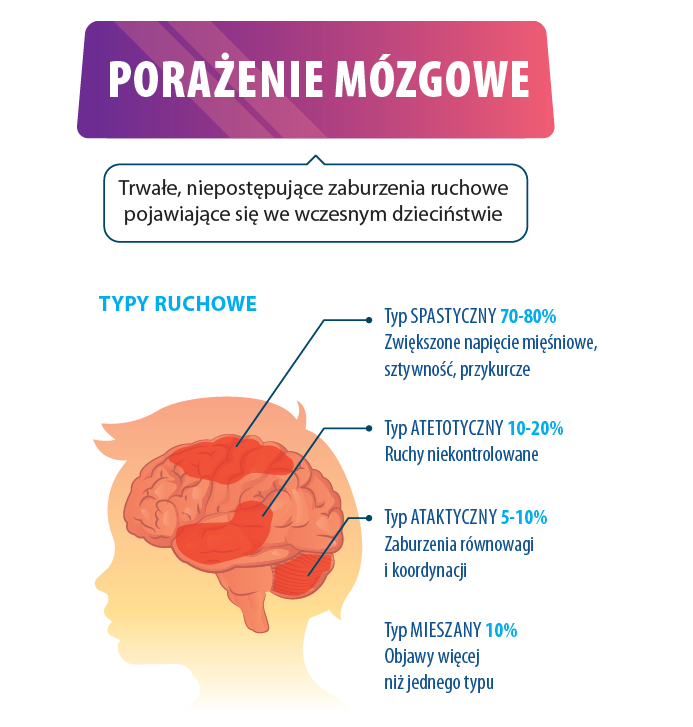
Porażenie mózgowe - epidemiologia
Porażenie mózgowe jest najpowszechniejszą niepełnosprawnością fizyczną wieku dziecięcego, występującą z częstotliwością od 2,0 do 2,5 na 1000 żywych urodzeń.
Chociaż całkowita liczba dzieci z porażeniem mózgowym pozostaje stabilna lub nieznacznie wzrosła od 1970 roku, obserwuje się stały wzrost odsetka porażenia mózgowego związanego z porodami wczesnymi i bardzo wczesnymi.
Wiele wiadomo o czynnikach ryzyka, które same lub w połączeniu mogą pośrednio prowadzić do porażenia mózgowego5.
Chociaż częstość występowania mózgowego porażenia dziecięcego, pomimo całego postępu we współczesnej nauce, pozostaje na podobnym poziomie, spektrum etiologii wyraźnie zmieniło się wraz z rozwojem medycyny.
Podczas gdy w przeszłości najczęstszymi przyczynami omawianej jednostki chorobowej były: encefalopatia niedotlenieniowo-niedokrwienna, infekcje oraz przyczyny związane z porodem, obecnie odsetek jej występowania znacznie wzrasta z powodu wcześniactwa: coraz wyższa jest przeżywalność dzieci urodzonych skrajnie wcześnie6.
Aby zidentyfikować czynniki ryzyka w przypadku porażenia mózgowego, niezbędny jest szczegółowy wywiad rodzinny. Bardzo ważna jest analiza występowania w poprzednich pokoleniach oraz w najbliższej rodzinie dzieci z zaburzeniami neurologicznymi lub innymi formami niepełnosprawności.
Wywiad dotyczący przebiegu ciąży i sytuacji przedporodowej – z naciskiem na infekcje, urazy, krwawienia, ogólny stan zdrowia, dietę, ciśnienie krwi i cukrzycę ciężarnych – jest niezbędny w przypadku stwierdzenia zaburzeń strukturalnych, np. dysplazji korowej.
Każde uszkodzenie fizyczne lub biochemiczne rozwijającego się mózgu płodu po 26. tygodniu ciąży może wpływać na oligodendrocyty – komórki neuronalne położone w okolicy okołokomorowej. Są one najbardziej podatne na szkodliwe czynniki, a jakiekolwiek ich uszkodzenie w okresie rozwoju wewnątrzmacicznego prowadzi do leukomalacji okołokomorowej lub paraplegii klinicznej.
Zastosowanie diagnostyki za pomocą rezonansu magnetycznego u płodu może zidentyfikować jawne wady rozwojowe kory, ale zwykle ich dokładna identyfikacja jest możliwa dopiero po 27–28 tygodniach, czyli po upływie okna czasowego możliwych interwencji.
Czynnikami wysokiego ryzyka wsytąpienia dziecięcego porażenia mózgowego są:
- poród przedwczesny, przedłużający się, trudny, przyspieszony,
- odklejenie się łożyska,
- każde inne ułożenie płodu niż główkowe,
- wynik w skali Apgar poniżej 7 w 5. minucie,
- wspomaganie wentylacji,
- hiperbilirubinemia,
- sepsa,
- infekcje, zwłaszcza zapalenie opon mózgowo‑rdzeniowych,
- krwotok dokomorowy,
- hipoglikemia,
- napady drgawek u noworodka,
- przedłużony pobyt noworodka na oddziale intensywnej terapii.
Praktyczne wskazówki pozwalające określić powagę problemu poporodowego:
- opóźnione rozpoczęcie karmienia
- dłuższy czas pobytu dziecka na oddziale intensywnej opieki neonatologicznej
- większa liczba współwystępujących czynników wysokiego ryzyka.
Pojedynczy czynnik o subklinicznym nasileniu może ujawnić się klinicznie, jeśli jest powiązany z innymi czynnikami wysokiego ryzyka, np. poziom bilirubiny o wartości 15 mg/dl u dziecka o masie ciała 2,5 kg w idealnym przypadku nie powinien powodować powstawania żółtaczki jąder podkorowych, jednak w przypadku współwystępowania wielu innych czynników ryzyka, takich jak sepsa, hipoglikemia, hipotermia, hipernatremia itp., ten sam poziom bilirubiny może prowadzić do wystąpienia żółtaczki jąder podkorowych.
Problemy okresu poporodowego mają stosunkowo mniejszy udział w predysponowaniu do wystąpienia porażenia mózgowego. Należą do nich: infekcje, napady drgawkowe, traumy, urazy naczyniowe i inne.
Chociaż górna granica wieku, w której zgodnie z definicją może ujawnić się porażenie mózgowe, nie jest dokładnie określona, zwykle przyjmuje się, że jest to wiek 24–36 miesięcy7 – ze względu na kryteria „niedojrzałego lub rosnącego mózgu”.
Genetyka a mózgowe porażenie dziecięce
Podobnie jak w przypadku wszystkich innych dziedzin medycyny, uwarunkowania genetyczne są uznawane za ważny czynnik etiologiczny dziecięcego porażenia mózgowego.
Głównym czynnikiem genetycznym jest tendencja do przedwczesnych porodów: jeżeli sama matka urodziła się przedwcześnie, istnieje podwyższone ryzyko, że także ona urodzi wcześniaka. Nie dotyczy to jednak ojców urodzonych przedwcześnie.
Dobrze zbadane są również predyspozycje rasowe: kobiety czarnoskóre rodzą wcześniaki dwa razy częściej niż kobiety rasy białej, nawet przy takich samych zmiennych społeczno-ekonomicznych.
Infekcje narządów płciowych i zakażenia wewnątrzmaciczne są związane z wysokim odsetkiem samoistnych porodów przedwczesnych, a czynniki genetyczne mogą być odpowiedzialne za nieprawidłową reakcję zapalną matki i zaburzenia układu odpornościowego9.
Trombofilia i zaburzenia krzepnięcia wywołane ciążą u niektórych matek są czynnikiem mogącym przyczyniać się do przedurodzeniowych wylewów krwi do mózgu10.
Klasyfikacja dziecięcego porażenia mózgowego
Klasyfikacja mózgowego porażenia dziecięcego została opracowana, lecz stosunkowo często ulega zmianom. Celem klasyfikacji jest opracowanie terminologii, za pomocą której wszyscy pracownicy medyczni i personel pomocniczy mogliby opisywać i rozumieć obraz kliniczny pacjenta w ten sam sposób.
Obydwie przedstawione poniżej klasyfikacje mogą być stosowane łącznie, aby opisać dziecko w bardziej jednolity, precyzyjny i zrozumiały sposób, np. dystoniczne porażenie mózgowe dwukończynowe bądź też postać dyskinetyczna /atetotyczna czterokończynowego porażenia mózgowego.
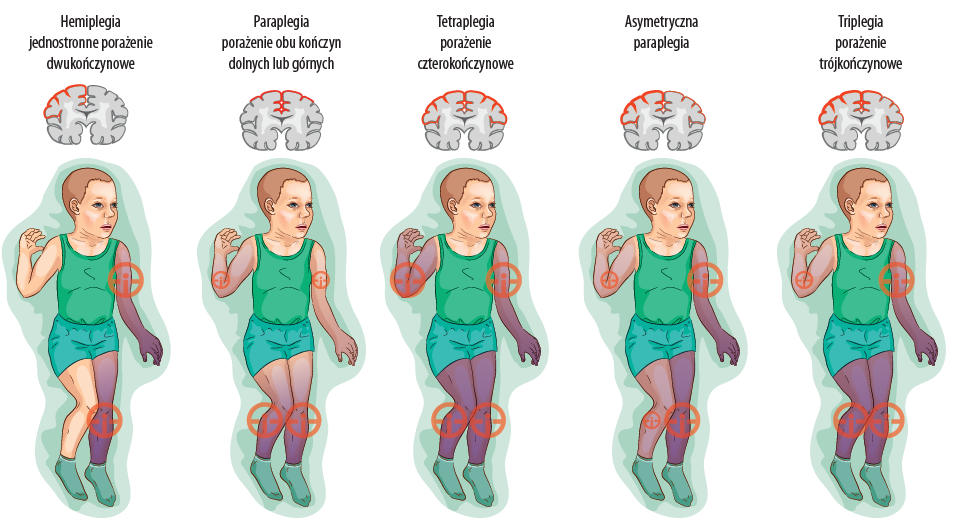
A. Klasyfikacja anatomiczna porażenia mózgowego
- Hemipareza – niedowład połowiczy dotyczący jednej strony.
- Zwykle powstaje w wyniku okołoporodowych wynaczynień krwi do mózgu.
- Zazwyczaj niedowład dotyczy kończyny górnej i dolnej, natomiast twarzy – w minimalnym stopniu.
- MRI ukazuje uszkodzenie jednej półkuli.
- Jeżeli uszkodzona jest istota biała mózgu tylko po jednej stronie (np. w przypadku wylewów dokomorowych) – istnieje niskie ryzyko wystąpienia padaczki i upośledzenia umysłowego.
- W przypadku uszkodzenia istoty białej i szarej (np. udar tętnicy środkowej mózgu) – prawdopodobieństwo wystąpienia padaczki i upośledzenia umysłowego jest większe.
- Paraplegia – obydwie kończyny dolne są upośledzone bardziej niż górne i bardziej niż twarz.
- Odwrotna progresja – należy zbadać również aktywność kończyn górnych i twarzy; w tej sytuacji zaburzenie zwykle dotyczy również tych części ciała, jednak w mniejszym stopniu.
- Opisana sytuacja sugeruje uszkodzenie komórek okolicy okołokomorowej.
- Przyczyną może być każdego rodzaju czynnik uszkadzający, występujący między 26. a 40. tygodniem ciąży.
- Zwykle obraz MRI ukazuje zmiany w zakresie okołokomorowej istoty białej.
- Oszczędzenie kory mózgowej sprawia, że ryzyko wystąpienia padaczki i upośledzenia umysłowego jest niskie.
- Tetraplegia – porażenie czterokończynowe, obejmujące kończyny górne, kończyny dolne oraz twarz (tzw. podwójna hemiplegia).
- Kończyny górne są bardziej zaatakowane niż dolne, a te z kolei bardziej niż twarz.
- Zwykle etiologia uszkodzenia jest rozproszona, np. encefalopatia niedotlenieniowo-niedokrwienna, hipoglikemia itp.
- Diagnostyka za pomocą MRI zwykle ukazuje obustronne zajęcie półkul, które niekoniecznie musi być równomierne i nie musi po obydwu stronach w równym stopniu dotyczyć istoty białej i szarej.
- Występuje duże ryzyko padaczki i upośledzenia umysłowego.
- Triplegia oznacza zajęcie trzech kończyn.
- Rezonans magnetyczny pomaga w określeniu stopnia uszkodzenia mózgu oraz w zdefiniowaniu obszaru uszkodzonego. Stanowi również pomoc w prognozowaniu wystąpienia chorób współistniejących. W rezonansie magnetycznym zwraca się szczególną uwagę na:
- stopień uszkodzenia istoty białej
- uszkodzenie istoty szarej
- zajęcie zwojów podstawy
- uszkodzenie móżdżku.
- Obraz kliniczny:
- objawy piramidowe, spastyczność, szlaki wzrokowe
- napady padaczkowe, opóźnienie rozwoju poznawczego, zaburzenia mowy, wzroku
- objawy pozapiramidowe, dystonie, dyskinezy, ruchy mimowolne
- ataksja, drżenie, hipotonia.
- Rezonans magnetyczny pomaga w określeniu stopnia uszkodzenia mózgu oraz w zdefiniowaniu obszaru uszkodzonego. Stanowi również pomoc w prognozowaniu wystąpienia chorób współistniejących. W rezonansie magnetycznym zwraca się szczególną uwagę na:
B. Klasyfikacja porażenia mózgowego oparta na kryterium ruchu lub napięcia mięśniowego
- Spastyczność
- Sugeruje zajęcie komórek układu piramidowego.
- Napięcie zwiększone w pozycji spoczynkowej i podczas wykonywania aktywności9.
- Dystonia lub dyskinezy
- Sugeruje zajęcie komórek układu pozapiramidowego.
- Ustępuje w spoczynku.
- Nieprawidłowości posturalne podczas aktywności.
- Możliwe symptomy motoryczne i w rozwoju psychicznym.
- Postać dynamiczna
- Dyskinezy/choreoatetoza
- Nieprawidłowy ruch o wysokiej amplitudzie, szczególnie podczas aktywności.
- Postać statyczna
- Dystonia
- Powolne, utrwalone nieprawidłowości posturalne podczas aktywności.
- Ataksja
- Przyczyną jest uszkodzenie móżdżku.
- Zwykle napięcie mięśniowe jest niskie.
- Osoba porusza się na szerokiej płaszczyźnie podparcia.
- Może współwystępować drżenie (tremor) lub dyskinezy. 4.
- Hipotonia
- Nie ma zgodności co do etiogenezy.
- Może mieć charakter przejściowy lub trwały.
- Zazwyczaj sytuacja poprawia się z wiekiem.
- Należy wykluczyć zaburzenia nerwowo-mięśniowe i neurogenne.
Leczenie dziecięcego porażenia mózgowego
Porażenie mózgowe - farmakoterapia
Po stwierdzeniu nieprawidłowości ruchowych i ich dokładnym zdiagnozowaniu można rozważyć wprowadzenie leków mających na celu ich ograniczenie. Celem leczenia farmakologicznego lub chirurgicznego jest poprawa funkcjonowania dziecka, a nie tylko zmniejszenie nieprawidłowego napięcia mięśniowego. Wspomnianych nieprawidłowości ruchowych nie można usunąć całkowicie.
Za pomocą leków można podjąć próbę poprawy napięcia, aby ułatwić dziecku lepsze funkcjonowanie. O ile istnieją leki stosowane w przypadku podwyższonego napięcia mięśniowego, np. spastyczności, dystonii, dyskinezy i do pewnego stopnia również ataksji, nie ma leków pozwalających na podwyższenie napięcia, co byłoby pożądane np. w przypadku dziecka z hipotonią.
U niektórych dzieci występuje wyraźny komponent sensoryczny, który sumuje się z nieprawidłowościami motorycznymi lub je wyzwala. W takich przypadkach leki mogą zmniejszyć negatywny wpływ układu sensorycznego, dzięki czemu dysfunkcja motoryczna zostaje do pewnego stopnia ograniczona.
Można również rozważyć wprowadzenie leków na choroby i zaburzenia współistniejące, takie jak nadmierne ślinienie się, infekcje dróg oddechowych, zaburzenia snu, problemy żywieniowe, behawioralne i szkolne.
Dawkowanie i czas trwania leczenia zależy od obrazu klinicznego. Dawkowanie dostosowuje się do stopnia nieprawidłowości napięcia mięśniowego. Dawkowanie powinno być regularne, bez wprowadzania nagłych przerw. Dawkę należy powoli zmniejszać lub zwiększać.
Rodzice powinni zostać zaznajomieni z powszechnie występującymi skutkami ubocznymi i poproszeni o ich raportowanie w regularnych odstępach czasu.
W razie potrzeby należy zbadać i monitorować interakcje lekowe, zwłaszcza z lekami wpływającymi na zachowanie i lekami przeciwpadaczkowymi.
Do leków powszechnie stosowanych w przypadku porażenia mózgowego należą: triheksfenydyl, baklofen, chlorazepam, tetrabenazyna, modafinil, tolperyzon, eperyzon i inne. Pomagają one w regulacji napięcia mięśniowego, ułatwiając tym samym lepsze funkcjonowanie ruchowe10.
Dziecięce porażenie mózgowe - zabiegi chirurgiczne
Chociaż dostatecznie dużo wiadomo na temat roli środków zwiotczających mięśnie stosowanych ogniskowo, takich jak toksyna botulinowa, niewiele wiadomo i niewiele mówi się o uogólnionych interwencjach chirurgicznych. Należą do nich:
- Pompa ITB (ciągły wlew baklofenu do przestrzeni podpajęczynówkowej) - dla dzieci ze znaczną dystonią i spastycznością pompa baklofenowa jest dobrym rozwiązaniem, gdy możliwości innego sposobu podawania leku zostaną wyczerpane. Pompa (umieszczona w jamie brzusznej) dozuje niewielkie dawki baklofenu i jest bardzo skuteczna w rozluźnianiu mięśni. Zabieg wymaga specjalistycznych umiejętności chirurgicznych, koniecznych do regularnego napełniania pompy i monitorowania jej stanu. Głównym skutkiem ubocznym może być zakażenie związane z zabiegiem lub nagły spadek poziomu baklofenu. Wspomniana procedura jest bardzo skuteczna, jednak wiąże się ze sporymi nakładami finansowymi. Zabieg jest odwracalny i istnieje możliwość wykonania próbnej procedury, która przed ostatecznym założeniem pompy pozwala sprawdzić, czy pacjent odniesie korzyść11.
- Głęboka stymulacja mózgu - jest to stosunkowo rzadka opcja leczenia, stosowana u dzieci z ciężkim dystonicznym, dyskinetycznym porażeniem mózgowym. Elektrody umieszcza się w zwojach podstawy mózgu, do których doprowadza się impulsy elektryczne za pomocą rozrusznika. Metoda ta pozwala na zmniejszenie dystonii i nieprawidłowości ruchowych. Wymagane jest bardzo regularne monitorowanie i specjalistyczna opieka neurologiczna, co generuje znaczne koszty. Procedura również jest odwracalna, ponieważ stymulator może zostać wyłączony, jeśli nie uzyskuje się pożądanej reakcji u leczonego pacjenta12.
- Selektywna rizotomia - selektywna rizotomia korzenia grzbietowego jest skuteczną, ale ograniczoną w zastosowaniu metodą zmniejszania spastyczności. Wymaga wykwalifikowanego neurochirurga i monitorowania śródoperacyjnego. Dobór pacjentów jest ograniczony ze względu na kryteria, które nieczęsto mogą być spełnione. Metoda nie jest bardzo droga, jest również trwała – nie można cofnąć jej skutków13.
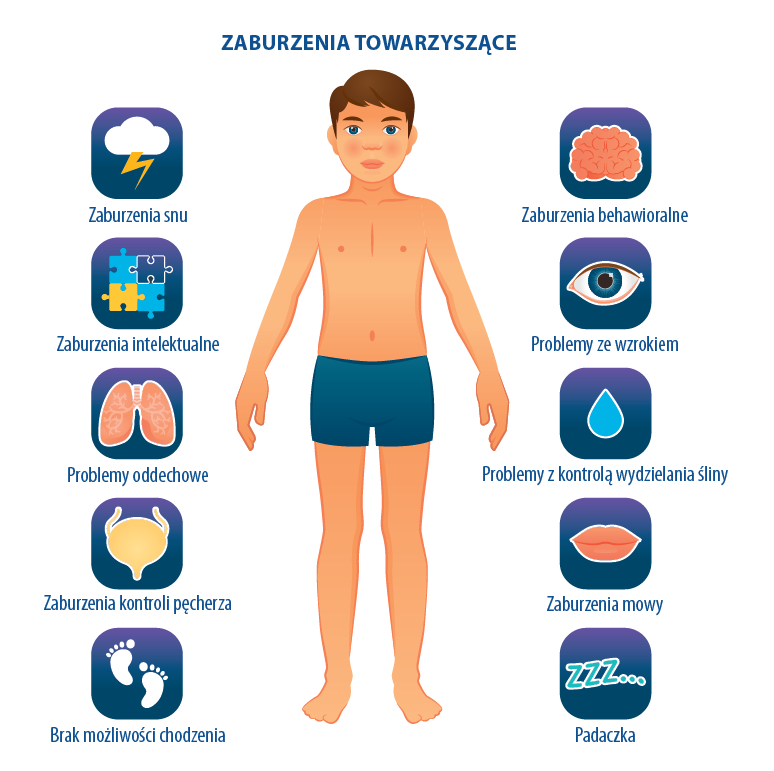
Dziecięce porażenie mózgowe - towarzyszące przejawy niepełnosprawności
Dziecko z porażeniem mózgowym należy oceniać całościowo już w momencie wstępnej diagnozy. Identyfikacja wszystkich rodzajów niepełnosprawności i odpowiednia interwencja jest koniecznością.
Przykładowo, upośledzenie wzroku lub słuchu może wpływać na postrzegany stan dziecka z porażeniem mózgowym, a także zmienić sposób, w jaki terapeuta odnosi się do dziecka i prowadzi postępowanie usprawniające.
Główne obszary współwystępujących niepełnosprawności, które należy ocenić i zidentyfikować, dotyczą:
- wzroku (10–25%),
- słuchu (2–6%),
- funkcji motorycznych aparatu mowy i samej mowy (28–45%),
- zachowania (5–25%),
- padaczki (25–50%),
- opóźnienia rozwoju psychicznego (30–75%)
- problemów sensorycznych.
W przypadku dzieci z porażeniem mózgowym należy zidentyfikować i usunąć wszystkie możliwe przeszkody, aby poprawić możliwości funkcjonalne.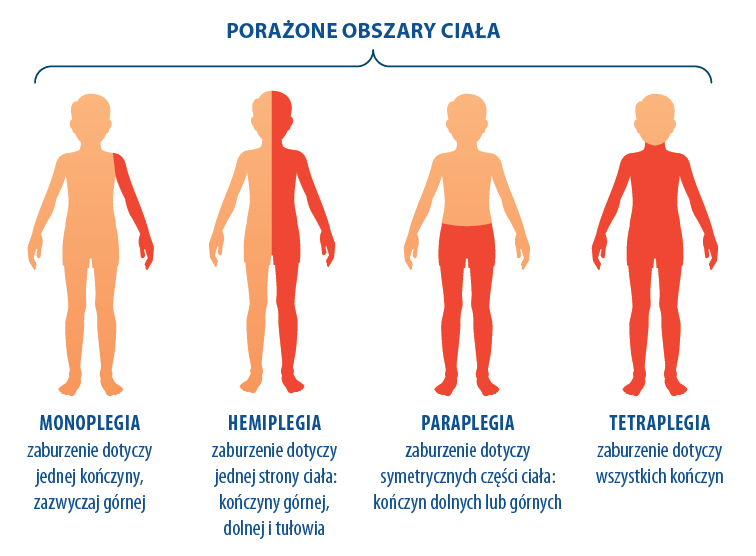
Problemy zdrowotne u dzieci z porażeniem mózgowym
Oprócz powiązanych przejawów niepełnosprawności często spotyka się wymienione poniżej problemy zdrowotne.
Nadmierne ślinienie się a porażenie mózgowe
Może być jednym z najpowszechniejszych problemów we wczesnych latach dziecięcych, który krępuje dziecko, negatywnie wpływa na rozwój mowy i przyjmowanie posiłków.
Problem ten można łatwo leczyć farmakologicznie oraz za pomocą terapii motoryki ust, dopóki dziecko nie nauczy się w sposób świadomy kontrolować i połykać śliny.
Wada ta pogłębia problemy z oddychaniem, ponieważ gromadzenie się wydzieliny zaostrza przebieg infekcji.
Zaburzenia snu u dzieci z porażeniem dziecięcym
Cykl snu może być zaburzony, a niektóre dzieci mają nieprawidłowe nawyki związane ze snem i higieną snu.
Początkowo nieprawidłowe napięcie mięśniowe i zaburzenia żołądkowe, a także drgawki, infekcje dróg oddechowych, ograniczenia ruchów w stawach i ból mogą być przyczyną zaburzenia wzorca snu. Również szyny i inne zaopatrzenie ortopedyczne nie ułatwia spokojnego snu.
Dobry sen i właściwa higiena snu są ważne, aby kolejny dzień był produktywny (nie tylko dla dziecka).
Dziecięce porażenie mózgowe a zaparcia
Większość dzieci z porażeniem mózgowym cierpi na zaparcia. Najlepiej byłoby, gdyby zamiast leków zalecana była zmiana diety.
Prawidłowe nawyki żywieniowe: zwiększona podaż płynów, więcej owoców i warzyw oraz mniej żywności powodującej zaparcia może mieć istotne znaczenie.
Jeśli mimo to zaparć nie uda się opanować, może zaistnieć potrzeba zastosowania leków, a nawet lewatywy.
Problemy żywieniowe u dzieci z porażeniem mózgowym
Niska waga jest przyczyną zmartwień we wczesnych latach życia dziecka z powodu problemów z karmieniem, częstych infekcji i utrzymującego się podwyższonego napięcia mięśniowego, które prowadzi do większych wydatków energetycznych.
U starszych dzieci częściej dostrzega się problem przybierania na wadze z powodu siedzącego trybu życia, niskiego poziomu aktywności i nieoptymalnych nawyków żywieniowych.
Problemy z karmieniem u dzieci z porażeniem dziecięcym
To główny problem występujący w okresie niemowlęcym i wczesnodziecięcym. Przy zaburzonej koordynacji motoryki ust ssanie i połykanie staje się trudne.
Najwięcej kłopotów sprawiają klarowne płyny i posiłki o stałej konsystencji – ich przyjmowanie prowadzi do częstego zachłystowego zapalenia płuc, podczas gdy posiłki zmiksowane lub półstałe są najlepiej tolerowane.
Ponadto duża liczba dzieci wykazuje zaburzenia czuciowo-ruchowe, które nasilają tendencję do sprzeciwiania się karmieniu.
Infekcje dróg oddechowych a dziecięce porażenie mózgowe
Podczas gdy wszystkie dzieci w wieku poniżej 5 lat częściej zapadają na infekcje dróg oddechowych, u dzieci z porażeniem mózgowym nawarstwia się wiele czynników jeszcze bardziej predysponujących do omawianego problemu zdrowotnego.
Dzieci te mają słaby układ mięśniowy, nieproduktywny kaszel, dochodzi u nich do gromadzenia się wydzielin i problemów związanych z zachłyśnięciami.
Fizjoterapia klatki piersiowej może być bardzo pomocna, a urządzenie wibracyjne stosowane w obszarze klatki piersiowej może być bardzo skutecznym rozwiązaniem.
Dziecięce porażenie mózgowe a próchnica zębów
Jest bardzo częstym problemem u dzieci z mózgowym porażeniem dziecięcym. W jamie ustnej trwale zalega ślina, w której zawsze znajdują się resztki spożytego pokarmu.
Oczyszczanie jamy ustnej, zębów i gardła jest dla dzieci trudne. Zgromadzona ślina staje się pożywką dla drobnoustrojów powodujących próchnicę i infekcje dziąseł. Regularne wizyty u dentysty są koniecznością.
Porażenie mózgowe - kwestie psychologiczne
Problemy z zachowaniem stanowią poważne zmartwienie rodziców dzieci z porażeniem mózgowym. Podczas gdy małe dzieci mogą być rozpieszczane przez członków rodziny, dojrzewanie jest najtrudniejszym okresem, z którym trzeba się zmierzyć.
Wpływ hormonów, gwałtowny skok wzrostu, zmiany w relacjach społecznościowych, kontaktach międzyludzkich, świadomość własnej niepełnosprawności, rozwój seksualny, miesiączka i nawyki seksualne – wszystkie te kwestie stanowią duży problem dla rodziców.
- Little W.J., On the influence of abnormal parturition, difficult labours, premature birth, and asphyxia neonatorum, on the mental and physical condition of the child, especially in relation to deformities. Clin Orthop Relat Res. 1966 May-Jun; 46:7-22. PMID: 5950310.
- Freud Sigmund, Die infantile Cerebrallähmung (1897) Infantile Cerebral Palsy. Introduction”, Essaim, 2016/1 (No 36), p. 169-174. DOI: 10.3917/ess.036.0169. URL: https://www.cairn-int.info/journal-essaim-2016-1-page-169.htm
- Kavcic A., Vodusek D.B., A historical perspective on cerebral palsy as a concept and a diagnosis. Eur J Neurol. 2005 Aug; 12(8):582-7. doi: 10.1111/j.1468-1331.2005.01013.x. PMID: 16053465.
- Rosenbaum P., Paneth N., Leviton A., Goldstein M., Bax M., Damiano D., Dan B., Jacobsson B., A report: the definition and classification of cerebral palsy, April 2006. Dev Med Child Neurol Suppl. 2007 Feb;109:8-14. Erratum in: Dev Med Child Neurol. 2007 Jun;49(6):480. PMID: 17370477.
- Reddihough D.S., Collins K.J., The epidemiology and causes of cerebral palsy. Aust J Physiother. 2003;49(1):7-12. doi: 10.1016/s0004-9514(14)60183-5. PMID: 12600249.
- Laisram N., Srivastava V.K., Srivastava R.K., Cerebral palsy – an etiological study. Indian J Pediatr. 1992 Nov-Dec; 59(6):723-8. doi: 10.1007/BF02859408. PMID: 1340861.
- Jan M.M. Cerebral palsy: comprehensive review and update. Ann Saudi Med. 2006 Mar-Apr; 26(2):123-32. doi: 10.5144/0256-4947.2006.123. PMID: 16761450; PMCID: PMC6074141.
- Varner M.W., Esplin M.S. Current understanding of genetic factors in preterm birth. BJOG. 2005 Mar;112 Suppl 1:28-31. doi: 10.1111/j.1471-0528.2005.00581.x. PMID: 15715591.
- Holst D., Garnier Y., Preterm birth and inflammation – The role of genetic polymorphisms, European Journal of Obstetrics & Gynecology and Reproductive Biology, Volume 141, Issue 1, 2008, Pages 3-9, ISSN 0301-2115, https://doi.org/10.1016/j.ejogrb.2008.07.020.
- Gibson C.S., MacLennan A.H., Goldwater P.N., Dekker G.A., Antenatal causes of cerebral palsy: associations between inherited thrombophilias, viral and bacterial infection, and inherited susceptibility to infection. Obstet Gynecol Surv. 2003 Mar; 58(3):209-20. doi: 10.1097/01.OGX.0000055205.21611.6E. PMID: 12612461.
- Gerszten, P.C., Albright, A.L., Johnstone, G.F. (1998). Intrathecal baclofen infusion and subsequent orthopedic surgery in patients with spastic cerebral palsy, Journal of Neurosurgery, 88(6), 1009-1013. Retrieved Jan 4, 2021, from https://thejns.org/view/journals/j-neurosurg/88/6/article-p1009.xml
- Vidailhet M., Yelnik J., Lagrange C., Fraix V., Grabli D., Thobois S., Burbaud P., Welter M.L., Xie-Brustolin J., Braga M.C., Ardouin C., Czernecki V., Klinger H., Chabardes S., Seigneuret E., Mertens P., Cuny E., Navarro S., Cornu P., Benabid A.L., Le Bas J.F., Dormont D., Hermier M., Dujardin K., Blond S., Krystkowiak P., Destée A., Bardinet E., Agid Y., Krack P., Broussolle E., Pollak P.; French SPIDY-2 Study Group. Bilateral pallidal deep brain stimulation for the treatment of patients with dystonia-choreoathetosis cerebral palsy: a prospective pilot study. Lancet Neurol. 2009 Aug; 8(8):709-17. doi: 10.1016/S1474-4422(09)70151-6. Epub 2009 Jul 1. PMID: 19576854.
- Koman L.A., Smith B.P., Shilt J.S. Cerebral palsy. Lancet. 2004 May 15; 363(9421):1619-31. doi: 10.1016/S0140-6736(04)16207-7. PMID: 15145637.
- Singhi P.D., Ray M., Suri G., Clinical spectrum of cerebral palsy in north India – an analysis of 1,000 cases. J Trop Pediatr. 2002 Jun; 48(3):162-6. doi: 10.1093/tropej/48.3.162. PMID: 12164600.