Mózgowe porażenie dziecięce (MPD) to „grupa stałych zaburzeń rozwojowych ruchu i postawy, powodujących ograniczenie aktywności i przypisywanych nieprogresywnym zaburzeniom, do których doszło w rozwijającym się mózgu płodu lub niemowlęcia. Motorycznym zaburzeniom w porażeniu mózgowym często towarzyszą zaburzenia czucia, percepcji, poznawcze, komunikacyjne, behawioralne oraz padaczka i wtórne problemy mięśniowo- szkieletowe”1.
Istnieją również inne definicje tego problemu zdrowotnego, natomiast zwykle mają one cztery główne komponenty:
- jest to zaburzenie ruchu i postawy,
- wynikające z nieprawidłowości występującej w mózgu,
- nabywane na wczesnym etapie życia i
- statyczne w momencie rozpoznania2.
MPD nie stanowi jednej jednostki chorobowej – pojęcie to obejmuje zaburzenia szeregu funkcji motorycznych, między innymi poruszania się, kontroli mięśni, koordynacji mięśniowej, napięcia mięśni, odruchów, motoryki małej, motoryki dużej, motoryki jamy ustno-gardłowej, postawy i równowagi. Zaburzenia te z kolei prowadzą do obniżonej siły, siedzącego trybu życia i zależności od innych przy wykonywaniu czynności życia codziennego oraz zmniejszonego udziału w czynnościach związanych z rekreacją i życiem w społeczności3.
Występowanie MPD szacuje się ogólnie na 1,5 do 3,3 przypadków na 1000 żywo urodzonych dzieci, a w Polsce na 2 do 2,5 na 1000 żywych urodzeń.
Przyczyny i czynniki ryzyka mózgowego porażenia dziecięcego
MPD spowodowane jest uszkodzeniem lub nieprawidłowym rozwojem tych części mózgu, które odpowiadają za ruch. Do takich problemów może dojść przed, podczas lub krótko po porodzie, ewentualnie w pierwszych kilku latach życia, kiedy rozwój mózgu jeszcze trwa, choć to zdarza się rzadko – w większości przypadków MPD ma charakter wrodzony, a nie nabyty.
Do przyczyn wrodzonego MPD należą:
- uszkodzenia substancji białej w mózgu,
- nieprawidłowy rozwój mózgu – mogą się do niego przyczyniać infekcje, gorączka, urazy lub mutacje genetyczne,
- krwawienie śródmózgowe, np. w wyniku udaru u płodu, problemów z krzepnięciem krwi, nieprawidłowej budowy naczyń krwionośnych, wad serca lub anemii sierpowatej,
- niedotlenienie mózgu, spowodowane np. zbyt niskim ciśnieniem tętniczym u matki, pęknięciem macicy, przedwczesnym oddzieleniem się łożyska, problemami z pępowiną lub poważnym urazem główki dziecka podczas porodu.
Do przyczyn nabytego MPD należą:
- uszkodzenie mózgu w pierwszych miesiącach lub latach życia,
- infekcje, takie jak zapalenie opon mózgowych lub mózgu,
- problemy z ukrwieniem mózgu z powodu udaru, nieprawidłowego krzepnięcia krwi, nieprawidłowych naczyń krwionośnych, wady serca lub anemii sierpowatej,
- uraz głowy w wyniku upadku, wypadku samochodowego lub maltretowania4.
W przeglądzie systematycznym przeprowadzonym przez McIntyre i wsp. zidentyfikowano najważniejsze czynniki ryzyka MPD u dzieci urodzonych o czasie w krajach rozwiniętych. Są to:
- dysfunkcja lub nieprawidłowości łożyska,
- wady wrodzone,
- niska waga urodzeniowa (temu czynnikowi sprzyja spożywanie alkoholu podczas ciąży),
- aspiracja smółki,
- cięcie cesarskie, próżniociąg, poród pośladkowy,
- asfiksja okołoporodowa (na ten czynnik ryzyka można wpływać, stosując chłodzenie, które zmniejsza śmiertelność oraz występowanie niepełnosprawności neurorozwojowych),
- napady padaczkowe w okresie noworodkowym,
- zespół zaburzeń oddechowych (według danych na temat wcześniaków, podawanie dawek surfaktanta egzogennego zapobiega temu zespołowi; brak badań nad wpływem takiego postępowania na dzieci donoszone),
- hipoglikemia, która wiąże się z ciężką encefalopatią,
- infekcje, w tym zapalenie opon mózgowych i sepsa5.
Inne czynniki ryzyka MPD to wcześniactwo, zapłodnienie in vitro (ze względu na większe ryzyko niskiej wagi urodzeniowej i ciąży mnogiej), niektóre choroby matki (choroby tarczycy, padaczka), infekcje matki podczas ciąży (takie jak opryszczka, kiła, różyczka, toksoplazmoza, ospa wietrzna), gorączka u matki podczas ciąży, konflikt serologiczny (grup głównych lub czynnika Rh), patologiczna żółtaczka noworodkowa (podczas której bilirubina uszkadza mózg dziecka), ciąża mnoga (ze względu na zwiększone ryzyko porodu przedwczesnego, niskiej wagi urodzeniowej i porodu pośladkowego) oraz wewnątrzmaciczne zahamowanie wzrostu płodu (np. z powodu choroby serca matki, spożywania alkoholu, stosowania narkotyków lub palenia tytoniu przez matkę podczas ciąży, nieodpowiedniego odżywiania się, problemów z łożyskiem, stanu przedrzucawkowego).
Zwykle MPD jest wynikiem kilku czynników ryzyka obecnych jednocześnie6.
Objawy i rozpoznanie mózgowego porażenia dziecięcego
Symptomami MPD są przede wszystkim opóźnienia w rozwoju dziecka (np. brak umiejętności siedzenia w 8. miesiącu czy chodzenia w 18. miesiącu) oraz problemy z poruszaniem się i koordynacją ruchową, takie jak niezdarne, niekontrolowane ruchy, drżenie rąk, chodzenie na palcach, zbyt duża sztywność lub wiotkość mięśni, skurcze mięśni oraz słabość kończyn dolnych lub górnych. Inne objawy, jakie mogą wystąpić w MPD, to trudności z przełykaniem, ślinotok, zaparcia, problemy z porozumiewaniem się, napady padaczkowe, problemy ze snem, choroba refluksowa przełyku, skolioza, nietrzymanie moczu, mniejsza stabilność stawów biodrowych (zwiększone ryzyko wzrokiem i słuchem.
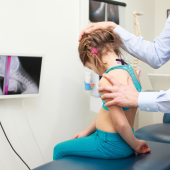
Rozpoznania MPD dokonuje lekarz neurolog na podstawie wywiadu na temat ciąży, porodu, okresu okołoporodowego, pierwszych miesięcy życia i rozwoju dziecka. Przeprowadza on badanie neurologiczne i analizuje przebieg choroby w czasie. Pomocne są również wyniki badań obrazowych mózgu, takich jak USG przezciemiączkowe, rezonans magnetyczny lub tomografia komputerowa. Sama diagnoza porażenia mózgowego nie określa, jak bardzo dziecko jest czy będzie niepełnosprawne – pacjenci z MPD są bardzo zróżnicowani pod względem sprawności, od zupełnie samodzielnych do wymagających stałej opieki ze strony bliskich.
W określeniu stopnia niepełnosprawności pomagają dalsze badania i ustalenie klasyfikacji właściwej dla danego pacjenta. Niezwykle ważne jest natomiast jak najwcześniejsze postawienie diagnozy i wdrożenie leczenia, a zwłaszcza rehabilitacji – dzięki temu można zminimalizować skutki urazu mózgu i zapewnić dziecku większą sprawność.
Klasyfikacja tradycyjna mózgowego porażenia dziecięcego
Najbardziej rozpowszechniony system klasyfikacji MPD to klasyfikacja wg Ingrama z 1966 r., zwana także klasyfikacją edynburską. Rozróżnia ona sześć podtypów MPD: porażenie połowicze (hemiplegia), obustronne porażenie połowicze (hemiplegia bilateralis), obustronne porażenie kurczowe (diplegia), zespół móżdżkowy (ataxia), postać pozapiramidową (dyskinesiae) oraz postacie mieszane7. Ten podział ma charakter topograficzno-fizjologiczny.
Podobny charakter ma klasyfikacja zaproponowana przez grupę Surveillance of Cerebral Palsy in Europe (SCPE). W systemie tym przy występowaniu utrzymującego się zwiększonego napięcia mięśni mamy do czynienia z kurczowym (spastycznym) porażeniem obustronnym lub jednostronnym. W postaciach kurczowych MPD występuje nieprawidłowy wzorzec postawy i/lub chodu, zwiększone napięcie mięśni (niekoniecznie stałe) oraz patologiczne odruchy (nadrefleksja i/lub objawy piramidowe, np. dodatni objaw Babińskiego).
Jeśli spastyczność nie występuje, ale napięcie mięśni jest zmienne, możemy mieć do czynienia z dyskinetycznym MPD, charakteryzującym się nieprawidłowym wzorcem postawy i/lub ruchu oraz niekontrolowanymi, nawracającymi ruchami mimowolnymi. Dyskinetyczne MPD dzieli się dalej na postać dystoniczną, w której występuje ograniczona aktywność (np. sztywność w poruszaniu się) i zwykle zwiększone napięcie mięśni, oraz postać choreoatetotyczną, gdzie mamy do czynienia ze zwiększoną aktywnością (np. gwałtownymi ruchami) i zwykle obniżonym napięciem mięśni.
Jeśli zaś napięcie mięśni nie jest zmienne, a zauważalna jest uogólniona hipotonia z objawami ataksji, postać tę klasyfikuje się jako ataktyczne porażenie mózgowe, czyli postać móżdżkową. Charakteryzuje się ona nietypowym wzorcem postawy i/lub ruchu oraz utratą uporządkowanej koordynacji mięśniowej, tak że ruchy wykonywane są z nieprawidłową siłą, rytmem i dokładnością. Część przypadków MPD daje nietypowy obraz kliniczny – określane są one jako MPD niedające się sklasyfikować8.
Klasyfikacja współczesna mózgowego porażenia dziecięcego
Wadą wcześniejszych systemów klasyfikacyjnych MPD jest nieuwzględnianie przez nie możliwości funkcjonalnych pacjentów, przez co ich użyteczność dla terapeutów była ograniczona. Obecnie instytucje międzynarodowe zalecają stosowanie klasyfikacji funkcjonalnej dla każdego przypadku MPD, bowiem takie podejście ma dużą przydatność w późniejszym postępowaniu z pacjentem. Dostępne są również skale oceny poszczególnych funkcji, jakie mogą podlegać ograniczeniom w MPD, takich jak porozumiewanie się, motoryka duża, motoryka mała czy funkcja jamy ustno-gardłowej. Pozwalają one na skategoryzowanie możliwości funkcjonalnych pacjenta lub stopnia występujących u niego ograniczeń aktywności. Badania potwierdziły adekwatność, obiektywność i wiarygodność kliniczną tych skal9.
Ta zmiana klasyfikacji odzwierciedla odejście od skupiania się na strukturze organizmu na rzecz aktywności pacjenta i jego uczestnictwa w społeczeństwie, jakie obserwowane jest we współczesnych naukach o zdrowiu.
Najważniejszymi i najczęściej stosowanymi skalami funkcjonalnymi pozwalającymi na określenie codziennego funkcjonowania pacjenta z MPD są:
- system klasyfikacji funkcji motoryki dużej (Gross Motor Function Classification System – GMFCS) – określa funkcję kończyn dolnych dziecka na jednym z pięciu poziomów:
- chodzi bez ograniczeń (poziom I),
- chodzi z ograniczeniami (poziom II),
- chodzi z użyciem ręcznego przyrządu (poziom III),
- samodzielnie porusza się z ograniczeniami, może korzystać z urządzenia elektrycznego (poziom IV),
- jest wożone wózkiem inwalidzkim (poziom V);
- system klasyfikacji zdolności manualnych (Manual Abilities Classification System – MACS) - określa funkcję kończyn górnych przy oburęcznym posługiwaniu się przedmiotami w ważnych czynnościach codziennych; dziecko:
- na poziomie I łatwo i skutecznie posługuje się przedmiotami,
- na poziomie II posługuje się większością przedmiotów, ale z nieco ograniczoną jakością i/lub szybkością wykonania,
- na poziomie III z trudem posługuje się przedmiotami, wymaga pomocy, aby podjąć lub zmodyfikować czynność,
- na poziomie IV posługuje się w sposób ograniczony przedmiotami łatwymi do używania i w dostosowanych sytuacjach,
- poziom V oznacza, że dziecko nie posługuje się przedmiotami i ma poważnie ograniczoną zdolność wykonywania nawet prostych czynności;
- skala ta jest odpowiednia dla dzieci w wieku 4-18 lat; w odniesieniu do dzieci w wieku 1-4 lat zastosowanie znajduje nieco zmodyfikowana skala mini-MACS;
- system klasyfikacji umiejętności komunikacyjnych (Communication Function Classification System – CFCS) – ocenia możliwości dziecka wchodzenia w role nadawcy i odbiorcy podczas porozumiewania się w różnych środowiskach oraz określa tempo porozumiewania się;
-
- poziom I oznacza skutecznego nadawcę i odbiorcę dla znanych i nieznanych partnerów,
- poziom II to skuteczny, ale wolniejszy nadawca i/lub odbiorca dla nieznanych i/lub znanych partnerów,
- poziom III – skuteczny nadawca i odbiorca dla znanych partnerów,
- poziom IV – niestały nadawca i/lub odbiorca dla znanych partnerów,
- poziom V – rzadko skuteczny nadawca i odbiorca nawet dla znanych partnerów;
-
- system klasyfikacji umiejętności jedzenia i picia (Eating and Drinking Ability Classification System – EDACS) – ocenia trudności dziecka w wykonywaniu tych czynności;
-
- poziom I oznacza, że badany je i pije w sposób bezpieczny i wydajny,
- poziom II – je i pije w sposób bezpieczny, ale z pewnymi ograniczeniami wydajności spożywania pokarmów,
- poziom III – je i pije w sposób nie w pełni bezpieczny; mogą pojawiać się ograniczenia w wydajności spożywania pokarmów, •
- poziom IV – je i pije ze znacznie ograniczonym bezpieczeństwem,
- poziom V – niezdolny do bezpiecznego jedzenia i picia, należy rozważyć karmienie przez sondę w celu zapewnienia odpowiedniego stopnia odżywienia.
-
Istnieje kilkanaście innych skal funkcjonalnych, które mogą pomóc w określaniu stopnia niepełnosprawności w MPD. Należą do nich: skala mobilności funkcjonalnej (Functional Mobility Scale – FMS), skala funkcjonalna motoryki dużej (Gross Motor Function Measure – GMFM), kwestionariusz oceny funkcjonalnej (Functional Assessment Questionnaire – FAQ), pomiar niezależności funkcjonalnej dla dzieci (WeeFIM), pediatryczny kwestionariusz jakości życia (PedsQL) oraz kwestionariusz do badania jakości życia związanej ze zdrowiem dzieci i młodzieży (KIDSCREEN).
Obecnie stosowane funkcjonalne skale są pomocnym narzędziem w określaniu ograniczeń występujących u pacjenta, a co za tym idzie – kierunków zwykle multidyscyplinarnej terapii, jaka pomoże mu w osiągnięciu jak największej samodzielności. Skale te stanowią cenne źródło informacji dla pediatry, fizjoterapeuty, terapeuty zajęciowego, logopedy i innych specjalistów zajmujących się dzieckiem z MPD i pozwalają na dopasowanie interwencji do jego potrzeb10.
Wytyczne odnośnie do rehabilitacji w mózgowym porażeniu dziecięcym
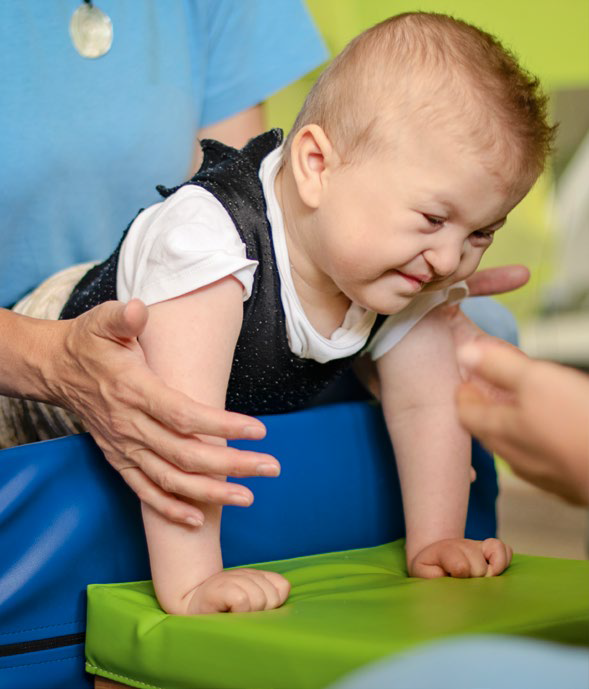
W postępowaniu z MPD kluczową rolę odgrywa fizjoterapia, która powinna być zapewniana niemal wszystkim pacjentom z zaburzeniem tego typu. Jej celem jest zmniejszenie upośledzenia fizycznego powodowanego przez objawy oraz ułatwienie uczestnictwa dziecka z MPD w społeczności. Dzięki fizjoterapii dzieci z MPD mogą realizować swój maksymalny potencjał odnośnie do samodzielności fizycznej i poziomu sprawności. Zmniejszając efekt ograniczeń fizycznych, rehabilitacja poprawia jakość życia dzieci i ich rodzin11.
W styczniu 2017 r. brytyjski National Institute for Health and Care Excellence (NICE) wydał wytyczne odnośnie do postępowania przy porażeniu mózgowym u osób poniżej 25. roku życia. Zalecają one, by wszystkie dzieci z podejrzeniem MPD były pilnie kierowane na badania umożliwiające wczesne postawienie diagnozy i podjęcie interwencji. Opiekę nad dzieckiem z MPD powinien sprawować multidyscyplinarny zespół, obejmujący pediatrę, pielęgniarkę, fizjoterapeutę, terapeutę zajęciowego, logopedę, dietetyka i psychologa. W razie potrzeby pacjentowi należy zapewnić także dostęp do neurologa (polskie realia są nieco inne od brytyjskich, u nas to właśnie neurolog dziecięcy przeprowadza rozpoznanie choroby i kieruje leczeniem chorych z MPD), neurorehabilitacji, gastroenterologa i chirurga, ortopedy, zaopatrzenia ortopedycznego, opieki społecznej, okulisty, otolaryngologa i nauczania wspomaganego. Dokument podkreśla znaczenie utrzymywania komunikacji między poszczególnymi specjalistami opiekującymi się pacjentem oraz centralną rolę dziecka i jego rodziców przy podejmowaniu decyzji odnośnie do leczenia i opieki12.
Jeśli chodzi o pracę nad ruchem i postawą pacjentów z PM, zastosowanie znajdują wytyczne NICE odnośnie do postępowania przy spastyczności u osób poniżej 19. roku życia. Ogólne zasady tych wytycznych mówią o jak najwcześniejszym kierowaniu dzieci i młodzieży ze spastycznością do fizjoterapeuty i, w razie potrzeby, terapeuty zajęciowego. Specjaliści ci powinni opracować program dopasowany do indywidualnych potrzeb pacjenta, zmierzający do osiągnięcia konkretnych celów, takich jak wspomaganie rozwoju umiejętności, funkcjonowania i zdolności do uczestniczenia w codziennych czynnościach oraz zapobieganie bólowi i przykurczom. Informacja przekazywana pacjentowi i jego rodzicom powinna podkreślać równowagę między możliwymi do osiągnięcia korzyściami i doświadczanymi podczas leczenia trudnościami, tak aby mogli oni aktywnie uczestniczyć w doborze odpowiedniego programu fizjoterapii.
Przy tworzeniu takiego programu dla dzieci i młodzieży należy brać pod uwagę zdanie pacjenta i jego rodziców, prawdopodobieństwo osiągnięcia celów leczenia, ewentualne trudności w przeprowadzaniu programu, a także wymagany czas i wysiłek pacjenta oraz jego opiekunów.
Konieczne jest zwracanie uwagi, aby sprzęt i techniki stosowane podczas fizjoterapii były bezpieczne i odpowiednie, zwłaszcza w przypadku pacjentów ze słabo kontrolowaną padaczką, o utrudnionym oddychaniu, ze zwiększonym ryzykiem zachłyśnięcia lub zwiększonym ryzykiem złamania z powodu osteoporozy.
Fizjoterapeuta powinien zachęcać dzieci i ich opiekunów do włączania elementów fizjoterapii do codziennych czynności (na przykład stania przy zlewie podczas mycia zębów w celu rozciągnięcia mięśni nóg).
Konkretne strategie w mózgowym porażeniu dziecięcym
Aby zapobiegać przykurczom lub opóźniać ich powstawanie oraz aby umożliwić pacjentowi uczestnictwo w czynnościach odpowiednich dla jego etapu rozwoju, należy rozważyć ujęcie w programie rehabilitacji 24-godzinnych strategii posturalnych. W przypadku stosowania takich strategii trzeba wziąć pod uwagę aktywne rozciąganie o niskim obciążeniu (czyli interwencje, podczas których pacjent rozciąga mięśnie w celu zwiększenia zakresu ruchu) lub bierne rozciąganie o niskim obciążeniu (czyli interwencje, podczas których rozciąganie osiąga się przy pomocy odpowiedniego pozycjonowania z zastosowaniem sprzętu, ortez lub gipsowania redresyjnego).
Fizjoterapeuta powinien zaproponować opiekunom dziecka przeszkolenie odnośnie do strategii utrzymywania prawidłowej postawy.
Aby poprawić umiejętności manualne pacjenta można rozważyć zastosowanie aktywnej terapii skupionej na zadaniu, czyli postępowania, podczas którego określa się konkretny cel, a następnie dziecko wykonuje ćwiczenia lub czynności przy pomocy porażonej kończyny lub kończyn, aby zwiększyć ich sprawność.
Przykładem takiej terapii jest terapia wymuszonego ruchu, podczas której ogranicza się tymczasowo zdrowe ramię, by wymusić korzystanie przez pacjenta z ramienia z niedowładem, a dopiero potem zastosowanie terapii bimanualnej. W przypadku zastosowania aktywnej terapii skupionej na zadaniu zaleca się intensywny program przeprowadzany w ograniczonym czasie (4-8 tygodni).
W razie występowania słabości mięśni przyczyniającej się do utraty funkcji lub trudności z utrzymywaniem postawy należy rozważyć terapię wzmacniającą mięśnie. Może być to terapia wzmacniająca mięśnie pracujące przy konkretnych zadaniach, przeprowadzana przy zastosowaniu progresywnych ćwiczeń oporowych.
Po leczeniu przy pomocy botulinotoksyny, leczeniu chirurgicznym, selektywnej rizotomii grzbietowej lub podczas terapii przy pomocy pompy baklofenowej niezbędne jest zapewnienie dostosowanego programu fizjoterapii – stanowi on konieczny element leczenia, o czym należy poinformować opiekunów dziecka.
Ważne jest regularne ocenianie programu fizjoterapii pod kątem wyznaczonych celów oraz dopasowania programu do potrzeb pacjenta.
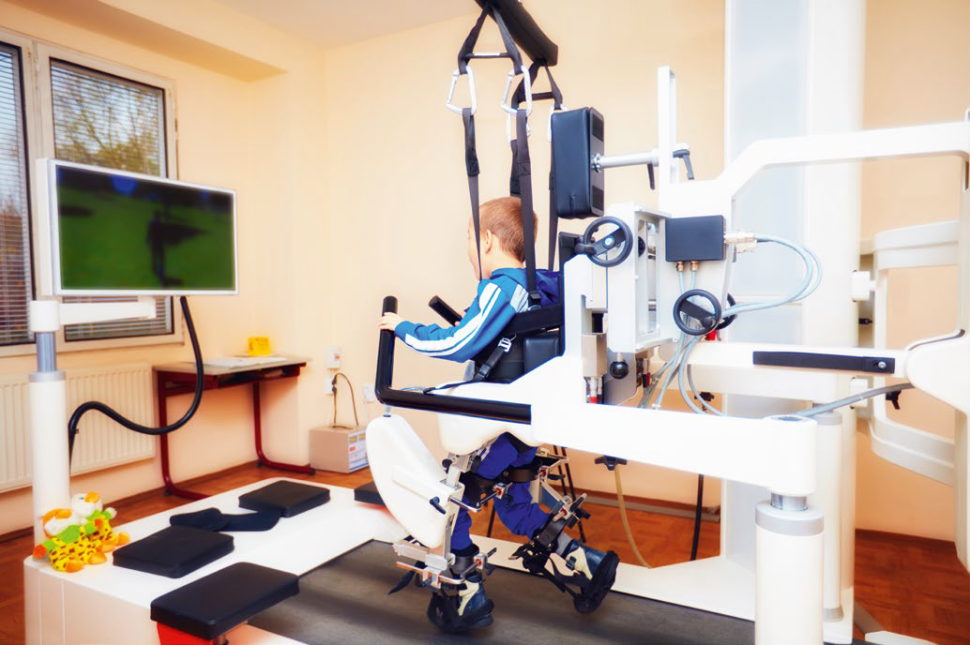
Trening na bieżni z odciążeniem
Jest to metoda terapii, podczas której pacjent, w uprzęży odciążającej jego masę ciała, ćwiczy chodzenie na powoli poruszającej się bieżni. Badania wykazały pozytywny wpływ takiego treningu u pacjentów z MPD na ich mobilność i siłę kończyn dolnych, wzorce chodu oraz poprawę równowagi. Pewne dane wskazują również, że sprzyja on proprioceptywnej informacji zwrotnej, dzięki czemu pacjent przyjmuje lepszą postawę i ma wyższą sprawność funkcjonalną13.
Ortezy
Według wytycznych NICE w terapii dzieci i młodzieży ze spastycznością pomocne mogą być różnego rodzaju ortezy, które sprzyjają poprawianiu postawy, wzmacnianiu funkcji kończyny górnej, usprawnianiu chodzenia, profilaktyce przykurczów, profilaktyce zwichnięcia stawu biodrowego, łagodzeniu bólu lub dyskomfortu oraz profilaktyce lub leczeniu urazów tkanki (na przykład poprzez odciążanie punktów nacisku). Rozważając zastosowanie ortezy, należy wziąć pod uwagę dawane przez nią korzyści oraz tworzone przez jej użycie ryzyko, np. ewentualnego dyskomfortu, urazów powodowanych przez ucisk czy zaniku mięśni z powodu ich bezczynności. Orteza może również utrudniać czynności samoobsługowe lub higieniczne. Pacjent może nie chcieć korzystać z ortezy z powodu jej wyglądu, co także należy uszanować.
Przy zastosowaniu ortezy sztywnej należy bacznie monitorować stan pacjenta, by upewnić się, że nie wywołuje ona dyskomfortu ani urazów powodowanych przez ucisk. Opiekunowie dziecka powinni zostać poinformowani, jak nakładać i nosić ortezę oraz kiedy i jak długo ją stosować.
Ortezy mające na celu utrzymywanie rozciągnięcia mięśni (zapobieganie przykurczom) są skuteczniejsze przy dłuższym stosowaniu (przynajmniej 6 godzin dziennie), natomiast ortezy wspierające konkretne funkcje powinny być stosowane tylko wtedy, kiedy jest to potrzebne.
Przy zastosowaniu ortezy należy podczas każdego kontaktu z pacjentem sprawdzić, czy nadal akceptuje on używanie ortezy, czy spełnia ona swoje zadanie odnośnie do celu leczenia, czy jest stosowana zgodnie z zaleceniami, czy jest dobrze dopasowana i w dobrym stanie i czy nie powoduje efektów ubocznych, takich jak dyskomfort, ból, zaburzenia snu, uraz czy nadmierny zanik mięśni.
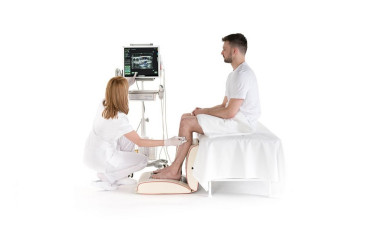
Toksyna botulinowa w mózgowym porażeniu dziecięcym
Wytyczne NICE zalecają rozważenie zastosowania toksyny botulinowej u dzieci i młodzieży z MPD w następujących przypadkach:
- przy spastyczności ogniskowej kończyny górnej lub dolnej, która zaburza odpowiednio motorykę małą lub dużą, utrudnia opiekę i utrzymywanie higieny, powoduje ból, zmniejsza tolerancję innych metod leczenia (np. stosowanie ortez), zaburza sen lub powoduje problemy natury estetycznej,
- przy ogniskowej dystonii powodującej poważne problemy, takie jak trudności posturalne czy funkcjonalne lub ból.
Nie należy natomiast stosować toksyny botulinowej u dzieci i młodzieży z poważnym osłabieniem mięśni, leczonych aminoglikozydami lub po poważnej niepożądanej reakcji na toksynę botulinową w przeszłości.
Przed podaniem toksyny botulinowej należy dokładnie zbadać napięcie mięśni, zakres ruchu i motorykę. Badanie, w którym powinien uczestniczyć fizjoterapeuta lub terapeuta zajęciowy, ma na celu umożliwienie podjęcia decyzji o wdrożeniu leczenia oraz odnotowanie stanu pacjenta w momencie początkowym, co jest niezbędne do późniejszego oceniania postępów leczenia.
Ponowną ocenę przeprowadza się 6-12 tygodni po iniekcjach, w celu sprawdzenia reakcji na leczenie, oraz 12-26 tygodni po iniekcjach, w celu podjęcia decyzji o dalszych zastrzykach. Ponowne zastosowanie iniekcji wskazane jest, jeśli reakcja organizmu na wcześniejsze zastosowanie toksyny była zadowalająca, ale efekt leczenia już ustąpił, lub jeśli zidentyfikowano nowe cele terapii poddające się tej metodzie leczenia.
Po wykonaniu iniekcji toksyny botulinowej należy rozważyć zastosowanie ortezy, która poprawiłaby rozciąganie tymczasowo osłabionego mięśnia i umożliwiła pacjentowi ćwiczenie umiejętności funkcjonalnych. Jeśli zastosowanie ortezy jest utrudnione z powodu ograniczenia biernego zakresu ruchu, zwykle stosuje się najpierw gipsowanie redresyjne w celu poprawy rozciągnięcia mięśnia. Zastosowanie gipsu dopiero 2-4 tygodni po iniekcji poprawia tolerancję pacjenta na gips i poprawia rozciągnięcie mięśni14.
Ważną rolę po iniekcjach toksyny botulinowej odgrywa fizjoterapia. Przykładem może być tutaj badanie z 2018 r. z udziałem dzieci z obustronnym porażeniem kurczowym. Pacjentów podzielono na dwie grupy. W obu grupach wykonano zastrzyki z toksyny botulinowej i na dwa tygodnie założono gips na kończyny dolne. Po zdjęciu gipsu w grupie pierwszej zastosowano tylko obuwie ortopedyczne, a w drugiej, oprócz takiego obuwia, również intensywny program fizjoterapii. Polegał on na godzinnych sesjach rozciągania mięśni i stopniowanego programu ćwiczeń bez obciążenia, ćwiczeń z oporem oraz ruchowych aktywności funkcjonalnych z obciążeniem. Ćwiczenia przeprowadzano codziennie przez 2 tygodnie. Poprawę motoryki dużej (mierzonej przy użyciu skali GMFM) zaobserwowano w obu grupach, natomiast tylko w grupie drugiej była ona znacząca. Dla porównania, w grupie pierwszej średnia poprawa po 4, 6 i 52 tygodniach od iniekcji wynosiła odpowiednio 2,6%, 4,8% i 5,5%, podczas gdy w grupie drugiej wyniosła 6,3%, 12% i 19,4%15.
Wczesna interwencja mózgowym porażeniu dziecięcym
Odnośnie do wczesnej interwencji w MPD u dzieci w wieku do 2 lat w sierpniu 2021 r. w „JAMA Pediatrics” opublikowano wytyczne kliniczne oparte o 16 przeglądów systematycznych i 27 randomizowanych badań kontrolowanych. Dokument zaleca natychmiastowe objęcie opieką dziecka w przypadku zdiagnozowania u niego wysokiego ryzyka MPD, ponieważ wczesna interwencja wykorzystuje plastyczność mózgu i innych rozwijających się układów organizmu. Rekomendowane jest także współuczestniczenie rodziców w wyznaczaniu celów przy rozpoczynaniu interwencji.
Konkretne zalecenia w zakresie rehabilitacji obejmują:
- w domenie motoryki:
- rozpoczynanie interwencji w momencie podejrzenia diagnozy MPD i niestosowanie strategii na przeczekanie, ponieważ w takim przypadku zaprzepaszcza się okazję wykorzystania krytycznego okna, gdy istnieje największa plastyczność neuromięśniowa,
- trening motoryczny oparty na konkretnych zadaniach, obejmujący odkrywanie otoczenia przez dziecko i rozwiązania pozwalające na pokonywanie ograniczeń ruchowych; wybór zadań ruchowych stanowiących wyzwanie, ale możliwych do wykonania przy wytrwałym ćwiczeniu; codzienne powtarzanie ćwiczeń pozwalających na nabywanie i doskonalenie umiejętności; szkolenie rodziców pozwalające na kontynuację ćwiczeń poza sesjami terapeutycznymi i tworzenie otoczenia sprzyjającego zróżnicowaniu ruchu oraz intensywności ćwiczeń, które jednocześnie powinny sprawiać dziecku radość,
- niezalecane są pasywne techniki przenoszenia stosowane przez terapeutę w odniesieniu do aktywacji ruchu czy czynności,
- przy podejrzeniu porażenia połowiczego zalecana jest terapia wymuszonego ruchu i/lub trening bimanualny, jako że korzyści przewyższają ryzyko szkód (w przypadku niepotwierdzenia diagnozy); zalecane są krótkie sesje terapii wymuszonego ruchu (30- 60 min. nadzorowanego przez terapeutę programu domowego przez 6 tygodni) we wczesnym niemowlęctwie i zwiększanie ich intensywności wraz z wiekiem dziecka;
- domena poznawcza:
- zalecane są celowane interwencje poznawcze obejmujące aktywny ruch inicjowany i generowany przez dziecko, z realnymi zadaniami o dostrzegalnych konsekwencjach,
- odradzane jest skupianie się na samych biernych interwencjach motorycznych w celu poprawy funkcji poznawczej (jak np. terapia neurorozwojowa, reakcje posturalne, itp.);
- jedzenie i picie u dzieci z MPD i dysfagią lub jej wysokim ryzykiem:
- sugerowane jest zmiękczanie konsystencji pokarmów dla zwiększenia bezpieczeństwa i skuteczności karmienia,
- wskazane jest stosowanie pozycji wyprostowanej lub lekko pochylonej podczas karmienia, natomiast odradzane jest stosowanie pozycji bardzo pochylonej, ponieważ może ona utrudniać przełykanie;
- wzrok u dzieci z wysokim ryzykiem mózgowych zaburzeń widzenia:
- zalecane jest wczesny program treningu wzrokowego poprawiający widzenie i uwagę na bodźce wzrokowe oraz wczesne zastosowanie stymulacji wykorzystującej duże kontrasty lub intensywne kolory w celu poprawienia wzrokowej orientacji i mobilności;
- napięcie mięśni:
- w przypadku hipertonii powodującej ból lub zakłócającej rozwój motoryczny zalecane jest rozpoczęcie kompleksowego, nakierowanego na konkretne cele leczenia hipertonii; powinno być ono stosowane razem z wybranymi interwencjami motorycznymi;
- domena mięśniowo-szkieletowa:
- u dzieci z ryzykiem dysplazji stawu biodrowego, nie wykonujących stania z obciążeniem w wieku, gdy zwykle dzieci zaczynają stać z obciążeniem, zalecane jest regularne stosowanie sprzętu do stania (pionizatorów) w ramach programu aktywnych interwencji w celu zmniejszenia współczynnika migracji stawu biodrowego i utrzymania zakresu ruchu odwodzenia tego stawu,
- u dzieci z ryzykiem przykurczu stawu skokowego zalecane są ortezy stawu skokowego i stopy w celu poprawienia lub utrzymania zakresu ruchu zgięcia grzbietowego (uwaga: takie ortezy mogą ograniczać aktywny ruch, ale zapewniają stabilność podczas stania)16.
Weryfikacja skuteczności ćwiczeń w mózgowym porażeniu dziecięcym
Efektywności ćwiczeń w MPD poświęcone są dwa nowe przeglądy badań. Pierwszy, przeprowadzony w 2017 r., to przegląd Cochrane, który objął 29 badań z udziałem 926 uczestników. Autorzy stwierdzają, że wyciąganie stanowczych wniosków było utrudnione ze względu na słabą jakość dostępnych dowodów i małą wielkość prób obejmowanych poszczególnymi badaniami. Według wyników przeglądu ćwiczenia aerobowe mogą skutkować niewielką krótko- i średnioterminową poprawą motoryki dużej oraz poprawą aktywności fizycznej.
Dowody o niskiej i bardzo niskiej jakości sugerują, że ćwiczenia aerobowe nie poprawiają prędkości chodu, wytrzymałości podczas chodzenia czy sprawności aerobowej. Jeśli zaś chodzi o trening oporowy, nie poprawia on aktywności ani uczestnictwa osób z MPD, ale może poprawiać krótko- i średnioterminowo siłę mięśni u dzieci i młodzieży (u młodych osób dorosłych tylko krótkoterminowo). Jedno badanie wskazywało również, że trening oporowy krótkoterminowo poprawia wytrzymałość u dzieci z MPD podczas chodzenia.
Generalnie dostępne dane świadczą o bezpieczeństwie ćwiczeń dla osób z MPD. Niewielka liczba uczestników zgłaszała takie dolegliwości, jak bolesność mięśni, łagodny ból kolana, stopy i stawu skokowego, zmęczenie czy łagodne naciągnięcie mięśni łydki lub upadki (przy czym w jednym przypadku upadek spowodował złamanie)17.
Drugi przegląd, opublikowany w 2021 r., obejmował 27 badań z udziałem 834 dzieci z MPD, bez podziału na typy ćwiczeń. Według metaanalizy badań interwencje ćwiczeniowe nie miały znaczącego wpływu na poziom motoryki dużej, choć inny typ analizy wskazuje na istnienie takiego korzystnego wpływu. Autorzy spekulują, że nie okazał się on znaczący być może z powodu zbyt małej intensywności programów ćwiczeniowych lub niedostatecznego stosowania się pacjentów do zaleceń. Takich wątpliwości nie było odnośnie do prędkości chodu i siły mięśni – metaanaliza potwierdziła, że ćwiczenia znacząco poprawiają te parametry18.
W roku 2019 opublikowano przegląd badań nad skutecznością fizjoterapii w mózgowym porażeniu dziecięcym. Jego autorzy, po przeanalizowaniu 34 przeglądów systematycznych na temat różnych interwencji u dzieci z MPD, stwierdzili, że niezależnie od typu MPD korzystny wpływ na pacjentów ma intensywny trening funkcjonalny. Natomiast u dzieci z porażeniem połowiczym większą poprawę funkcji kończyny górnej osiąga się dzięki terapii wymuszonego ruchu.
Oprócz niej najsilniejsze dowody naukowe przemawiają za stosowaniem takich interwencji jak trening funkcjonalny nakierowany na konkretny cel, trening siłowy kończyn dolnych i trening chodu w celu poprawienia szybkości chodzenia. W przypadku zaś hipoterapii, treningu wirtualnego, wibracji całego ciała, wczesnej interwencji (odnośnie do motoryki) oraz funkcjonalnej elektrostymulacji dowody nie są mocne.
Przy podejmowaniu decyzji o ich zastosowaniu należy się kierować oceną kliniczną, preferencjami pacjenta i jego rodziny oraz możliwościami funkcjonalnymi i motorycznymi dziecka. Natomiast interwencje typu terapii neurorozwojowej (NDT – neurodevelopmental therapy) nie wykazały żadnej skuteczności i autorzy przeglądu zalecają usunięcie ich ze standardu opieki19.
Efektom terapii wymuszonego ruchu poświęcone było niedawne, bo opublikowane w listopadzie zeszłego roku, badanie amerykańskie. Podczas eksperymentu dzieci z porażeniem połowiczym podzielono na pięć grup. Jedną z nich objęto terapią standardową, dwie – terapią wymuszonego ruchu w trybie zwykłym (2,5 godziny trzy razy w tygodniu przez cztery tygodnie), przy czym w jednej z nich sprawną kończynę górną unieruchomiono przy pomocy gipsu, a w drugiej – przy pomocy szyny zakładanej wyłącznie na czas sesji. W dwóch pozostałych grupach przeprowadzono terapię wymuszonego ruchu w trybie intensywnym (trzy godziny dziennie, pięć dni w tygodniu przez cztery tygodnie), a różniły się one znowu sposobem unieruchomienia sprawnej kończyny. Jak można się było spodziewać, poprawa była zdecydowanie największa w obu grupach ćwiczących intensywnie. Co więcej, uzyskane w nich wyniki utrzymywały się co najmniej pół roku po zakończeniu terapii. Ponadto, u dzieci z grupy objętej terapią standardową zaobserwowano poprawę większą od spodziewanej w oparciu o wcześniejsze badania, co oznacza, że nawet zwykła terapia przynosi wymierne korzyści. Zauważono również, że generalnie rodzaj zastosowanego ograniczenia sprawnej kończyny nie miał większego znaczenia dla pacjentów, którzy – w przypadku noszonego cały czas gipsu – szybko adaptowali się do tej niedogodności. Jak mówią autorzy eksperymentu, zaobserwowana u dzieci z MPD wielkość zmian przeszła ich oczekiwania i świadczy o wielkim potencjale tego, co można osiągnąć dzięki ćwiczeniom20.
Natomiast we wrześniu 2021 r. zespół australijskich uczonych opublikował międzynarodowe wytyczne praktyki klinicznej na temat interwencji mających poprawiać funkcjonowanie fizyczne dzieci i młodzieży z MPD. Dokument oparto na wynikach trzech przeglądów systematycznych, trzydziestu badaniach randomizowanych i pięciu badaniach typu przed/po. Dane naukowe sugerują, że cele funkcjonalne można osiągnąć przy pomocy interwencji obejmujących ćwiczenie wykonywania całych zadań w rzeczywistym otoczeniu, wyznaczonych w oparciu o cele określone przez pacjenta. Jednocześnie niezbędne jest udzielanie wsparcia rodzinom pacjentów i zastosowanie podejścia zespołowego. Pod uwagę należy brać wiek, możliwości i preferencje dziecka i jego rodziny.
W celu usprawnienia zdolności chodzenia zalecane jest chodzenie po płaskich powierzchniach, do którego można dodać trening na bieżni. Jeśli chodzi o cele związane z funkcją kończyn górnych, pomocna może być terapia bimanualna, terapia wymuszonego ruchu, trening ukierunkowany na zadania oraz podejścia kognitywne. W zakresie czynności samoobsługowych zwiększenie samodzielności i zmniejszenie obciążenia opiekuna można osiągnąć poprzez ćwiczenie całych zadań połączone z urządzeniami wspomagającymi.
Natomiast praca nad celami dotyczącymi uczestnictwa w rekreacji może łączyć ćwiczenie całych zadań ze strategiami pokonywania barier środowiskowych, osobistych i społecznych21.
Jeśli chodzi o efektywność toksyny botulinowej, polscy naukowcy przeprowadzili przegląd danych naukowych odnośnie do jej zastosowania w porażeniu mózgowym. Doszli oni do wniosku, że preparaty te skutecznie zmniejszają hipertonię kończyn górnych i dolnych i są bezpieczne, a wywoływane przez nie efekty uboczne zdarzają się rzadko i w większości są łagodne i przemijające. Toksyna botulinowa powinna być podawana tym pacjentom, u których ma ona potencjał przyniesienia znaczącej korzyści odnośnie do funkcjonowania, integralności stawu biodrowego, wygody lub opieki. Autorzy zaznaczają jednocześnie, że preparaty te koniecznie należy łączyć z takimi metodami leczenia jak terapia zajęciowa, fizjoterapia, ortezy lub gipsowanie22.
Podsumowując, rehabilitacja może realnie pomóc dzieciom z MPD, pod warunkiem, że obejmuje ona uzasadnione naukowo interwencje dopasowane do indywidualnych potrzeb pacjenta.
- Rosembaum P. et al., Dev Med Child Neurol. 2007; 49 (Suppl 109): 8-14.
- Thornhill Pakula A. et al., Phys Med Rehabil Clin N Am. 2009; 20: 425-452.
- Fowler EG et al., Phys Ther. 2008 Nov; 87(11): 1495-510.
- https://www.nichd.nih.gov/health/topics/cerebral-palsy/conditioninfo/causes
- McIntyre S. et al., Dev Med Child Neurol. 2012 Nov, doi.org/10.1111/dmcn.12017
- https://www.cerebralpalsyguidance.com/cerebral-palsy/risk-factors/
- Ingram TTS, Arch Dis Childh. 1966; 41: 337.
- Surveillance of Cerebral Palsy in Europe, Dev Med Child Neurol. 2000 Dec; 42(12): 816-24.
- Palisano RJ et al., Dev Med Child Neurol. 2008; 50(10): 744-750.
- Ogoke C.C., in: Cerebral Palsy – Clinical and Therapeutical Aspects, editor: IJ Al-Zweini, Dec 2018,
10.5772/INTECHOPEN.79246 - Günel MK. INTECH Open Access Publisher; 2011. Physiotherapy for Children with Cerebral Palsy. Åeljka
Petelin GadÅe (ed) Epilepsy in Children „Clinical and Social Aspects”. - Cerebral palsy in under 25s: assessment and management. National Guideline Alliance (UK), London:
National Institute for Health and Care Excellence (NICE); 2017 Jan. - Cheng RJ et al., Am J Phys Med Rehabil. 2007; 86; 548-55.
- Spasticity in under 19s: management. London: National Institute for Health and Care Excellence
(NICE); 2016 Nov. National Istitute for Heath and Care Excellence: Guidelines. - Flemban A, Elsayed W., J Phys Ther Sci. 2018 Jul; 30(7): 902-905.
- Morgan C. et al., JAMA Pediatrics. 2021 Aug 17; 175(8): 846-858.
- Ryan JM, Cochrane Database Syst Rev. 2017 Jun; 2017(6): CD011660.
- Liang X. et al., J Rehabil Med. 2021 Apr 1; 53(4): jrm00176.
- Das SP, Ganesh GS, Indian J Orthop. 2019 Jan-Feb; 53(1): 20-34.
- Ramey SL et al., Pediatrics. 2021 Nov; 148(5): e2020033878.
- Jackman M. et al., Dev Med Child Neurol. 2021 Sep; doi: 10.1111/dmcn.15055.
- Bonikowski M., Sławek J., Neurol Neurochir Pol. 2021; 55(2): 158-164.