Ostatnie badania na ludziach pokazują, że kwasy tłuszczowe omega-3 pochodzenia morskiego mogą wpływać na odpowiedź wysiłkową i żywieniową mięśni szkieletowych. Kwasy tłuszczowe omega – 3 pochodzenia morskiego mają potencjał, aby zmienić przebieg wielu chorób człowieka, w tym spadek formy fizycznej związany ze starzeniem się. Badamy potencjalne mechanizmy molekularne, przez które kwasy tłuszczowe omega-3 mogą działać w mięśniach szkieletowych.
1. Wstęp
Światowa Organizacja Zdrowia szacuje, że w ciągu ostatnich trzech dekad liczba osób otyłych na świecie wzrosła prawie dwukrotnie, do ponad 1,4 miliarda, co oznacza, że aż jedna trzecia populacji krajów zachodnich ma nadwagę/otyłość. Równocześnie ze wzrostem wskaźników otyłości następuje wzrost liczby zaburzeń związanych z otyłością, takich jak cukrzyca typu 2 (T2D), otyłość sarkopeniczna i choroby układu krążenia, co sprawia, że otyłość jest jednym z głównych problemów opieki zdrowotnej na świecie. Nadwaga/otyłość zwiększa ryzyko rozwoju cukrzycy nawet o 30%1. Koszty podstawowej opieki diabetologicznej w brytyjskiej Narodowej Służbie Zdrowia (NHS) wynoszą obecnie 9,8 miliarda funtów rocznie i oczekuje się, że będą nadal rosły (NHS). Mięśnie szkieletowe są głównym miejscem utylizacji glukozy, odpowiadając za około 30% poposiłkowej utylizacji glukozy2. Utrzymanie zdrowia metabolicznego mięśni szkieletowych jest zatem kluczowe dla zachowania kontroli glikemii. Strategie, które poprawiają funkcję metaboliczną mięśni szkieletowych i wrażliwość na insulinę, mogą mieć zatem istotny wpływ na wywołany otyłością rozwój insulinooporności i cukrzycy, a także zmniejszyć koszty opieki zdrowotnej i poprawić jakość życia. Utrzymanie masy mięśni szkieletowych ma kluczowe znaczenie nie tylko dla utrzymania funkcji metabolicznej, ale także poprzez kontrolę lokomocji jest kluczowe dla utrzymania funkcji fizycznych. Mięśnie szkieletowe (w zależności od poziomu otyłości) stanowią około 40% całkowitej masy ciała i są wysoce adaptacyjne do zmian środowiskowych, takich jak dieta i poziom aktywności fizycznej3,4.
Utrata masy mięśniowej wraz z postępującym wiekiem jest nieuniknionym aspektem procesu starzenia się5. Zmniejszenie masy mięśni szkieletowych i funkcji metabolicznych może mieć szkodliwy wpływ na ogólny stan zdrowia i jest głównym czynnikiem przyczyniającym się do pojawienia się chorób wraz z wiekiem6. Utrata masy mięśniowej i wynikającej z niej funkcji fizycznej nie tylko zwiększa ryzyko wystąpienia chorób przewlekłych, ale prowadzi do kruchości i obniżenia jakości życia6. Od około 50. roku życia masa mięśni szkieletowych zmniejsza się o 0,2% – 0,5%/rok, a utrata ta ulega przyspieszeniu w stanie chorobowym7. Co więcej, już 5% spadek masy mięśni szkieletowych wiąże się ze zwiększoną zachorowalnością8. Jeśli wskaźnik sarkopenii (utrata masy mięśniowej związana z wiekiem) można zmniejszyć o 10%, przełożyłoby się to na oszczędności w kosztach opieki zdrowotnej w USA wynoszące 1,1 miliarda dolarów rocznie9. Dlatego też znalezienie skutecznych terapii poprawiających masę mięśniową i funkcję metaboliczną ma ogromne znaczenie kliniczne. Ostatnie dowody sugerują, że manipulowanie zawartością wielonienasyconych kwasów tłuszczowych (PUFA) omega-3 w mięśniach szkieletowych może poprawić ich funkcję i metabolizm10,11. W tym przeglądzie skupimy się na potencjalnej roli terapeutycznej i molekularnym mechanizmie działania PUFAs omega-3, z naciskiem na morskie pochodne PUFAs omega-3, w regulacji metabolizmu i funkcji fizycznej mięśni szkieletowych.
2. Źródła kwasów tłuszczowych w diecie i wpływ stosunku n-3/n-6 na zdrowie metaboliczne
Jak już wcześniej wspomniano, mięśnie szkieletowe są w dużym stopniu przystosowane lub niedostosowane do zmian w składzie diety. W szczególności dieta o dużej zawartości tłuszczów nasyconych jest powiązana z wystąpieniem otyłości i T2D12,13. Jednakże dieta o wysokiej zawartości wielonienasyconych kwasów tłuszczowych, taka jak dieta śródziemnomorska, jest powiązana z korzystnymi wynikami, takimi jak poprawa zdrowia sercowo-naczyniowego14,15. Ponadto tradycyjna dieta Eskimosów, która jest bogata w kwasy omega-3 PUFA i uboga w kwasy omega-6, wiąże się z obniżonym ryzykiem chorób sercowo-naczyniowych i poprawą wrażliwości na insulinę, mimo że jest to dieta o dużej zawartości tłuszczu16,17. Dlatego ilość i rodzaj tłuszczu w diecie może odgrywać ważną rolę w regulacji zdrowia metabolicznego całego organizmu.
Gatunki kwasów tłuszczowych klasyfikuje się ze względu na ich różny stopień nasycenia na trzy główne klasy: nasycone kwasy tłuszczowe (SFA), jednonienasycone kwasy tłuszczowe (MUFA) i wielonienasycone kwasy tłuszczowe (PUFA). SFA to prosty łańcuch węglowy nie zawierający żadnych wiązań podwójnych, MUFA zawierają jedno wiązanie podwójne, a PUFA są klasyfikowane jako łańcuchy węglowe zawierające dwa lub więcej wiązań podwójnych. Różnice w strukturze chemicznej tych różnych klas mogą prowadzić do różnych efektów fizjologicznych. Na przykład SFA zostały powiązane z rozwojem dysfunkcji metabolicznych, podczas gdy odwrotnie niektóre MUFA i PUFA mają pozytywny wpływ na funkcje metaboliczne18,19.
Na poziomie komórkowym kwasy tłuszczowe mają nie tylko znaczenie strukturalne, jako główny składnik błon komórkowych, ale również pełnią ważną funkcję w wielu procesach metabolicznych, takich jak regulacja aktywności niektórych enzymów oraz poprzez działanie jako cząsteczki sygnalizacyjne20. Dlatego też zmiany w składzie puli lipidów mięśniowych mogą mieć głęboki wpływ na metabolizm i funkcje fizyczne mięśni szkieletowych. Wiadomo, że mięśnie szkieletowe są wrażliwe na zmiany zawartości lipidów w diecie, przy czym do istotnej zmiany składu lipidów mięśniowych wystarczy co najmniej 2-tygodniowa zmiana diety21-23. Zmiana funkcji komórkowej spowodowana zmianą składu lipidów jest prawdopodobnie spowodowana faktem, że różne gatunki kwasów tłuszczowych wykazują zróżnicowaną strukturę od prostych nasyconych łańcuchów węglowych do wysoce nienasyconych łańcuchów węglowych, te różnice w strukturze są dużym czynnikiem determinującym funkcję. Zanim kwasy tłuszczowe mogą mieć wpływ na metabolizm komórkowy, muszą być najpierw przetransportowane do komórki. Jednak transport i metabolizm kwasów tłuszczowych musi być ściśle regulowany, ponieważ wysokie wewnątrzkomórkowe poziomy wolnych kwasów tłuszczowych mogą być bardzo toksyczne z powodu peroksydacji lipidów, teoretycznie, wysoko nienasycone kwasy tłuszczowe będą najłatwiej utleniane. W związku z tym istnieje szereg białek transportujących (CD36/FATP/FABPpm) i cytozolowych (FABPc), które regulują wychwyt i lokalizację subkomórkową kwasów tłuszczowych, umożliwiając ich efektywne magazynowanie lub metabolizowanie24. Wychwyt kwasów tłuszczowych jest analogiczny do wychwytu glukozy, w którym pęcherzyki CD translokowane są z magazynów wewnątrzkomórkowych do sarkolemmy i jest wrażliwy na stymulację insuliną oraz indukowaną skurczem aktywację AMPK24. Wiadomo również, że te białka transportowe odgrywają rolę w regulacji mitochondrialnego utleniania kwasów tłuszczowych25.
Po przetransportowaniu do komórki możliwy jest szereg losów wewnątrzkomórkowych; głównie β-oksydacji, magazynowania w dyskretnych kropelkach lipidowych lub wbudowywania w błony komórkowe. W mięśniach szkieletowych przybliżony stosunek przechowywania do utleniania wynosi 2:1, chociaż jest to zmienne w zależności od szeregu czynników, takich jak wydatek energetyczny czy typ włókna mięśniowego26. Do 90% FA transportowanych do komórki jest magazynowane lub utleniane w mięśniu soleus26. Alternatywnie, kwasy tłuszczowe są włączane do błon komórkowych; długość łańcucha węglowego, liczba i pozycja wiązań podwójnych kwasów tłuszczowych składających się na błonę determinują właściwości fizykochemiczne, takie jak płynność27. Błony zawierające fosfolipidy pozbawione wiązań podwójnych ściśle przylegają do siebie, zmniejszając płynność, podczas gdy cis-kinks w łańcuchach węglowych spowodowane podwójnymi wiązaniami w nienasyconych kwasach tłuszczowych przylegają mniej ściśle i zwiększają odkształcalność i płynność błony28. Zmiana płynności błony może wpływać na aktywność białek związanych z błoną, receptorów błonowych oraz pączkowanie i fuzję pęcherzyków29,30.
Kwasy tłuszczowe omega-3 są grupą wielonienasyconych kwasów tłuszczowych zdefiniowanych przez podwójne wiązanie przy trzecim węglu od metylowego końca łańcucha węglowego. Ludzie nie posiadają niezbędnej desaturazy omega-3, aby dodać podwójne wiązanie na 15. węglu długołańcuchowego kwasu tłuszczowego i dlatego nie są w stanie endogennie syntetyzować kwasu alfa-linolowego (ALA 18:3n-3) i kwasu linolowego (LA 18:2n-6), co czyni je niezbędnymi kwasami tłuszczowymi. Omega-6 PUFA są również niezbędnymi kwasami tłuszczowymi i zazwyczaj mają metabolicznie różne efekty w stosunku do omega-3 PUFAs. Podczas gdy organizm ludzki nie może syntetyzować PUFA omega-3 i omega-6, ma zdolność do dalszego metabolizowania tych kwasów tłuszczowych poprzez etapy wydłużania i desaturacji. ALA może być metabolizowany do kwasu eikozapentaenowego (EPA 20:5n-3) i dokozaheksaenowego (DHA 22:6n-3) odpowiednio przez Δ6 desaturazę i Δ5 desaturazę, natomiast LA jest przekształcany do kwasu arachidonowego (AA 22:4n – 6). Jednakże konwersja ALA do DHA jest bardzo nieefektywna z konwersją <10% u kobiet i <3% u mężczyzn31,32. Podczas gdy ALA jest preferowanym substratem dla Δ6 desaturazy, wykazano, że obfitość kwasu linolowego w diecie tłumi konwersję ALA do DHA33, co może być czynnikiem mylącym w tych badaniach. Ostatnio pojawiły się dowody sugerujące, że suplementacja kwasem stearidonowym (18:3n-3) może poprawić efektywność konwersji do DHA, wskazując na desaturazę Δ6 jako etap ograniczający tempo34. Istnieje również pewien stopień indywidualnej zmienności w składzie lipidów po suplementacji omega-3 u ludzi, co może być czynnikiem niejednoznacznej zmiany metabolicznej mierzonej w wielu badaniach suplementacyjnych u ludzi35.
Uważa się, że dieta hominidów w epoce paleolitu była bogata w owoce morza, a uboga w nasiona i oleje roślinne, co doprowadziło do stosunku omega-3/omega-6 wynoszącego około 1:136. Biorąc pod uwagę prawdopodobieństwo, że dieta wczesnych przodków człowieka była już bogata w kwasy omega-3, rozwój zdolności do syntezy kwasów omega-3 PUFA mógł nie przynieść żadnych korzyści ewolucyjnych. Podczas rewolucji rolniczej, ze zmianami w produkcji żywności w epoce neolitu, ten stosunek n-3/n-6 zaczął się rozchodzić i obecnie w typowej diecie zachodniej uważa się, że wynosi aż 1:20, przy czym spożycie omega-3 PUFA pochodzi głównie z ALA37. Chociaż jest mało prawdopodobne, że jest to główny czynnik napędzający, rozbieżność w stosunku n-3/n-6 nastąpiła równolegle ze wzrostem CVD i stanami przewlekłego zapalenia. Krótko mówiąc, PUFA omega-6 są związane z produkcją mediatorów prozapalnych, podczas gdy PUFA omega-3 produkują mniej silne mediatory zapalne i białka rozstrzygające o stanie zapalnym, więc manipulowanie tym stosunkiem może przynieść pozytywne efekty zdrowotne.
Potencjalne korzyści terapeutyczne wynikające z diety o wysokiej zawartości omega-3 zostały po raz pierwszy zaobserwowane w związku z mniejszą częstością występowania CVD w populacjach Eskimosów grenlandzkich17. W kolejnych badaniach zaobserwowano, że okres suplementacji omega-3 zmniejsza czynniki ryzyka związane z CVD, takie jak obniżenie stężenia triacylogliceroli (TAG) w osoczu oraz wzrost lipoprotein o wysokiej gęstości kosztem lipoprotein o niskiej gęstości, a także zmniejszenie agregacji płytek krwi35,38,39. Jednak, gdy środki punktu końcowego, takie jak choroba sercowo-naczyniowa, są brane razem w metaanalizie, wyniki suplementacji omega-3 są niejednoznaczne40-43. Postawiliśmy hipotezę, że podczas gdy dany okres suplementacji omega-3 prowadzi do znacznego wzrostu zawartości omega-3 w różnych tkankach, może nie być wystarczający do radykalnego zmniejszenia stosunku n-6/n-3.
Wyniki badań na zwierzętach, u których znacznie zmniejszono stosunek n-6/n-3, były w dużej mierze pozytywne w odniesieniu do wrażliwości na insulinę i ustępowania stanu zapalnego. Szczególnie skutecznym modelem do oceny wpływu stosunku n-6/n-3 jest model myszy transgenicznej fat-1, która potrafi endogennie syntetyzować kwasy omega-3 PUFA z omega-6 PUFA 44. Zdolność do przekształcania kwasów tłuszczowych omega-6 do omega-3 prowadzi do uzyskania stosunku n-6/n-3 wynoszącego około 1. Model ten pozwala na zastosowanie tej samej diety we wszystkich warunkach i porównanie dwóch znacząco różniących się stosunków n-6/n-3. Trudno jest jednak rozróżnić, czy jakiekolwiek efekty wynikają ze zmniejszenia ogólnego stosunku n-6/n-3, czy też ze wzrostu samych PUFA omega-3. Zmniejszenie stosunku n-6/n-3 wiąże się z poprawą tolerancji glukozy w całym organizmie, jak również zapobiega związanemu z wiekiem spadkowi tolerancji glukozy45,46. Myszy Fat-1 były również chronione przed związaną z otyłością aktywnością zapalną i spadkiem wrażliwości na insulinę47. Ponieważ obniżenie stosunku n-6/n-3 prowadziło również do zwiększenia wydzielania insuliny48. Badania te pokazują, że równowaga pomiędzy PUFA omega-6 i omega-3 w puli lipidów może mieć potencjalną rolę w określaniu efektów metabolicznych PUFA omega- 3. Badania mające na celu określenie tego stosunku u ludzi byłyby jednak trudne do odpowiedniego kontrolowania. W badaniu na ludziach dotyczącym diety typu śródziemnomorskiego, która doprowadziła do zmniejszenia stosunku n-6/n-3, zaobserwowano, że to zmniejszenie wraz z innymi zmiennymi może zapewnić pewną ochronę przed dysfunkcją metaboliczną, dostarczając pewnych dowodów, że zmiany w zawartości kwasów tłuszczowych mogą mieć wpływ na zdrowie człowieka15.
3. EPA vs. DHA
Omega-3 PUFA składają się z heterogenicznej mieszaniny kwasów tłuszczowych, z których kwas eikozapentaenowy (EPA, 20:5) i kwas dokozapentaenowy (DHA, 22:6) są obecnie uważane za najbardziej bioaktywne spośród gatunków omega-3, jednak kwas dokozapentaenowy (DPA, 22:5), pośrednik EPA i DHA, może również mieć korzystne efekty zdrowotne49. Pomimo bardzo podobnej budowy i wspólnych niektórych efektów metabolicznych pojawiają się dowody, że różne PUFA omega-3 niezależnie zmieniają funkcje metaboliczne. Rola DPA w metabolizmie mięśni szkieletowych pozostaje niejasna ze względu na stosunkowo niedawną dostępność w czystej postaci. Badania wykazały jednak, że DPA ma podobne, a w niektórych przypadkach silniejsze działanie niż EPA i DHA, chociaż do tej pory wiedza na temat wpływu DPA na zdrowie mięśni szkieletowych jest ograniczona50-52. Istnieją również dowody sugerujące, że EPA ma silniejszy wpływ na metabolizm białek mięśni szkieletowych w porównaniu z DHA53. Typowa zachodnia dieta jest jednak uboga w kwasy tłuszczowe omega-3 PUFA i obfita w kwasy omega-654. Ten stosunek n-6/n-3 jest związany z podwyższonym stanem przewlekłego zapalenia, który został powiązany z takimi chorobami jak T2D i otyłość55. Obecnie coraz więcej dowodów przemawia za tym, że równolegle z działaniem CV i przeciwzapalnym, PUFA omega-3 odgrywają korzystną rolę w metabolizmie i funkcji mięśni szkieletowych10,11. Chociaż mechanizmy działania, które leżą u podstaw tych zmian, nie zostały jeszcze w pełni scharakteryzowane. Omówimy niektóre z badań ukazujących mechanizmy działania PUFAs omega-3 i tam, gdzie ma to zastosowanie, potencjalne zróżnicowane działanie EPA i DHA.
4. Anabolizm mięśni szkieletowych
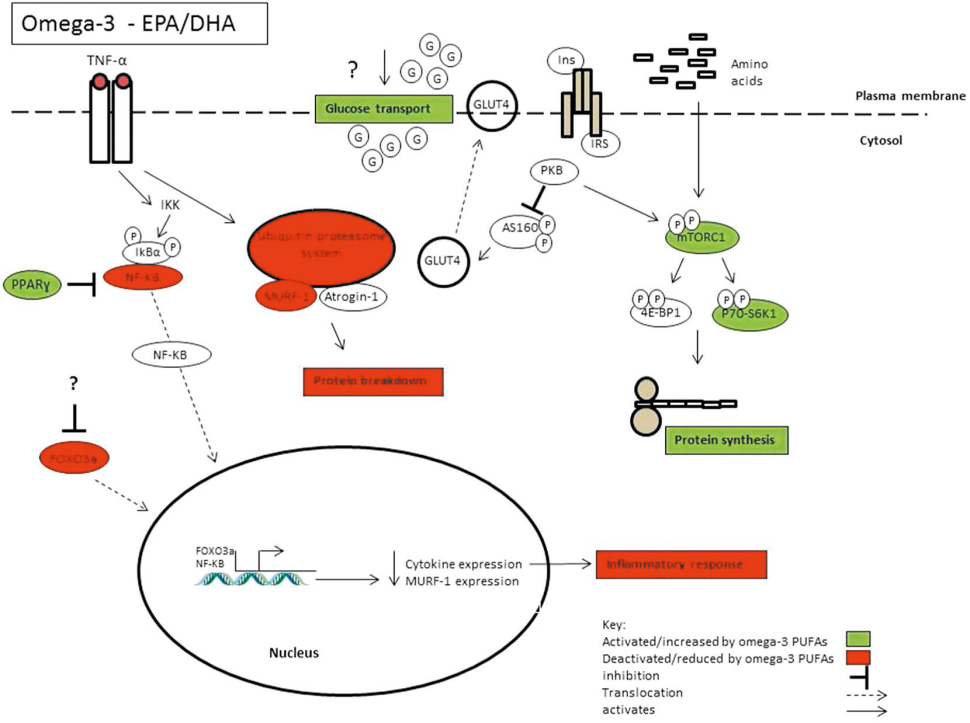
Obecnie istnieje coraz więcej dowodów na to, że omega-3 PUFAs mają również wewnętrzne właściwości anaboliczne/ antykataboliczne w mięśniach szkieletowych. Równowaga białek mięśniowych jest regulowana przez zmiany w stosunku syntezy białek mięśniowych (MPS): rozpad białek mięśniowych (MPB). Wzrost MPS lub spadek MPB prowadzi do dodatniego bilansu i ostatecznie do hipertrofii56. Dezaktywacja mięśni z powodu choroby lub urazu wiąże się z poważną utratą mięśni szkieletowych57. Jednak w niektórych badaniach wykazano, że suplementacja omega – 3 może stępić utratę masy mięśni szkieletowych58-60. Wiadomo, że zwiększenie dostępności aminokwasów stymuluje wzrost MPS, a suplementacja omega-3 może potęgować tę odpowiedź na bodźce anaboliczne61-63. W randomizowanym, kontrolowanym badaniu u zdrowych osób w podeszłym wieku zaobserwowano, że PUFA omega-3 potęgują odpowiedź syntezy białek mięśniowych (MPS) na symulowane żywienie (klamra hiperinsulemia-hyperaminoacidemia) po 8 – tygodniowym okresie suplementacji (1,86 g EPA, 1,5 g DHA/dzień), niezależnie od zwiększonego działania glukozy. Co ważne, suplementacja omega-3 nie miała wpływu na podstawowe wskaźniki MPS63. W badaniu kontynuacyjnym również zaobserwowano ten sam trend wpływu PUFA omega – 3 na MPS u zdrowych osób w młodym i średnim wieku62.
Zwiększone wskaźniki MPS były niezależne od jakiejkolwiek aktywności przeciwzapalnej, ponieważ nie zaobserwowano żadnych zmian w markerach surowicy lub TAG w osoczu po suplementacji, co prawdopodobnie można wyjaśnić faktem, że wszyscy ochotnicy byli zdrowymi osobami. Zamiast tego uważa się, że ten efekt anaboliczny jest częściowo pośredniczony przez zwiększoną fosforylację mechanicznego celu rapamycyny (mTOR) i celu sygnalizacyjnego P70-S6K1, kluczowej ścieżki regulacyjnej syntezy białek, a przez to masy mięśniowej64,65. Rodacki i wsp. (2012) jako pierwsi ocenili, czy suplementacja omega-3 może poprawić funkcjonowanie mięśni u osób starszych w połączeniu z treningiem oporowym11. Suplementowali oni 45 osób przez 90 dni kwasami tłuszczowymi omega-3 w ilości 2 g/dzień w połączeniu z 90-dniowym progresywnym programem ćwiczeń oporowych. Stwierdzili, że siła mięśni i funkcja nerwowo-mięśniowa uległy znacznej poprawie, gdy suplementacja omega-3 była połączona z ćwiczeniami oporowymi, ale sam omega-3 nie miał żadnego wpływu. Potencjalnym mechanizmem poprawy funkcji skurczowej przez omega-3 PUFAs może być zwiększona wrażliwość mięśnia na acetylocholinę, neuroprzekaźnik stymulujący skurcz mięśnia. Wyższa dawka omega-3 PUFAs niż ta zastosowana przez Rodackiego i współpracowników (2012) wykazała, że suplementacja starszych osób 4 g omega-3 PUFAs dziennie przez sześć miesięcy zachowała masę i funkcję mięśni, nie ze względu na efekty wywołane ćwiczeniami, osłabiając normalne spadki związane ze starzeniem się 10. Omega-3 PUFA mogą mieć potencjalne znaczenie w warunkach klinicznych jako niefarmakologiczna metoda zmniejszania utraty mięśni.
5. Elastyczność metaboliczna mięśni szkieletowych a insulinooporność
Mięśnie szkieletowe wykazują dużą zdolność adaptacji do zmian w dostępności substratów i mogą przełączać się między utlenianiem tłuszczu i glukozy w odpowiedzi na zmiany warunków środowiskowych83. Zdolność do przełączania się między różnymi źródłami paliwa, określana jako elastyczność metaboliczna, jest zmniejszona przez otyłość i T2D w spoczynku i podczas ćwiczeń 84,85. W badaniach zaobserwowano, że zdolność do utleniania tłuszczu jest w szczególności osłabiona przez T2D86,87. Zarówno EPA, jak i DHA w podobny sposób poprawiają zdolność adaptacji do zmiennej dostępności substratów w hodowanych komórkach mięśniowych88. Jednak nie wszystkie badania badające wpływ PUFA omega-3 na selekcję substratów wykazały niespójne wyniki. U zdrowych osób trzy tygodnie suplementacji omega-3 zwiększyły oksydację tłuszczu o 35% kosztem utylizacji glukozy w odpowiedzi na bolus glukozy89. Badanie kontynuacyjne wykazało tendencję do zwiększonego utleniania tłuszczu podczas ćwiczeń (60% VO2 max), jednak różne tryby i intensywność ćwiczeń prawdopodobnie zmieniłyby te wyniki90.
Przesunięcie w kierunku wykorzystania tłuszczu podczas ćwiczeń może być charakterystyczne dla wszystkich PUFA, ponieważ kwasy tłuszczowe omega-6 tłumią aktywację dehydrogenazy pirogronianowej (PDH) na początku ćwiczeń91. Jednak według wiedzy autorów nie ustalono jeszcze, czy omega-3 również tłumi aktywność PDH. Inna grupa zaobserwowała zależne od czasu zmiany w selekcji substratów u osób z T2D, przy czym olej rybi zwiększał utylizację glukozy po jednym tygodniu, jednak po dziewięciu tygodniach zwiększał oksydację tłuszczu92. Mięśnie szkieletowe są podstawowym miejscem stymulowanej insuliną utylizacji glukozy, a wszelkie zaburzenia tego procesu mogą prowadzić do rozwoju insulinooporności (IR), poprzedzającej T2D2,106. Zmniejszona wrażliwość mięśni szkieletowych na stymulację insuliną jest jednym z podstawowych defektów prowadzących do rozwoju T2D107. T2D charakteryzuje się w mięśniach szkieletowych zmniejszeniem wychwytu glukozy, zmniejszeniem syntezy glikogenu, upośledzeniem oksydacji tłuszczów i zwiększeniem puli wewnątrzmięśniowej (TAG)108,109.
6. Zapalenie
Chociaż jest to zbytnie uproszczenie, kwasy tłuszczowe omega-6, szczególnie kwas arachidonowy (AA, 20:4), mają silniejsze działanie zapalne w porównaniu z omega-3 PUFAs. Podczas gdy przejściowe zapalenie jest ważnym procesem w adaptacji mięśni, brak skutecznego rozwiązania zapalenia prowadzący do przewlekłego stanu zapalnego jest związany z IR/T2D i otyłością79,143. Istnieje coraz więcej dowodów, że omega-3 PUFAs mają silne działanie przeciwzapalne144. Synergistycznie, EPA i DHA odgrywają rolę w rozwiązywaniu stanu zapalnego poprzez pochodne EPA i DHA mediatory zapalne, takie jak prostaglandyny, leukotrieny, lipoksyny, rezolwiny i proteiny. Przeciwzapalne działanie EPA i DHA w przeważającej mierze zależy od wbudowania w fosfolipidy. EPA i DHA w różny sposób zmieniają odpowiedź zapalną poprzez specyficzne dla lipidów wytwarzanie mediatorów pochodzących z lipidów. Chociaż zapalenie może nie mieć pierwszoplanowej roli w rozwoju IR u mięśni szkieletowych, może uwypuklać dysfunkcję metaboliczną wywołaną przez początek IR/T2D 110. Na przykład media kondycjonowane z makrofagów traktowanych palmitynianem indukują insulinooporność w komórkach mięśni szkieletowych158.
Ponadto w wielu badaniach na zwierzętach, w których szlaki zapalne są genetycznie wyregulowane, wykazano, że zapobieganie zapaleniu wywołanemu przez otyłość może zapobiec rozwojowi insulinooporności159,160. Kontrola zapalenia może być zatem ważnym czynnikiem w długoterminowym zarządzaniu IR mięśni szkieletowych. Badania in vivo oceniające immunomodulacyjny efekt PUFAs omega-3 u ludzi są ograniczone. Jednak dieta bogata w EPA i DHA jest odwrotnie związana ze stężeniem białka reaktywnego-c161. Wykazano również, że PUFA omega-3 zwiększają proliferację limfocytów, jak również zmieniają funkcję neutrofili i komórek naturalnych zabójców162-165. Wyniki badań in vivo są niejednoznaczne, niektóre wykazały korzystny efekt w tkance tłuszczowej osób poważnie otyłych, podczas gdy u osób z umiarkowaną nadwagą nie zaobserwowano żadnego efektu166,167. Ćwiczenia mogą mieć również wpływ na funkcje immunologiczne i sześć tygodni suplementacji omega-3 zwiększa aktywność naturalnych zabójców po ćwiczeniach168. Badania nad dawką niezbędną do wywołania efektu przeciwzapalnego są nadal ograniczone. W jednym z badań stwierdzono, że zdolność EPA do redukcji prostaglandyny E2 wystąpiła pomiędzy spożyciem 1,35 a 2,75 g/dzień, co sugeruje próg dla efektów przeciwzapalnych148. Dawka EPA jest zazwyczaj niższa w wielu badaniach, co może być możliwym czynnikiem niejednoznacznych zmian markerów zapalnych obserwowanych w badaniach suplementacyjnych. Biorąc pod uwagę, że mięśnie szkieletowe stanowią do 40% całkowitej masy ciała, znaczna zmiana składu lipidów i następcza produkcja eikozanoidów może mieć duży wpływ na ogólnoustrojowy stan zapalny.
7. Wnioski
Wyniki z prób suplementacji omega-3 często były mieszane, dając zerowe odpowiedzi, gdy połączone w metaanalizach. Postawiliśmy hipotezę, że jedną z podstawowych zmiennych, które mogą ograniczać działanie kwasów tłuszczowych omega-3 jest wysoki stosunek n-6/n-3. Najwyraźniej związek między omega-3 i omega-6 PUFAs nie jest po prostu antagonistyczny i różne efekty kwasów tłuszczowych w każdej podklasie dodaje do złożoności. Dalsze badania powinny mieć na celu rozpowszechnienie interakcji między omega-3 i omega-6 PUFAs i jak to może wpływać na metabolizm. Obecnie dostępne dowody sugerują, że omega-3 PUFAs EPA i DHA mogą być skuteczne w zapobieganiu szkodliwym skutkom stanów zanikowych lub zapalenia o niskim stopniu złośliwości (rysunek 1). Badania koncentrowały się głównie na EPA i DHA, jednak obecnie okazuje się, że DPA ma również podobne, a w niektórych przypadkach silniejsze działanie. Pojawiają się dowody na to, że różne PUFA omega-3 pełnią rozbieżne funkcje metaboliczne i konieczne są dalsze badania, aby zrozumieć różne mechanizmy leżące u podstaw tych efektów. Ostatnie postępy w technikach „omic” i technologii spektrometrii masowej pozwolą na wszechstronne i czułe podejście do analizy zmian metabolicznych wywołanych przez przyswajanie omega-3. Obecnie PUFA omega-3 są pozyskiwane głównie ze źródeł morskich. Biorąc pod uwagę rosnącą presję środowiskową na populacje ryb, stawia to pod znakiem zapytania trwałość ryb jako odpowiedniego źródła omega-3. Szacuje się, że do 2050 roku populacja ludzka osiągnie 9,1 miliarda, a globalne ocieplenie zmniejszy zawartość omega-3 w algach, zmniejszając całkowitą zawartość omega-3 w rybach175. Podkreśla to potrzebę zrozumienia mechanizmów działania PUFA omega-3, co może doprowadzić do opracowania mimetyku omega-3 i zapewnić trwałe, długoterminowe źródło.
Żródło: Mar. Drugs 2015, 13, 6977-7004; doi:10.3390/md13116977
© 2015 The Authors
Adaptacja: Wiesław Marciniak
Na podstawie licencji CC BY
(http://creativecommons.org/licenses/by/4.0/)
- Schmidt, M.; Johannesdottir, S.A.; Lemeshow, S.; Lash, T.L.; Ulrichsen, S.P.; Botker, H.E.; Toft Sorensen, H. Obesity in young men, and individual and combined risks of type 2 diabetes, cardiovascular morbidity and death before 55 years of age: A Danish 33-year follow-up study. BMJ Open 2013, 3, e002698, doi:10.1136/bmjopen-2013-002698.
- Meyer, C.; Dostou, J.M.; Welle, S.L.; Gerich, J.E. Role of human liver, kidney, and skeletal muscle in postprandial glucose homeostasis. Am. J. Physiol. Endocrinol. Metab. 2002, 282, E419–E427.
- Zhao, X.; Wang, Z.; Zhang, J.; Hua, J.; He, W.; Zhu, S. Estimation of total body skeletal muscle mass in Chinese adults: Prediction model by dual-energy X-ray absorptiometry. PLoS ONE 2013, 8, e53561, doi:10.1371/journal.pone.0053561.
- Kim, J.; Wang, Z.; Heymsfield, S.B.; Baumgartner, R.N.; Gallagher, D. Total-body skeletal muscle mass: Estimation by a new dual-energy X-ray absorptiometry method. Am. J. Clin. Nutr. 2002, 76, 378–383.
- Rosenberg, I.H. Sarcopenia: Origins and clinical relevance. J. Nutr. 1997, 127, 990S–991S.
- Wolfe, R.R. The underappreciated role of muscle in health and disease. Am. J. Clin. Nutr. 2006, 84, 475–482.
- Kyle, U.G.; Genton, L.; Hans, D.; Karsegard, L.; Slosman, D.O.; Pichard, C. Age-related differences in fat-free mass, skeletal muscle, body cell mass and fat mass between 18 and 94 years. Eur. J. Clin. Nutr. 2001, 55, 663–672.
- Roubenoff, R. Sarcopenia: Effects on body composition and function. J. Gerontol. A Biol. Sci.
- Janssen, I.; Shepard, D.S.; Katzmarzyk, P.T.; Roubenoff, R. The healthcare costs of sarcopenia in the United States. J. Am. Geriatr. Soc. 2004, 52, 80–85.
- Smith, G.I.; Julliand, S.; Reeds, D.N.; Sinacore, D.R.; Klein, S.; Mittendorfer, B. Fish oil-derived n-3 PUFA therapy increases muscle mass and function in healthy older adults. Am. J. Clin. Nutr. 2015, 102, 115–122.
- Rodacki, C.L.N.; Rodacki, A.L.F.; Pereira, G.; Naliwaiko, K.; Coelho, I.; Pequito, D.; Fernandes, L.C. Fish-oil supplementation enhances the effects of strength training in elderly women. Am. J. Clin. Nutr. 2012, 95, 428–436.
- Vessby, B.; Uusitupa, M.; Hermansen, K.; Riccardi, G.; Rivellese, A.A.; Tapsell, L.C.; Nälsén, C.; Berglund, L.; Louheranta, A.; Rasmussen, B.M.; et al. Substituting dietary saturated for monounsaturated fat impairs insulin sensitivity in healthy men and women: The KANWU Study. Diabetologia 2001, 44, 312–319.
- Summers, L.K.M.; Fielding, B.A.; Bradshaw, H.A.; Ilic, V.; Beysen, C.; Clark, M.L.; Moore, N.R.; Frayn, K.N. Substituting dietary saturated fat with polyunsaturated fat changes abdominal fat distribution and improves insulin sensitivity. Diabetologia 2002, 45, 369–377.
- Rees, K.; Hartley, L.; Flowers, N.; Clarke, A.; Hooper, L.; Thorogood, M.; Stranges, S. “Mediterranean” dietary pattern for the primary prevention of cardiovascular disease. Cochrane Database Syst. Rev. 2013, 8, CD009825, doi:10.1002/14651858.CD009825.pub2.
- Esposito, K.; Marfella, R.; Ciotola, M.; Di Palo, C.; Giugliano, F.; Giugliano, G.; Giugliano, D. Effect of a mediterranean-style diet on endothelial dysfunction and markers of vascular inflammation in the metabolic syndrome: A randomized trial. JAMA 2004, 292, 1440–1446.
- Ebbesson, S.O.E.; Ebbesson, L.O.E.; Swenson, M.; Kennish, J.M.; Robbins, D.C. A successful diabetes prevention study in Eskimos: The Alaska Siberia project. Int. J. Circumpolar Health 2005, 64, 409–424.
- Bang, H.O.; Dyerberg, J.; Sinclair, H.M. The composition of the Eskimo food in north western Greenland. Am. J. Clin. Nutr. 1980, 33, 2657–2661.
- Siriwardhana, N.; Kalupahana, N.S.; Fletcher, S.; Xin, W.; Claycombe, K.J.; Quignard-Boulange, A.; Moustaid-Moussa, N. n-3 and n-6 polyunsaturated fatty acids differentially regulate adipose angiotensinogen and other inflammatory adipokines in part via NF-κB-dependent mechanisms. J. Nutr. Biochem. 2012, 23, 1661–1667.
- Dimopoulos, N.; Watson, M.; Sakamoto, K.; Hundal, H.S. Differential effects of palmitate and palmitoleate on insulin action and glucose utilization in rat L6 skeletal muscle cells. Biochem. J. 2006, 399, 473–481.
- Burdge, G.C.; Calder, P.C. Introduction to fatty acids and lipids. World Rev. Nutr. Diet. 2015, 112, 1–16.
- Andersson, A.; Nälsén, C.; Tengblad, S.; Vessby, B. Fatty acid composition of skeletal muscle reflects dietary fat composition in humans. Am. J. Clin. Nutr. 2002, 76, 1222–1229.
- Dangardt, F.; Chen, Y.; Gronowitz, E.; Dahlgren, J.; Friberg, P.; Strandvik, B. High physiological omega-3 Fatty Acid supplementation affects muscle Fatty Acid composition and glucose and insulin homeostasis in obese adolescents. J. Nutr. Metab. 2012, 2012, 395757, doi:10.1155/2012/395757.
- McGlory, C.; Galloway, S.D.R.; Hamilton, D.L.; McClintock, C.; Breen, L.; Dick, J.R.; Bell, J.G.; Tipton, K.D. Temporal changes in human skeletal muscle and blood lipid composition with fish oil supplementation. Prostaglandins Leukot. Essent. Fatty Acids 2014, 90, 199–206.
- Glatz, J.F.; Luiken, J.J.; Bonen, A. Membrane fatty acid transporters as regulators of lipid metabolism: Implications for metabolic disease. Physiol. Rev. 2010, 90, 367–417.
- Holloway, G.P.; Bezaire, V.; Heigenhauser, G.J.; Tandon, N.N.; Glatz, J.F.; Luiken, J.J.; Bonen, A.; Spriet, L.L. Mitochondrial long chain fatty acid oxidation, fatty acid translocase/CD36 content and carnitine palmitoyltransferase I activity in human skeletal muscle during aerobic exercise. J. Physiol. 2006, 571 201–210.
- Dyck, D.J.; Peters, S.J.; Glatz, J.; Gorski, J.; Keizer, H.; Kiens, B.; Bonen, A. Functional differences in lipid metabolism in resting skeletal muscle of various fiber types. Am. J. Physiol. 1997, 272, E340–E351.
- Los, D.A.; Murata, N. Membrane fluidity and its roles in the perception of environmental signals. Biochim. Biophys. Acta 2004, 1666, 142–157.
- Holte, L.L.; Peter, S.A.; Sinnwell, T.M.; Gawrisch, K. 2H nuclear magnetic resonance order parameter profiles suggest a change of molecular shape for phosphatidylcholines containing a polyunsaturated acyl chain. Biophys. J. 1995, 68, 2396–2403.
- Stillwell, W.; Wassall, S.R. Docosahexaenoic acid: Membrane properties of a unique fatty acid. Chem. Phys. Lipids 2003, 126, 1–27.
- Stubbs, C.D.; Smith, A.D. Essential fatty acids in membrane: Physical properties and function. Biochem. Soc. Trans. 1990, 18, 779–781.
- Burdge, G.C.; Jones, A.E.; Wootton, S.A. Eicosapentaenoic and docosapentaenoic acids are the principal products of alpha-linolenic acid metabolism in young men*. Br. J. Nutr. 2002, 88, 355–363.
- Burdge, G.C.; Wootton, S.A. Conversion of alpha-linolenic acid to eicosapentaenoic, docosapentaenoic and docosahexaenoic acids in young women. Br. J. Nutr. 2002, 88, 411–420.
- Smink, W.; Gerrits, W.J.J.; Gloaguen, M.; Ruiter, A.; van Baal, J. Linoleic and α-linolenic acid as precursor and inhibitor for the synthesis of long-chain polyunsaturated fatty acids in liver and brain of growing pigs. Animal 2012, 6, 262–270.
- Walker, C.G.; Jebb, S.A.; Calder, P.C. Stearidonic acid as a supplemental source of ω-3 polyunsaturated fatty acids to enhance status for improved human health. Nutrition 2013, 29, 363–369.
- Nording, M.L.; Yang, J.; Georgi, K.; Hegedus Karbowski, C.; German, J.B.; Weiss, R.H.; Hogg, R.J.; Trygg, J.; Hammock, B.D.; Zivkovic, A.M. Individual variation in lipidomic profiles of healthy subjects in response to omega-3 Fatty acids. PLoS ONE 2013, 8, e76575, doi:10.1371/journal.pone.0076575.
- Simopoulos, A.P. Evolutionary aspects of diet, the omega-6/omega-3 ratio and genetic variation: Nutritional implications for chronic diseases. Biomed. Pharmacother. 2006, 60, 502–507.
- Harris, W.S.; Mozaffarian, D.; Lefevre, M.; Toner, C.D.; Colombo, J.; Cunnane, S.C.; Whelan, J. Towards establishing dietary reference intakes for eicosapentaenoic and docosahexaenoic acids. J. Nutr. 2009, 139, 804S–819S.
- Harris, W.S. N-3 fatty acids and serum lipoproteins: Human studies. Am. J. Clin. Nutr. 1997, 65, 1645S–1654S.
- Thifault, E.; Cormier, H.; Bouchard-Mercier, A.; Rudkowska, I.; Paradis, A.-M.; Garneau, V.; Vohl, M.-C. Effects of age, sex, body mass index and APOE genotype on cardiovascular biomarker response to an n-3 polyunsaturated fatty acid supplementation. J. Nutrigenet. Nutrigenomics 2013, 6, 73–82.
- Hooper, L.; Thompson, R.L.; Harrison, R.A.; Summerbell, C.D.; Ness, A.R.; Moore, H.J.; Davey Smith, G. Risks and benefits of omega 3 fats for mortality, cardiovascular disease, and cancer: Systematic review. BMJ 2006, 332, 752–760.
- Rizos, E.C.; Ntzani, E.E.; Bika, E.; Kostapanos, M.S.; Elisaf, M.S. Association between omega-3 fatty acid supplementation and risk of major cardiovascular disease events: A systematic review and meta-analysis. JAMA 2012, 308, 1024–1033.
- Djoussé, L.; Akinkuolie, A.O.; Wu, J.H.Y.; Ding, E.L.; Gaziano, J.M. Fish consumption, omega-3 fatty acids and risk of heart failure: A meta-analysis. Clin. Nutr. 2012, 31, 846–853.
- Marik, P.E.; Varon, J. Omega-3 Dietary Supplements and the Risk of Cardiovascular Events: A Systematic Review. Clin. Cardiol. 2009, 32, 365–372.
- Kang, J.X.; Wang, J.; Wu, L.; Kang, Z.B. Transgenic mice: Fat-1 mice convert n-6 to n-3 fatty acids. Nature 2004, 427, 504, doi:10.1038/427504a.
- Smith, B.K.; Holloway, G.P.; Reza-Lopez, S.; Jeram, S.M.; Kang, J.X.; Ma, D.W.L. A decreased n-6/n-3 ratio in the fat-1 mouse is associated with improved glucose tolerance. Appl. Physiol. Nutr. Metab. 2010, 35, 699–706.
- Romanatto, T.; Fiamoncini, J.; Wang, B.; Curi, R.; Kang, J.X. Elevated tissue omega-3 fatty acid status prevents age-related glucose intolerance in fat-1 transgenic mice. Biochim. Biophys. Acta 2014, 1842, 186–191.
- White, P.J.; Arita, M.; Taguchi, R.; Kang, J.X.; Marette, A. Transgenic restoration of long-chain n-3 fatty acids in insulin target tissues improves resolution capacity and alleviates obesity-linked inflammation and insulin resistance in high-fat-fed mice. Diabetes 2010, 59, 3066–3073.
- Wei, D.; Li, J.; Shen, M.; Jia, W.; Chen, N.; Chen, T.; Zhao, A. Cellular production of n-3 PUFAs and reduction of n-6-to-n-3 ratios in the pancreatic beta-cells and islets enhance insulin secretion and confer protection against cytokine-induced cell death. Diabetes 2010, 59, 471–478.
- Kaur, G.; Cameron-Smith, D.; Garg, M.; Sinclair, A.J. Docosapentaenoic acid (22:5n-3): A review of its biological effects. Prog. Lipid. Res. 2011, 50, 28–34.
- Akiba, S.; Murata, T.; Kitatani, K.; Sato, T. Involvement of lipoxygenase pathway in docosapentaenoic acid-induced inhibition of platelet aggregation. Biol. Pharm. Bull. 2000, 23, 1293–1297.
- Kanayasu-Toyoda, T.; Morita, I.; Murota, S. Docosapentaenoic acid (22:5, n-3), an elongation metabolite of eicosapentaenoic acid (20:5, n-3), is a potent stimulator of endothelial cell migration on pretreatment in vitro. Prostaglandins Leukot. Essent. Fatty Acids 1996, 54, 319–325.
- Norris, P.C.; Dennis, E.A. Omega-3 fatty acids cause dramatic changes in TLR4 and purinergic eicosanoid signaling. Proc. Natl. Acad. Sci. USA 2012, 109, 8517–8522.
- Kamolrat, T.; Gray, S.R. The effect of eicosapentaenoic and docosahexaenoic acid on protein synthesis and breakdown in murine C2C12 myotubes. Biochem. Biophys. Res. Commun. 2013, 432 593–598.
- Blasbalg, T.L.; Hibbeln, J.R.; Ramsden, C.E.; Majchrzak, S.F.; Rawlings, R.R. Changes in consumption of omega-3 and omega-6 fatty acids in the United States during the 20th century. Am. J. Clin. Nutr. 2011, 93, 950–962.
- Schenk, S.; Saberi, M.; Olefsky, J.M. Insulin sensitivity: Modulation by nutrients and inflammation. J. Clin. Investig. 2008, 118, 2992–3002.
- Phillips, S.M.; Tipton, K.D.; Aarsland, A.; Wolf, S.E.; Wolfe, R.R. Mixed muscle protein synthesis and breakdown after resistance exercise in humans. Am. J. Physiol. 1997, 273, E99–E107.
- Bodine, S.C. Disuse-induced muscle wasting. Int. J. Biochem. Cell Biol. 2013, 45, 2200–2208.
- Ryan, A.M.; Reynolds, J.V, Healy, L.; Byrne, M.; Moore, J.; Brannelly, N.; Flood, P. Enteral nutrition enriched with eicosapentaenoic acid (EPA) preserves lean body mass following esophageal cancer surgery: Results of a double-blinded randomized controlled trial. Ann. Surg. 2009, 249, 355–363.
- You, J.-S.; Park, M.-N.; Song, W.; Lee, Y.-S. Dietary fish oil alleviates soleus atrophy during immobilization in association with Akt signaling to p70s6k and E3 ubiquitin ligases in rats. Appl. Physiol. Nutr. Metab. 2010, 35, 310–318.
- Alexander, J.W.; Saito, H.; Trocki, O.; Ogle, C.K. The importance of lipid type in the diet after burn injury. Ann. Surg. 1986, 204, 1–8.
- Tipton, K.D.; Ferrando, A.A.; Phillips, S.M.; Doyle, D.; Wolfe, R.R. Postexercise net protein synthesis in human muscle from orally administered amino acids. Am. J. Physiol. 1999, 276, E628–E634.
- Smith, G.I.; Atherton, P.; Reeds, D.N.; Mohammed, B.S.; Rankin, D.; Rennie, M.J.; Mittendorfer, B. Omega-3 polyunsaturated fatty acids augment the muscle protein anabolic response to hyperinsulinaemia-hyperaminoacidaemia in healthy young and middle-aged men and women. Clin. Sci. (Lond.) 2011, 121, 267–278.
- Smith, G.I.; Atherton, P.; Reeds, D.N.; Mohammed, B.S.; Rankin, D.; Rennie, M.J.; Mittendorfer, B. Dietary omega-3 fatty acid supplementation increases the rate of muscle protein synthesis in older adults: A randomized controlled trial. Am. J. Clin. Nutr. 2011, 93, 402–412.
- Baar, K.; Esser, K. Phosphorylation of p70 (S6k) correlates with increased skeletal muscle mass following resistance exercise. Am. J. Physiol. 1999, 276, C120–C127.
- Drummond, M.J.; Dreyer, H.C.; Fry, C.S.; Glynn, E.L.; Rasmussen, B.B. Nutritional and contractile regulation of human skeletal muscle protein synthesis and mTORC1 signaling. J. Appl. Physiol. (1985) 2009, 106, 1374–1384.
- Huang, F.; Wei, H.; Luo, H.; Jiang, S.; Peng, J. EPA inhibits the inhibitor of κBα (IκBα)/NF-κB/muscle RING finger 1 pathway in C2C12 myotubes in a PPARγ-dependent manner. Br. J. Nutr. 2011, 105, 348–356.
- Magee, P.; Pearson, S.; Allen, J. The omega-3 fatty acid, eicosapentaenoic acid (EPA), prevents the damaging effects of tumour necrosis factor (TNF)-alpha during murine skeletal muscle cell differentiation. Lipids Health Dis. 2008, 7, 24, doi:10.1186/1476-511X-7-24.
- Magee, P.; Pearson, S.; Whittingham-Dowd, J.; Allen, J. PPARγ as a molecular target of EPA anti-inflammatory activity during TNF-α-impaired skeletal muscle cell differentiation. J. Nutr. Biochem. 2012, 23, 1440–1448.
- Kubota, H.; Matsumoto, H.; Higashida, M.; Murakami, H.; Nakashima, H.; Oka, Y.; Hirai, T. Eicosapentaenoic acid modifies cytokine activity and inhibits cell proliferation in an oesophageal cancer cell line. Anticancer Res. 2013, 33, 4319–4324.
- Li, H.; Malhotra, S.; Kumar, A. Nuclear factor-kappa B signaling in skeletal muscle atrophy. J. Mol. Med. (Berl.) 2008, 86, 1113–1126.
- Bodine, S.C.; Latres, E.; Baumhueter, S.; Lai, V.K.; Nunez, L.; Clarke, B.A.; Glass, D.J. Identification of ubiquitin ligases required for skeletal muscle atrophy. Science 2001, 294, 1704–1708.
- Baehr, L.M.; Furlow, J.D.; Bodine, S.C. Muscle sparing in muscle RING finger 1 null mice: Response to synthetic glucocorticoids. J. Physiol. 2011, 589, 4759–4776.
- Whitehouse, A.S.; Tisdale, M.J. Downregulation of ubiquitin-dependent proteolysis by eicosapentaenoic acid in acute starvation. Biochem. Biophys. Res. Commun. 2001, 285, 598–602.
- Wang, Y.; Lin, Q.; Zheng, P.; Zhang, J.; Huang, F. DHA inhibits protein degradation more efficiently than EPA by regulating the PPARγ/NFκB pathway in C2C12 myotubes. Biomed Res. Int. 2013, 2013, doi:10.1155/2013/318981.
- Patten, G.S.; Abeywardena, M.Y.; McMurchie, E.J.; Jahangiri, A. Dietary fish oil increases acetylcholine – and eicosanoid-induced contractility of isolated rat ileum. J. Nutr. 2002, 132, 2506–2513.
- Piasecki, M.; Ireland, A.; Stashuk, D.; Hamilton-Wright, A.; Jones, D.A.; McPhee, J.S. Age-related neuromuscular changes affecting human vastus lateralis. J. Physiol. 2015, doi:10.1113/JP271087.
- You, J.-S.; Park, M.-N.; Lee, Y.-S. Dietary fish oil inhibits the early stage of recovery of atrophied soleus muscle in rats via Akt-p70s6k signaling and PGF2α. J. Nutr. Biochem. 2010, 21, 929–934.
- Trappe, T.A.; Fluckey, J.D.; White, F.; Lambert, C.P.; Evans, W.J. Skeletal muscle PGF (2) (alpha) and PGE (2) in response to eccentric resistance exercise: Influence of ibuprofen acetaminophen. J. Clin. Endocrinol. Metab. 2001, 86, 5067–5070.
- Trappe, T.A.; White, F.; Lambert, C.P.; Cesar, D.; Hellerstein, M.; Evans, W.J. Effect of ibuprofen and acetaminophen on postexercise muscle protein synthesis. Am. J. Physiol. Endocrinol. Metab. 2002, 282, E551–E556.
- Cuthbertson, D.; Smith, K.; Babraj, J.; Leese, G.; Waddell, T.; Atherton, P.; Wackerhage, H; Taylor, P.M.; Rennie, M.J. Anabolic signaling deficits underlie amino acid resistance of wasting, aging muscle. FASEB J. 2005, 19, 422–424.
- Kamolrat, T.; Gray, S.R.; Thivierge, M.C. Fish oil positively regulates anabolic signalling alongside an increase in whole-body gluconeogenesis in ageing skeletal muscle. Eur. J. Nutr. 2013, 52, 647–657.
- Gingra, A.A.; White, P.J.; Chouinard, P.Y.; Julien, P.; Davis, T.A.; Dombrowski, L.; Couture, Y.; Dubreuil, P.; Myre, A.; Bergeron, K.; et al. Long-chain omega-3 fatty acids regulate bovine whole-body protein metabolism by promoting muscle insulin signalling to the Akt-mTOR-S6K1 pathway and insulin sensitivity. J. Physiol. 2007, 579, 269–284.
- Phillips, B.E.; Hill, D.S.; Atherton, P.J. Regulation of muscle protein synthesis in humans. Curr. Opin. Clin. Nutr. Metab. Care 2012, 15, 58–63.
- Corpeleijn, E.; Mensink, M.; Kooi, M.E.; Roekaerts, P.M.H.J.; Saris, W.H.M.; Blaak, E.E. Impaired skeletal muscle substrate oxidation in glucose-intolerant men improves after weight loss. Obesity (Silver Spring) 2008, 16, 1025–1032.
- 85. Blaak, E.E.; Wagenmakers, A.J.; Glatz, J.F.; Wolffenbuttel, B.H.; Kemerink, G.J.; Langenberg, C.J.; Heidendal, G.A.; Saris, W.H. Plasma FFA utilization and fatty acid-binding protein content are diminished in type 2 diabetic muscle. Am. J. Physiol. Endocrinol. Metab. 2000, 279, E146–E154.
- Kelley, D.E.; He, J.; Menshikova, E.V.; Ritov, V.B. Dysfunction of mitochondria in human skeletal muscle in type 2 diabetes. Diabetes 2002, 51, 2944–2950.
- Simoneau, J.-A.; Veerkamp, J.H.; Turcotte, L.P.; Kelley, D.E. Markers of capacity to utilize fatty acids in human skeletal muscle: Relation to insulin resistance and obesity and effects of weight loss. FASEB J. 1999, 13, 2051–2060.
- Hessvik, N.P.; Bakke, S.S.; Fredriksson, K.; Boekschoten, M.V, Fjørkenstad, A.; Koster, G.; Thoresen, G.H. Metabolic switching of human myotubes is improved by n-3 fatty acids. J. Lipid. Res. 2010, 51, 2090–2104.
- Delarue, J.; Couet, C.; Cohen, R.; Bréchot, J.F.; Antoine, J.M.; Lamisse, F. Effects of fish oil on metabolic responses to oral fructose and glucose loads in healthy humans. Am. J. Physiol. 1996, 270, E353–E362.
- Delarue, J.; Labarthe, F.; Cohen, R. Fish-oil supplementation reduces stimulation of plasma glucose fluxes during exercise in untrained males. Br. J. Nutr. 2003, 90, 777–786.
- Bradley, N.S.; Heigenhauser, G.J.F.; Roy, B.D.; Staples, E.M.; Inglis, J.G.; LeBlanc, P.J.; Peters, S.J. The acute effects of differential dietary fatty acids on human skeletal muscle pyruvate dehydrogenase activity. J. Appl. Physiol. (1985) 2008, 104, 1–9.
- Mostad, I.L.; Bjerve, K.S.; Bjorgaas, M.R.; Lydersen, S.; Grill, V. Effects of n-3 fatty acids in subjects with type 2 diabetes: Reduction of insulin sensitivity and time-dependent alteration from carbohydrate to fat oxidation. Am. J. Clin. Nutr. 2006, 84, 540–550.
- Figueras, M.; Olivan, M.; Busquets, S.; López-Soriano, F.J.; Argilés, J.M. Effects of eicosapentaenoic acid (EPA) treatment on insulin sensitivity in an animal model of diabetes: Improvement of the inflammatory status. Obesity (Silver Spring) 2011, 19, 362–369.
- Vaughan, R.A.; Garcia-Smith, R.; Bisoffi, M.; Conn, C.A.; Trujillo, K.A. Conjugated linoleic acid or omega 3 fatty acids increase mitochondrial biosynthesis and metabolism in skeletal muscle cells. Lipids Health Dis. 2012, 11, 142, doi:10.1186/1476-511X-11-142.
- Patti, M.E.; Butte, A.J.; Crunkhorn, S.; Cusi, K.; Berria, R.; Kashyap, S.; Miyazaki, Y.; Kohane, I.; Costello, M.; Saccone, R.; et al. Coordinated reduction of genes of oxidative metabolism in humans with insulin resistance and diabetes: Potential role of PGC1 and NRF1. Proc. Natl. Acad. Sci. USA 2003, 100, 8466–8471.
- Hancock, C.R.; Han, D.-H.; Chen, M.; Terada, S.; Yasuda, T.; Wright, D.C.; Holloszy, J.O. High-fat diets cause insulin resistance despite an increase in muscle mitochondria. Proc. Natl. Acad. Sci. USA 2008, 105, 7815–7820.
- Turner, N.; Bruce, C.R.; Beale, S.M.; Hoehn, K.L.; So, T.; Rolph, M.S.; Cooney, G.J. Excess lipid availability increases mitochondrial fatty acid oxidative capacity in muscle: Evidence against a role for reduced fatty acid oxidation in lipid-induced insulin resistance in rodents. Diabetes 2007, 56, 2085–2092.
- Trenell, M.I.; Hollingsworth, K.G.; Lim, E.L.; Taylor, R. Increased daily walking improves lipid oxidation without changes in mitochondrial function in type 2 diabetes. Diabetes Care 2008, 31, 1644–1649.
- Van Tienen, F.H.; Praet, S.F.; de Feyter, H.M.; van den Broek, N.M.; Lindsey, P.J.; Schoonderwoerd, K.G.; de Coo, I.F.; Nicolay, K.; Prompers, J.J.; Smeets, H.J.; et al. Physical activity is the key determinant of skeletal muscle mitochondrial function in type 2 diabetes. J. Clin. Endocrinol. Metab. 2012, 97, 3261–3269.
- Lanza, I.R.; Blachnio-Zabielska, A.; Zabielski, P.; Nair, K.S.; Jensen, M.; Lebrasseur, N. Influence of fish oil on skeletal muscle mitochondrial energetics and lipid metabolites during high-fat diet. Am. J. Physiol. Endocrinol. Metab. 2013, 304, E1391–E1403. 101. Jeng, J.-Y.; Lee, W.-H.; Tsai, Y.-H.; Chen, C.-Y.; Chao, S.-Y.; Hsieh, R.-H. Functional modulation of mitochondria by eicosapentaenoic acid provides protection against ceramide toxicity to C6 glioma cells. J. Agric. Food Chem. 2009, 57, 11455–11462.
- Herbst, E.A.F.; Paglialunga, S.; Gerling, C.; Whitfield, J.; Mukai, K.; Chabowski, A.; Holloway, G.P. Omega-3 supplementation alters mitochondrial membrane composition and respiration kinetics in human skeletal muscle. J. Physiol. 2014, 592, 1341–1352.
- Lalia, A.Z.; Johnson, M.L.; Jensen, M.D.; Hames, K.C.; Port, J.D.; Lanza, I.R. Effects of dietaryn-3 fatty acids on hepatic and peripheral insulin sensitivity in insulin resistant humans. Diabetes Care 2015, 38, 1228–1237.
- Johnson, M.L.; Lalia, A.Z.; Dasari, S.; Pallauf, M.; Fitch, M.; Hellerstein, M.K.; Lanza, I.R. Eicosapentaenoic acid but not docosahexaenoic acid restores skeletal muscle mitochondrial oxidative capacity in old mice. Aging Cell 2015, 14, 7343.
- Matravadia, S.; Herbst, E.A.F.; Jain, S.S.; Mutch, D.M.; Holloway G.P. Both linoleic and α-linolenic acid prevent insulin resistance but have divergent impacts on skeletal muscle mitochondrial bioenergetics in obese Zucker rats. Am. J. Physiol. Endocrinol. Metab. 2014, 307 E102–E114.
- Thiebaud, D.; Jacot, E.; DeFronzo, R.A.; Maeder, E.; Jequier, E.; Felber, J.P. The effect of graded doses of insulin on total glucose uptake, glucose oxidation, and glucose storage in man. Diabetes 1982, 31, 957–963.
- Zierath, J.R.; Krook, A.; Wallberg-Henriksson, H. Insulin action and insulin resistance in human skeletal muscle. Diabetologia 2000, 43, 821–835.
- Damsbo, P.; Vaag, A.; Hother-Nielsen, O.; Beck-Nielsen, H. Reduced glycogen synthase activity in skeletal muscle from obese patients with and without type 2 (non-insulin-dependent) diabetes mellitus. Diabetologia 1991, 34, 239–245.
- Cline, G.W.; Petersen, K.F.; Krssak, M.; Shen, J.; Hundal, R.S.; Trajanoski, Z.; Inzucchi, S.; Dresner, A.; Rothman, D.L.; Shulman, G.I. Impaired glucose transport as a cause of decreased insulin-stimulated muscle glycogen synthesis in type 2 diabetes. N. Engl. J. Med. 1999, 341, 240–246.
- Turner, N.; Kowalski, G.M.; Leslie, S.J.; Risis, S.; Yang, C.; Lee-Young, R.S.; Bruce, C.R. Distinct patterns of tissue-specific lipid accumulation during the induction of insulin resistance in mice by high-fat feeding. Diabetologia 2013, 56, 1638–1648.
- Roden, M.; Stingl, H.; Chandramouli, V.; Schumann, W.C.; Hofer, A.; Landau, B.R.; Nowotny, P.; Waldhäusl, W.; Shulman, G.I. Effects of free fatty acid elevation on postabsorptive endogenous glucose production and gluconeogenesis in humans. Diabetes 2000, 49, 701–707.
- Boden, G. Free fatty acids, insulin resistance, and type 2 diabetes mellitus. Proc. Assoc. Am. Physicians. 1991, 111, 241–248.
- Szendroedi, J.; Yoshimura, T.; Phielix, E.; Koliaki, C.; Marcucci, M.; Zhang, D.; Roden, M. Role of diacylglycerol activation of PKCθ in lipid-induced muscle insulin resistance in humans. Proc. Natl. Acad. Sci. USA 2014, 111, 9597–9602.
- Stratford, S.; DeWald, D.B.; Summers, S.A. Ceramide dissociates 3′-phosphoinositide production from pleckstrin homology domain translocation. Biochem. J. 2001, 354, 359–368.
- Ellis, B.A.; Poynten, A.; Lowy, A.J.; Furler, S.M.; Chisholm, D.J.; Kraegen, E.W.; Cooney, G.J. Long-chain acyl-CoA esters as indicators of lipid metabolism and insulin sensitivity in rat and human muscle. Am. J. Physiol. Endocrinol. Metab. 2000, 279, E554–E560.
- Itani, S.I.; Ruderman, N.B.; Schmieder, F.; Boden, G. Lipid-induced insulin resistance in human muscle is associated with changes in diacylglycerol, protein kinase C, and IkappaB-alpha. Diabetes 2002, 51, 2005–2011.
- Yu, C.; Chen, Y.; Cline, G. W.; Zhang, D.; Zong, H.; Wang, Y.; Shulman, G.I. Mechanism by which fatty acids inhibit insulin activation of insulin receptor substrate-1 (IRS-1)-associated phosphatidylinositol 3-kinase activity in muscle. J. Biol. Chem. 2002, 277, 50230–50236.
- Chavez, J.A.; Knotts, T.A.; Wang, L.-P.; Li, G.; Dobrowsky, R.T.; Florant, G.L.; Summers, S.A. A role for ceramide, but not diacylglycerol, in the antagonism of insulin signal transduction by saturated fatty acids. J. Biol. Chem. 2003, 278, 10297–10303.
- Powell, D.J.; Turban, S.; Gray, A.; Hajduch, E.; Hundal, H.S. Intracellular ceramide synthesis and protein kinase Czeta activation play an essential role in palmitate-induced insulin resistance in rat L6 skeletal muscle cells. Biochem. J. 2004, 382, 619–629
- Stretton, C.; Evans, A.; Hundal, H.S. Cellular depletion of atypical PKCλ is associated with enhanced insulin sensitivity and glucose uptake in L6 rat skeletal muscle cells. Am. J. Physiol. Endocrinol. Metab. 2010, 299, E402–E412.
- Pedersen, O.; Bak, J.F.; Andersen, P.H.; Lund, S.; Moller, D.E.; Flier, J.S.; Kahn, B.B. Evidence against altered expression of GLUT1 or GLUT4 in skeletal muscle of patients with obesity or NIDDM. Diabetes 1990, 39, 865–870.
- Ryder, J.W.; Yang, J.; Galuska, D.; Rincón, J.; Björnholm, M.; Krook, A.; Holman, G.D. Use of a novel impermeable biotinylated photolabeling reagent to assess insulin – and hypoxia-stimulated cell surface GLUT4 content in skeletal muscle from type 2 diabetic patients. Diabetes 2000, 49, 647–654.
- Wu, J.H.Y.; Micha, R.; Imamura, F.; Pan, A.; Biggs, M.L.; Ajaz, O.; Mozaffarian, D. Omega-3 fatty acids and incident type 2 diabetes: A systematic review and meta-analysis. Br. J. Nutr. 2012, 107, S214–S227.
- Akinkuolie, A.O.; Ngwa, J.S.; Meigs, J.B.; Djoussé, L. Omega-3 polyunsaturated fatty acid and insulin
sensitivity: A meta-analysis of randomized controlled trials. Clin. Nutr. 2011, 30, 702–707. - Hartweg, J.; Perera, R.; Montori, V.; Dinneen, S.; Neil, H.A.W.; Farmer, A. Omega-3 polyunsaturated fatty acids (PUFA) for type 2 diabetes mellitus. Cochrane Database Syst. Rev. 2008, CD003205, doi:10.1002/14651858.CD003205.pub2.
- Albert, B.B.; Derraik, J.G.; Brennan, C.M.; Biggs, J.B.; Smith, G.C.; Garg, M.L.; Cameron-Smith, D.; Hofman, P.L.; Cutfield, W.S. Higher omega-3 index is associated with increased insulin sensitivity and more favourable metabolic profile in middle-aged overweight men. Sci. Rep. 2014, 4, 6697, doi:10.1038/srep06697.
- Delarue, J.; Li, C.-H.; Cohen, R.; Corporeau, C.; Simon, B. Interaction of fish oil and a glucocorticoid on metabolic responses to an oral glucose load in healthy human subjects. Br. J. Nutr. 2006, 95, 267–272.
- Popp-Snijders, C.; Schouten, J.A.; Heine, R.J.; van der Meer, J.; van der Veen, E.A. Dietary supplementation of omega-3 polyunsaturated fatty acids improves insulin sensitivity in non-insulin-dependent diabetes. Diabetes Res. 1987, 4, 141–147.
- Fasching, P.; Ratheiser, K.; Waldhäusl, W.; Rohac, M.; Osterrode, W.; Nowotny, P.; Vierhapper, H. Metabolic effects of fish-oil supplementation in patients with impaired glucose tolerance. Diabetes 1991, 40, 583–589.
- Glauber, H.; Wallace, P.; Griver, K.; Brechtel, G. Adverse metabolic effect of omega-3 fatty acids in non-insulin-dependent diabetes mellitus. Ann. Intern. Med. 1988, 108, 663–668.
- Stephens, F.B.; Mendis, B.; Shannon, C.E.; Cooper, S.; Ortori, C.A.; Barrett, D.A.; Mansell, P.; Tsintzas, K. Fish oil omega-3 fatty acids partially prevent lipid-induced insulin resistance in human skeletal muscle without limiting acylcarnitine accumulation. Clin. Sci. (Lond.) 2014, 127, 315–322.
- Aas, V.; Rokling-Andersen.; M.H.; Kase, E.T.; Thoresen, G.H.; Rustan, A.C. Eicosapentaenoic acid (20:5 n-3) increases fatty acid and glucose uptake in cultured human skeletal muscle cells. J. Lipid. Res. 2005, 47, 366–374.
- Wensaas, A.J.; Rustan, A.C.; Just, M.; Berge, R.K.; Drevon, C.A.; Gaster, M. Fatty acid incubation of myotubes from humans with type 2 diabetes leads to enhanced release of oxidation products because of impaired fatty acid oxidation: Effects of tetradecylthioacetic acid and eicosapentaenoic acid. Diabetes 2008, 58, 527–535.
- Barber, E.; Sinclair, A.J.; Cameron-Smith, D. Comparative actions of omega-3 fatty acids on in-vitro lipid droplet formation. Prostaglandins Leukot. Essent. Fatty Acids 2013, 89, 359–366.
- Listenberger, L.L.; Han, X.; Lewis, S.E.; Cases, S.; Farese, R.V, Ory, D.S.; Schaffer, J.E. Triglyceride accumulation protects against fatty acid-induced lipotoxicity. Proc. Natl. Acad. Sci. USA 2003, 100, 3077–3082.
- 136. Bosma, M.; Hesselink, M.K.C.; Sparks, L.M.; Timmers, S.; Ferraz, M.J.; Mattijssen, F.; Schrauwen, P. Perilipin 2 improves insulin sensitivity in skeletal muscle despite elevated intramuscular lipid levels. Diabetes 2012, 61, 2679–2690.
- Le Foll, C.; Corporeau, C.; Le Guen, V.; Gouygou, J.-P.; Bergé, J.-P.; Delarue, J. Long-chain n-3 polyunsaturated fatty acids dissociate phosphorylation of Akt from phosphatidylinositol 3’-kinase activity in rats. Am. J. Physiol. Endocrinol. Metab. 2007, 292, E1223–E1230.
- Capel, F.; Acquaviva, C.; Pitois, E.; Laillet, B.; Rigaudière, J.-P.; Jouve, C.; Morio, B. DHA at nutritional doses restores insulin sensitivity in skeletal muscle by preventing lipotoxicity and inflammation. J. Nutr. Biochem. 2015, 26, 949–959.
- Zisman, A.; Peroni, O.D.; Abel, E.D.; Michael, M.D.; Mauvais-Jarvis, F.; Lowell, B.B.; Wojtaszewski, J.F.; Hirshman, M.F.; Virkamaki, A.; Goodyear, L.J.; et al. Targeted disruption of the glucose transporter 4 selectively in muscle causes insulin resistance and glucose intolerance. Nat. Med. 2000, 6, 924–928.
- Aguirre, V.; Uchida, T.; Yenush, L.; Davis, R.; White, M.F. The c-Jun NH2-terminal kinase promotes insulin resistance during association with insulin receptor substrate-1 and phosphorylation of Ser307. J. Biol. Chem. 2000, 275, 9047–9054.
- Oh, D.Y.; Talukdar, S.; Bae, E.J.; Imamura, T.; Morinaga, H.; Fan, W.; Olefsky, J.M. GPR120 is an omega-3 fatty acid receptor mediating potent anti-inflammatory and insulin-sensitizing effects. Cell 2010, 142, 687–698.
- Jelenik, T.; Rossmeisl, M.; Kuda, O.; Jilkova, Z.M.; Medrikova, D.; Kus, V.; Hensler, M.; Janovska, P.; Miksik, I.; Baranowski, M.; et al. AMP-activated protein kinase α2 subunit is required for the preservation of hepatic insulin sensitivity by n-3 polyunsaturated fatty acids. Diabetes 2010, 59, 2737–2746.
- Arkan, M.C.; Hevener, A.L.; Greten, F.R.; Maeda, S.; Li, Z.-W.; Long, J.M.; Karin, M. IKK-beta links inflammation to obesity-induced insulin resistance. Nat. Med. 2005, 11, 191–198.
- Calder, P.C. Omega-3 fatty acids and inflammatory processes. Nutrients 2010, 2, 355–374.
- Calder, P.C. Marine omega-3 fatty acids and inflammatory processes: Effects, mechanisms and clinical relevance. Biochim. Biophys. Acta 2014, 1851, 469–484.
- Gregory, M.K.; Gibson, R.A.; Cook-Johnson, R.J.; Cleland, L.G.; James, M.J. Elongase reactions as control points in long-chain polyunsaturated fatty acid synthesis. PLoS ONE 2011, 6, e29662, doi:10.1371/ journal.pone.0029662.
- Lee, T.H.; Hoover, R.L.; Williams, J.D.; Sperling, R.I.; Ravalese, J.; Spur, B.W.; Austen, K.F. Effect of dietary enrichment with eicosapentaenoic and docosahexaenoic acids on in vitro neutrophil and monocyte leukotriene generation and neutrophil function. N. Engl. J. Med. 1985, 312, 1217–1224.
- Rees, D.; Miles, E.A.; Banerjee, T.; Wells, S.J.; Roynette, C.E.; Wahle, K.W.; Calder, P.C. Dose-related effects of eicosapentaenoic acid on innate immune function in healthy humans: A comparison of young and older men. Am. J. Clin. Nutr. 2006, 83, 331–342.
- Wada, M.; DeLong, C.J.; Hong, Y.H.; Rieke, C.J.; Song, I.; Sidhu, R.S.; Yuan, C.; Warnock, M.; Schmaier, A.H.; Yokoyama, C.; et al. Enzymes and receptors of prostaglandin pathways with arachidonic acid-derived versus eicosapentaenoic acid-derived substrates and products. J. Biol. Chem. 2007, 282, 22254–22266.
- Mas, E.; Croft, K.D.; Zahra, P.; Barden, A.; Mori, T.A. Resolvins D1, D2, and other mediators of self-limited resolution of inflammation in human blood following n-3 fatty acid supplementation. Clin Chem. 2012, 58, 1476–1484.
- Bannenberg, G.; Serhan, C.N. Specialized pro-resolving lipid mediators in the inflammatory response: An update. Biochim. Biophys. Acta 2010, 1801, 1260–1273.
- Skarke, C.; Alamuddin, N.; Lawson, J.A.; Ferguson, J.F.; Reilly, M.P.; FitzGerald, G.A. Bioactive products formed in humans from fish oils. J. Lipid Res. 2015, 56, 1808–1820.
- Camandola, S.; Leonarduzzi, G.; Musso, T.; Varesio, L.; Carini, R.; Scavazza, A.; Poli, G. Nuclear factor kB is activated by arachidonic acid but not by eicosapentaenoic acid. Biochem. Biophys. Res. Commun. 1996, 229, 643–647.
- Vanden Berghe, W.; Vermeulen, L.; Delerive, P.; De Bosscher, K.; Staels, B.; Haegeman, G. A paradigm for gene regulation: Inflammation, NF-kappaB and PPAR. Adv. Exp. Med. Biol. 2003, 544, 181–196.
- Shakhov, A.N.; Collart, M.A.; Vassalli, P.; Nedospasov, S.A.; Jongeneel, C.V. Kappa B-type enhancers are involved in lipopolysaccharide-mediated transcriptional activation of the tumor necrosis factor alpha gene in primary macrophages. J. Exp. Med. 1990, 171, 35–47.
- Mehra, M.R.; Lavie, C.J.; Ventura, H.O.; Milani, R.V. Fish oils produce anti-inflammatory effects and improve body weight in severe heart failure. J. Heart Lung Transplant. 2006, 25, 834–838.
- Kumar, A.; Takada, Y.; Boriek, A.M.; Aggarwal, B.B. Nuclear factor-kappaB: Its role in health and disease. J. Mol. Med. (Berl.) 2004, 82, 434–448.
- Pillon, N.J.; Arane, K.; Bilan, P.J.; Chiu, T.T.; Klip, A. Muscle cells challenged with saturated fatty acids mount an autonomous inflammatory response that activates macrophages. Cell Commun. Signal. 2012, 10, 30, doi:10.1186/1478-811X-10-30.
- Uysal, K.T.; Wiesbrock, S.M.; Marino, M.W.; Hotamisligil, G.S. Protection from obesity-induced insulin resistance in mice lacking TNF-alpha function. Nature 1997, 389, 610–614.
- Hotamisligil, G.; Shargill, N.; Spiegelman, B. Adipose expression of tumor necrosis factor-alpha: Direct role in obesity-linked insulin resistance. Science 1993, 259, 87–91.
- Reinders, I.; Virtanen, J.K.; Brouwer, I.A.; Tuomainen, T.-P. Association of serum n-3 polyunsaturated fatty acids with C-reactive protein in men. Eur. J. Clin. Nutr. 2012, 66, 736–741.
- Niu, K.; Hozawa, A.; Kuriyama, S.; Ohmori-Matsuda, K.; Shimazu, T.; Nakaya, N.; Fujita, K.; Tsuji, I.; Nagatomi, R. Dietary long-chain n-3 fatty acids of marine origin and serum C-reactive protein concentrations are associated in a population with a diet rich in marine products. Am. J. Clin. Nutr. 2006, 84, 223–229.
- Thies, F.; Nebe-von-Caron, G.; Powell, J.R.; Yaqoob, P.; Newsholme, E.A.; Calder, P.C. Dietary supplementation with gamma-linolenic acid or fish oil decreases T lymphocyte proliferation in healthy older humans. J. Nutr. 2001, 131, 1918–1927.
- Varming, K.; Schmidt, E.B.; Svaneborg, N.; Møller, J.M.; Lervang, H.H.; Grunnet, N.; Dyerberg, J. The effect of n-3 fatty acids on neutrophil chemiluminescence. Scand. J. Clin. Lab. Investig. 1995, 55, 47–52.
- Trebble, T.M.; Wootton, S.A.; Miles, E.A.; Mullee, M.; Arden, N.K.; Ballinger, A.B.; Calder, P.C. Prostaglandin E2 production and T cell function after fish-oil supplementation: Response to antioxidant cosupplementation. Am. J. Clin. Nutr. 2003, 78, 376–382.
- Itariu, B.K.; Zeyda, M.; Hochbrugger, E.E.; Neuhofer, A.; Prager, G.; Schindler, K.; Bohdjalian, A.; Mascher, D.; Vangala, S.; Schranz, M.; et al. Long-chain n-3 PUFAs reduce adipose tissue and systemic inflammation in severely obese nondiabetic patients: A randomized controlled trial. Am. J. Clin. Nutr. 2012, 96, 1137–1149.
- Kratz, M.; Kuzma, J.N.; Hagman, D.K.; van Yserloo, B.; Matthys, C.C.; Callahan, H.S.; Weigle, D.S. n3 PUFAs do not affect adipose tissue inflammation in overweight to moderately obese men and women. J. Nutr. 2013, 143, 1340–1347.
- Gray, P.; Gabriel, B.; Thies, F.; Gray, S.R. Fish oil supplementation augments post-exercise immune function in young males. Brain Behav. Immun. 2012, 26, 1265–1272.
- Rossmeisl, M.; Jilkova, Z.M.; Kuda, O.; Jelenik, T.; Medrikova, D.; Stankova, B.; Kristinsson, B.; Haraldsson, G.G.; Svensen, H.; Stoknes, I.; et al. Metabolic effects of n-3 PUFA as phospholipids are superior to triglycerides in mice fed a high-fat diet: Possible role of endocannabinoids. PLoS ONE 2012, 7, e38834, doi:10.1371/journal.pone.0038834.
- Borkman, M.; Storlien, L.H.; Pan, D.A.; Jenkins, A.B.; Chisholm, D.J.; Campbell, L.V. The relation between insulin sensitivity and the fatty-acid composition of skeletal-muscle phospholipids. N. Engl. J. Med. 1993, 328, 238–244.
- Shaikh, S.R.; Rockett, B.D.; Salameh, M.; Carraway, K. Docosahexaenoic acid modifies the clustering and size of lipid rafts and the lateral organization and surface expression of MHC class I of EL4 cells. J. Nutr. 2009, 139, 1632–1639.
- Lingwood, D.; Simons, K. Lipid rafts as a membrane-organizing principle. Science 2010, 327, 46–50.
- Altenburg, J.D.; Siddiqui, R.A. Omega-3 polyunsaturated fatty acids down-modulate CXCR4 expression and function in MDA-MB-231 breast cancer cells. Mol. Cancer Res. 2009, 7, 1013–1020.
- Williams, J.A.; Batten, S.E.; Harris, M.; Rockett, B.D.; Shaikh, S.R.; Stillwell, W.; Wassall, S.R. Docosahexaenoic and eicosapentaenoic acids segregate differently between raft and nonraft domains. Biophys. J. 2012, 103, 228–237.
- Kang, J.X. Omega-3: A link between global climate change and human health. Biotechnol. Adv. 2011, 29, 388–390.
© 2015 by the authors; licensee MDPI, Basel, Switzerland. This article is an open access article distributed under the terms and conditions of the Creative Commons Attribution license (http://creativecommons.org/ licenses/by/4.0/).