Rehabilitacja po urazowym uszkodzeniu mózgu - wprowadzenie
Określenie "urazowe uszkodzenie mózgu" odnosi się do tępego, przenikającego lub spowodowanego siłą przyspieszenia/hamowania urazu w obrębie mózgoczaszki, który powoduje takie objawy jak pogorszenie sprawności na poziomie świadomości czy też zdolności postrzegania, zaniki pamięci lub zapominanie, inne nieprawidłowości neurologiczne lub neuropsychologiczne, a nawet zgon. Na całym świecie stanowi to poważny problem zdrowotny i socjoekonomiczny.
Częstość występowania urazowego uszkodzenia mózgu rośnie z każdym rokiem. Według oceny Światowej Organizacji Zdrowia z 2007 r., schorzenie to miało być znaczącym problemem i główną przyczyną niepełnosprawności w 2020 r.1. Pierwotne i wtórne urazowe uszkodzenie mózgu powoduje czasową lub trwałą dysfunkcję tego narządu, która ogranicza aktywność pacjentów, wpływa na ich udział w życiu społecznym i obniża jakość życia. Może to prowadzić do wystąpienia u nich depresji i innych chorób przewlekłych2,3. Artykuł ten stanowi przegląd obecnie stosowanych metod rehabilitacyjnego leczenia urazowego uszkodzenia mózgu.
Tlenoterapia hiperbaryczna łagodzi skutki urazowego uszkodzenia mózgu
Tlenoterapia hiperbaryczna obejmuje wdychanie gazu o stężeniu tlenu na poziomie 100 proc. pod ciśnieniem wyższym niż 1 atmosfera absolutna (ang. atmosphere absolute, ATA) (1 ATA = 101,3 kPa). Ta forma leczenia jest obecnie przedmiotem żywego zainteresowania w neurologii. Jak bowiem udowodniono, hamuje ona apoptozę, tłumi stan zapalny, chroni integralność bariery krew–mózg oraz wspiera angiogenezę i neurogenezę4,5.
Główne mechanizmy patogeniczne w przebiegu urazowego uszkodzenia mózgu obejmują niedokrwienie i niedotlenienie tkanek mózgowych, co skutkuje zmiękczeniem miąższu i martwicą. Obecnie leczenie tlenem w hiperbarii to jedna z najważniejszych terapii klinicznych tego schorzenia.
Badanie Lina i in.6 wykazało, że podawanie tego gazu pod ciśnieniem 2 atmosfer absolutnych przez pięć kolejnych dni (godzinne sesje odbywały się raz dziennie) spowodowało nadekspresję białka szoku cieplnego (HSP-70) o masie 70 kDa, złagodzenie obrzęku mózgu, zmniejszenie uszkodzenia oksydacyjnego hipokampu i obniżenia funkcji poznawczych. Badanie przeprowadzono w modelu szczurzym, w sztucznym środowisku na dużych wysokościach (stężenie tlenu: 9,7%, wysokość: 6000 m, 0,47 ATA) przez trzy kolejne dni.
Z kolei Harch i in.7 przez 30 dni leczyli 16 pacjentów z urazowym uszkodzeniem mózgu, cerebrastenią pourazową i zespołem stresu pourazowego za pomocą 40 sesji terapii hiperbarycznej (1,5 ATA przez godzinę). Dzięki temu uzyskali znaczne złagodzenie objawów, dużą poprawę wyników badań neurologicznych, kompleksowych testów IQ oraz funkcji poznawczych. Badanie przeprowadzone przez Genga i in. wykazało zaś, że tlenoterapia hiperbaryczna może powstrzymywać aktywację sygnałów zapalnych, łagodząc tym samym skutki urazowego uszkodzenia mózgu8.
W przypadkach przewlekłego uszkodzenia mózgu tlenoterapia hiperbaryczna poprawiła dopływ krwi do tego narządu i złagodziła zaburzenia neuropsychologiczne9,10. Zgłoszono również, że przynosi ona pozytywne rezultaty, jeśli chodzi o polepszenie jakości życia pacjentów z zespołem powstrząśnieniowym lub łagodnym urazowym uszkodzeniem mózgu na późnym etapie przewlekłym7,11,12. W ciężkich przypadkach urazowego uszkodzenia mózgu tlenoterapia hiperbaryczna zmniejsza śmiertelność i poprawia funkcjonowanie chorych13-15. Badania te sugerowały skuteczne zastosowanie intensywnej formy tej terapii w leczeniu pacjentów z urazowym uszkodzeniem mózgu.
Nieinwazyjna stymulacja mózgu przynosi korzyści w leczeniu pacjentów z urazowym uszkodzeniem mózgu
Do tej pory opracowano kilka technologii, spośród których najpowszechniejsze są przezczaszkowa stymulacja magnetyczna i przezczaszkowa stymulacja prądem stałym. Powtarzalna przezczaszkowa stymulacja magnetyczna to bezbolesny, nieinwazyjny i łatwy do przeprowadzenia zabieg, który ma niewiele działań niepożądanych. Przynosi konkretne rezultaty w rehabilitacji pacjentów z urazowym uszkodzeniem mózgu16. W zależności od zastosowanej częstotliwości powtarzalna przezczaszkowa stymulacja magnetyczna zmienia pobudliwość neuronalną przez generację pobudzenia (> 5 Hz) lub inhibicji (1 Hz), które mogą utrzymywać się przez kilka godzin17,18. Jako nieinwazyjna technika stymulacji mózgu skutecznie leczy schizofrenię, depresję, chorobę Parkinsona, afazję, zespół nieuwagi stronnej i zaburzenia poznawcze19-24.
Neville i in.25 przeprowadzili podwójnie zaślepione, randomizowane badanie kontrolowane z udziałem 36 pacjentów z urazowym uszkodzeniem mózgu, których losowo przydzielono do dwóch równolicznych grup. Grupę leczoną poddano 10 sesjom powtarzalnej przezczaszkowej stymulacji magnetycznej o wysokiej częstotliwości (10 Hz) nad lewą grzbietowo-boczną korą przedczołową. Pacjenci z grupy kontrolnej przeszli zaś pseudostymulację. Uczestników badania poddano ocenie neuropsychologicznej na tydzień przed jego rozpoczęciem, a także po tygodniu oraz po trzech miesiącach od zakończenia terapii – w celu określenia jej bezpośrednich i opóźnionych skutków. Jak się okazało, powtarzalna przezczaszkowa stymulacja magnetyczna może złagodzić depresję i poprawić funkcje poznawcze u pacjentów z urazowym uszkodzeniem mózgu.
Dhaliwal i in.26 oraz Li i in.27 donieśli niedawno, że stymulacja mózgu miała potencjalny wpływ na leczenie urazowego uszkodzenia tego narządu. Obie grupy naukowców badały urazy niezwiązane ze sportem; badania te wykazały bezpieczeństwo i potencjalną skuteczność tej metody w terapii pacjentów z urazowym uszkodzeniem mózgu. Kilka badań wykazało, że powtarzalna przezczaszkowa stymulacja magnetyczna i przezczaszkowa stymulacja prądem stałym łagodzą związane z urazowym uszkodzeniem mózgu depresję, szumy uszne, zespół nieuwagi, zaniki pamięci i zaburzenia koncentracji26,27.
Middleton i in.28 również donieśli, że u dwóch pacjentów z urazowym uszkodzeniem mózgu (jeden z nich przeszedł również udar), których przez sześć miesięcy poddawano dwupółkulowej przezczaszkowej stymulacji prądem stałym, zaobserwowano znaczącą poprawę funkcjonowania kończyny górnej, ocenianego według skali Fugla-Meyera. Badania te dowodzą, że stymulacja mózgowa jest w przypadku tego schorzenia bezpieczna i potencjalnie korzystna.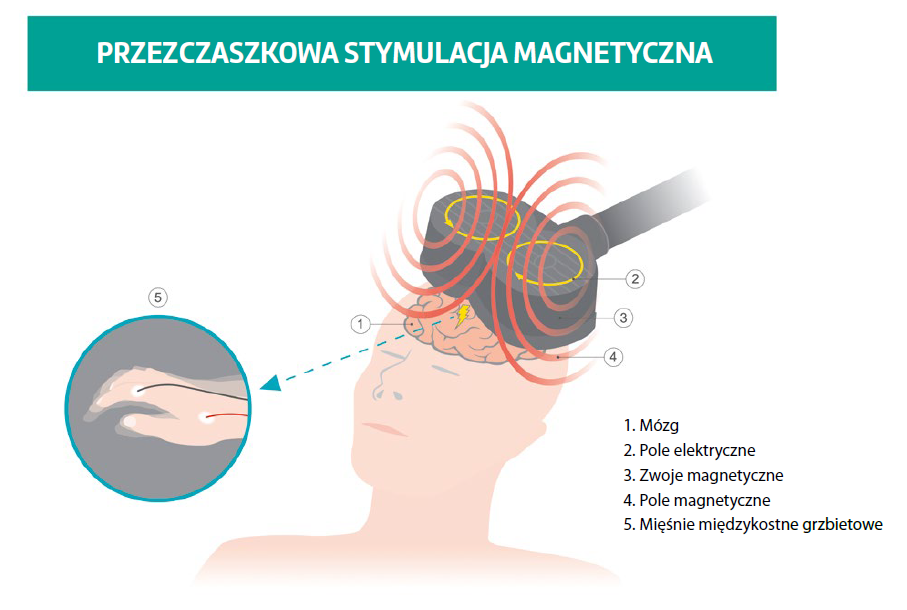
Wirtualna rzeczywistość ocenia funkcjonowanie i poprawia rokowania pacjentów z urazowym uszkodzeniem mózgu
Wspomagany komputerowo trening w połączeniu ze stymulacją audiowizualną – w celu pobudzenia dźwiękowych, wizualnych i związanych z grami intuicyjnych procesów, które obejmują różne elementy upośledzenia, takie jak pamięć, koncentracja, percepcja wzrokowa – znacznie poprawia zaangażowanie pacjenta i jego zapał do uczestnictwa w rehabilitacji.
Rozwój wspomaganego komputerowo systemu treningowego, zwłaszcza technologii wirtualnej rzeczywistości, sprzyja integracji technologii komputerowej i kognitywistyki. To połączenie ma zaś niezaprzeczalne zalety w ocenie i rehabilitacji funkcji poznawczych w porównaniu z treningiem poznawczym prowadzonym przez rehabilitantów29-31. W czasie procesu szkoleniowego stosuje się spersonalizowane procedury w celu redukcji czasu bezpośredniego kontaktu pomiędzy terapeutą a pacjentem.
Badania wykazały, że komputerowo wspomagane strategie poprawiają koncentrację, pamięć i funkcje wykonawcze32,33. Trening z wykorzystaniem wirtualnej rzeczywistości polepsza również nastrój pacjenta poprzez słuchowe i wizualne sprzężenie zwrotne, pozwalające mu odnieść emocjonalny sukces i redukujące towarzyszący terapii niepokój34. Sprzyja również wytrwałości, ponieważ chorzy ćwiczą, dopóki nie odniosą zwycięstwa.
Ponadto system treningowy z wykorzystaniem wirtualnej rzeczywistości zapewnia kompleksową ocenę funkcji motorycznych i poznawczych pacjenta, jego czynności życia codziennego i umiejętności społecznych. Bezpośrednio analizuje dane i przedstawia pisemny raport w celu porównania stanu chorego przed terapią i po jej zakończeniu. Pomaga to w wyznaczaniu celów leczenia, wyborze opcji terapeutycznych oraz ocenie efektów treningu, a wszystko to służy uzyskaniu idealnej kombinacji interaktywnego treningu i ćwiczeń, szkolenia poznawczego i ewaluacji rehabilitacji35.
Przywracanie funkcji kończyny lub narządu po urazowym uszkodzeniu mózgu
Funkcjonalna elektrostymulacja (FES – functional electrical stimulation) polega na zastosowaniu pulsacyjnego prądu elektrycznego o niskiej częstotliwości w celu pobudzenia niesprawnych kończyn lub narządów. Pod jej wpływem następuje zastąpienie lub korekcja utraconych funkcji. Stymulowanie odpowiedniego ośrodka nerwowego sprzyja rekonstrukcji funkcjonalnej u pacjentów36.
Zorientowana na zadania funkcjonalna elektrostymulacja (TFES – task-oriented functional electrical stimulation) to połączenie obustronnych ćwiczeń, treningu powtarzalnego, terapii zadaniowej i funkcjonalnej elektrostymulacji, a wstępne wyniki wykazały jej pozytywne rezultaty37-40. Wyniki terapeutyczne zorientowanej na zadania funkcjonalnej elektrostymulacji są lepsze niż w przypadku funkcjonalnej elektrostymulacji i terapii konwencjonalnej. Możliwe, że odpowiada za to połączenie rezultatów funkcjonalnej elektrostymulacji i terapii zadaniowych, jak również synergistyczny efekt tego rodzaju leczniczej kombinacji.
Iftime-Nielsen i in.41 potwierdzili istnienie takiego efektu pomiędzy proaktywnym nastawieniem pacjentów a funkcjonalną elektrostymulacją. Makowski i in.42 wykazali, że połączenie tej formy leczenia i świadomej aktywności miało wpływ na stymulowane przez terapię działanie. Dzięki rezultatom funkcjonalnej elektrostymulacji słaby i spontaniczny wysiłek może dawać większy zasięg i ruch.
Calabrò i in.43 prowadzili dwa rodzaje intensywnego treningu rehabilitacyjnego. Pacjentem był 34-letni mężczyzna z dysfagią po urazowym uszkodzeniu mózgu. Sześciotygodniowa terapia obejmowała konwencjonalny trening rehabilitacyjny oraz jego połączenie z elektrostymulacją VitalStim. Miała ona na celu przywrócenie specyficznej funkcji połykania oraz ocenę parametrów elektrofizjologicznych przed leczeniem i po jego zakończeniu. Jak się okazało, tylko stymulacja punktowa VitalStim znacząco poprawiła czynność połykania. Po terapii pacjent mógł w końcu bezpiecznie spożywać pokarmy stałe.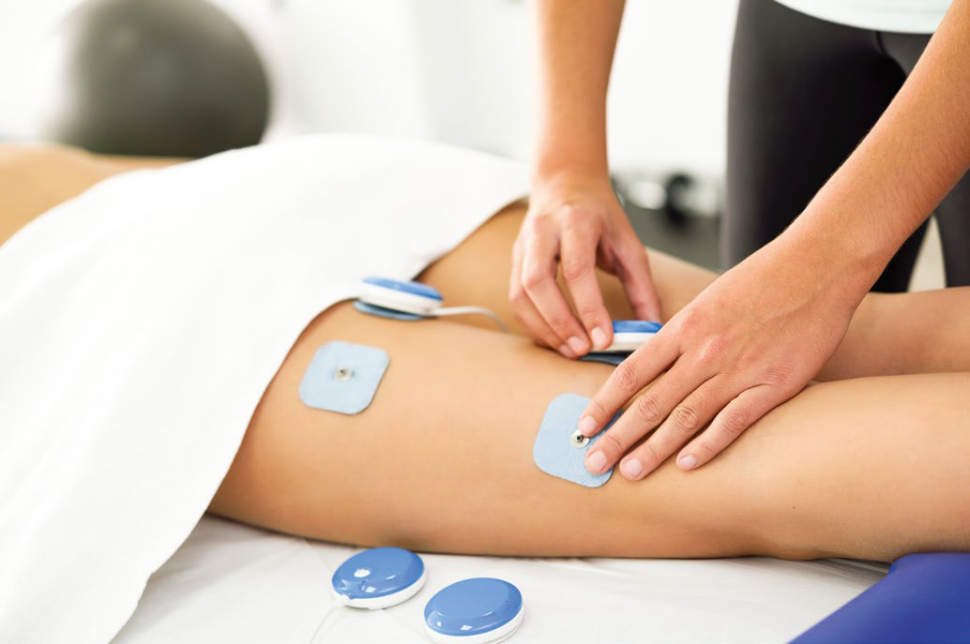
Korzyści płynące z behawioralnych, emocjonalnych i rodzinnych terapii urazowego uszkodzenia mózgu
Urazowe uszkodzenie mózgu wpływa na emocje, stabilność behawioralną i pewność siebie pacjenta. Główni opiekunowie chorych doświadczają znacznego stresu emocjonalnego i poczucia obciążenia. Albert i in.44 wykazali, że niskokosztowe interwencje odciążają ich i zwiększają odczuwaną przez nich satysfakcję. Z badania Sinnakaruppana i in.45 wynika zaś, że rodzinne programy edukacyjne dla opiekunów i członków rodziny pacjenta z urazowym uszkodzeniem mózgu wspomagają redukcję stresu i zwiększają potencjał do radzenia sobie z sytuacją.
Typowe zmiany behawioralne po urazowym uszkodzeniu mózgu często obejmują:
- gniew,
- depresję,
- lęk,
- agresję słowną lub fizyczną.
Konieczna jest stabilność emocjonalna pacjentów. W przeciwnym razie nie mogą oni uczestniczyć w procesie rehabilitacji ani czerpać z niego korzyści. Psychoterapia (indywidualna i grupowa) kładzie nacisk na terapie emocjonalne i behawioralne. Badania pokazują, że szkolenie w zakresie umiejętności radzenia sobie z sytuacją i zarządzania gniewem może zmniejszyć agresję pacjenta. Ponadto Baker i in.46 wykazali, że muzykoterapia spowodowała złagodzenie problemów związanych z emocjami i złością u chorego.
Podstawowe badania dotyczące rehabilitacji pacjentów z urazowym uszkodzeniem mózgu w ostatnich latach
W ostatnich latach stopniowo wzrasta liczba podstawowych badań nad rehabilitacją urazowego uszkodzenia mózgu47-51. Najnowszy przegląd sugeruje, że w dziedzinie badań behawioralnych młodzieńczego urazowego uszkodzenia mózgu, przeprowadzonych na modelach zwierzęcych, dominowały modele szczurze oraz zamknięte urazy głowy.
Wydaje się, że choroba ma wpływ zarówno na funkcje motoryczne, jak i poznawcze47. Najnowsze badanie wykazało, że długoterminowe deficyty w zakresie pamięci przestrzennej i przestrzennego uczenia się są uzależnione od stopnia zniszczenia istoty białej i hipokampu. Strategie terapeutyczne ukierunkowane na te dwa obszary mózgu mogą być niezbędne do poprawy funkcji neurologicznych u pacjentów z urazowym uszkodzeniem mózgu50.
Badania wykazały, że główną przyczyną zgonów po urazowym uszkodzeniu mózgu jest śmierć neuronów i pęknięcie naczyń krwionośnych. Regeneracja nerwów i angiogeneza odgrywają kluczowe role w odzyskiwaniu sprawności52-54. Krążące komórki progenitorowe śródbłonka są zaangażowane w angiogenezę55,56 i – jak potwierdzono – redukują obszar uszkodzeń, zwiększają gęstość naczyń włosowatych, poprawiają perfuzję mięśnia sercowego i ograniczają niedokrwienie kończyn w modelach zwierzęcych57,58. Erytropoetyna sprzyja namnażaniu i różnicowaniu czerwonych krwinek. Stosuje się ją w terapii klinicznej anemii i w profilaktyce uszkodzenia rdzenia kręgowego59, niedokrwienia siatkówki60, mięśni szkieletowych58, nadciśnienia płucnego61 oraz uszkodzenia niedokrwienno-reperfuzyjnego mięśnia sercowego62,63. Jest również wykorzystywana w prewencji urazowego uszkodzenia mózgu, ponieważ wzmacnia właściwości przeciwdziałające apoptozie59,64, przeciwzapalne60 i neuroprotekcyjne65,66. Poprzez mobilizację komórek progenitorowych śródbłonka erytropoetyna sprzyja angiogenezie i ogranicza śmierć komórek nerwowych, co poprawia rezultaty funkcjonalne po udarze mózgu67-69. Dane Wanga i in.49 wykazały, że rekombinowana erytropoetyna ludzka mobilizowała komórki progenitorowe śródbłonka i angiogenezę w celu poprawy rokowania funkcjonalnego u szczurów z urazowym uszkodzeniem mózgu.
Podsumowując, rehabilitacja po leczeniu urazowego uszkodzenia mózgu jest niezbędna. Istnieją liczne badania dotyczące odpowiedniego momentu na rehabilitację u pacjentów po udarze, ale rzadko pojawiają się informacje dotyczące optymalnego okna czasowego na rehabilitację po urazowym uszkodzeniu mózgu. Andelic i in.70 podzielili 61 pacjentów z ciężką postacią tego schorzenia na dwie grupy. W grupie eksperymentalnej podjęto wczesną interwencję w postaci treningu rehabilitacyjnego, zaś w grupie kontrolnej opóźniono go. W celu klasyfikacji obu grup po 12 miesiącach od zakończenia leczenia zastosowano rozszerzoną wersję skali wyników Glasgow oraz skalę niepełnosprawności. Okazało się, że grupa eksperymentalna osiągnęła znacznie wyższe wyniki w obu z nich niż grupa kontrolna. Wskazywało to na fakt, że wczesna interwencja w postaci treningu rehabilitacyjnego pozwala na osiągnięcie lepszych efektów terapeutycznych.
Jednak ze względu na złożoność urazowego uszkodzenia mózgu, nieodpowiednią wielkość próby oraz brak wystarczającej grupy kontrolnej, badania dotyczące rehabilitacji klinicznej napotykają na znaczące wyzwania. W dalszych badaniach potrzebna jest szeroko zakrojona randomizowana i kontrolowana próba. Dodatkowe prace w tym kierunku zwiększą możliwości rehabilitacji pacjentów z urazowym uszkodzeniem mózgu.
- A.A. Hyder, C.A. Wunderlich, P. Puvanachandra, G. Gururaj, O.C. Kobusingye, The impact of traumatic brain injuries: a global perspective, NeuroRehabilitation, vol. 22, no. 5, pp. 341–353, 2007.
- B.T. Mausbach, E.A. Chattillion, R.C. Moore, S.K. Roepke, C.A. Depp, S. Roesch, Activity restriction and depression in medical patients and their caregivers: a meta-analysis, Clinical Psychology Review, vol. 31, no. 6, pp. 900–908, 2011.
- K.A. Cappa, J.C. Conger, A.J. Conger, Injury severity and outcome: a meta-analysis of prospective studies on TBI outcome, Health Psychology, vol. 30, no. 5, pp. 542–560, 2011.
- C. Braswell, D.T. Crowe, Hyperbaric oxygen therapy, Compendium on Continuing Education for the Practising Veterinarian, vol. 34, no. 3, pp. E1–E5, E6, 2012.
- C. Sanchez, Mechanisms of action of hyperbaric oxygenation in stroke: a review, Critical Care Nursing Quarterly, vol. 36, no. 3, pp. 290–298, 2013. Neural Plasticity 3
- H. Lin, C.P. Chang, H.J. Lin, M.T. Lin, C.C. Tsai, Attenuating brain edema, hippocampal oxidative stress, and cognitive dysfunction in rats using hyperbaric oxygen preconditioning during simulated high-altitude exposure, Journal of Trauma and Acute Care Surgery, vol. 72, no. 5, pp. 1220–1227, 2012.
- P.G. Harch, S.R. Andrews, E.F. Fogarty et al., A phase I study of low-pressure hyperbaric oxygen therapy for blastinduced post-concussion syndrome and post-traumatic stress disorder, Journal of Neurotrauma, vol. 29, no. 1, pp. 168–185, 2012.
- F. Geng, Y. Ma, T. Xing, X. Zhuang, J. Zhu, L. Yao, Effects of hyperbaric oxygen therapy on Inflammasome signaling after traumatic brain injury, Neuroimmunomodulation, vol. 23, no. 2, pp. 122–129, 2016.
- Z.L. Golden, R. Neubauer, C.J. Golden, L. Greene, J. Marsh, A. Mleko, Improvement in cerebral metabolism in chronic brain injury after hyperbaric oxygen therapy, International Journal of Neuroscience, vol. 112, no. 2, pp. 119–131, 2002.
- Z. Golden, C.J. Golden, R.A. Neubauer, Improving neuropsychological function after chronic brain injury with hyperbaric oxygen, Disability and Rehabilitation, vol. 28, no. 22, pp. 1379–1386, 2006.
- R. Boussi-Gross, H. Golan, G. Fishlev et al., Hyperbaric oxygen therapy can improve post concussion syndrome years after mild traumatic brain injury – randomized prospective trial, PloS One, vol. 8, no. 11, article e79995, 2013.
- P.G. Harch, E.F. Fogarty, P.K. Staab, K. Van Meter, Low pressure hyperbaric oxygen therapy and SPECT brain imaging in the treatment of blast-induced chronic traumatic brain injury (post-concussion syndrome) and post traumatic stress disorder: a case report, Cases Journal, vol. 2, p. 6538, 2009.
- L.Q. Lv, L.J. Hou, M.K. Yu, X.H. Ding, X.Q. Qi, Y.C. Lu, Hyperbaric oxygen therapy in the management of paroxysmal sympathetic hyperactivity after severe traumatic brain injury: a report of 6 cases, Archives of Physical Medicine and Rehabilitation, vol. 92, no. 9, pp. 1515–1518, 2011.
- G.L. Rockswold, S.E. Ford, D.C. Anderson, T.A. Bergman, R.E. Sherman, Results of a prospective randomized trial for treatment of severely brain-injured patients with hyperbaric oxygen, Journal of Neurosurgery, vol. 76, no. 6, pp. 929–934, 1992.
- A. Prakash, S.V. Parelkar, S.N. Oak et al., Role of hyperbaric oxygen therapy in severe head injury in children, Journal of Pediatric Neurosciences, vol. 7, no. 1, pp. 4–8, 2012.
- P.M. Kreuzer, M.Landgrebe, E.Frank, B. Langguth, Repetitive transcranial magnetic stimulation for the treatment of chronic tinnitus after traumatic brain injury: a case study, The Journal of Head Trauma Rehabilitation, vol. 28, no. 5, pp. 386–389, 2013.
- E.M. Wassermann, A. Samii, B. Mercuri et al., Responses to paired transcranial magnetic stimuli in resting, active, and recently activated muscles, Experimental Brain Research, vol. 109, no. 1, pp. 158–163, 1996.
- S. Rossi, M. Hallett, P.M. Rossini, A. Pascual-Leon, and Safety of TMS Consensus Group, Safety, ethical considerations, and application guidelines for the use of transcranial magnetic stimulation in clinical practice and research, Clinical Neurophysiology, vol. 120, no. 12, pp. 2008–2039, 2009.
- W. Yang, T.T. Liu, X.B. Song et al., Comparison of different stimulation parameters of repetitive transcranial magnetic stimulation for unilateral spatial neglect in stroke patients, Journal of the Neurological Sciences, vol. 359, no. 1-2, pp. 219–225, 2015.
- C. Miniussi, S.F. Cappa, L.G. Cohen et al., Efficacy of repetitive transcranial magnetic stimulation/transcranial direct current stimulation in cognitive neurorehabilitation, Brain Stimulation, vol. 1, no. 4, pp. 326–336, 2008.
- T. Wobrock, B. Guse, J. Cordes et al., Left prefrontal highfrequency repetitive transcranial magnetic stimulation for the treatment of schizophrenia with predominant negative symptoms: a sham-controlled, randomized multicenter trial, Biological Psychiatry, vol. 77, no. 11, pp. 979–988, 2015.
- Y. Li, Y. Qu, M. Yuan, and T. Du, Low-frequency repetitive transcranial magnetic stimulation for patients with aphasia after stoke: a meta-analysis, Journal of Rehabilitation Medicine, vol. 47, no. 8, pp. 675–681, 2015.
- S. Pallanti, A. Di Rollo, S. Antonini, G. Cauli, E. Hollander, L. Quercioli, Low-frequency rTMS over right dorsolateral prefrontal cortex in the treatment of resistant depression: cognitive improvement is independent from clinical response, resting motor threshold is related to clinical response, Neuropsychobiology, vol. 65, no. 4, pp. 227–235, 2012.
- M. Vonloh, R. Chen, B. Kluger, Safety of transcranial magnetic stimulation in Parkinson’s disease: a review of the literature, Parkinsonism & Related Disorders, vol. 19, no. 6, pp. 573–585, 2013.
- I.S. Neville, C.Y. Hayashi, H.S. El et al., Repetitive transcranial magnetic stimulation (rTMS) for the cognitive rehabilitation of traumatic brain injury (TBI) victims: study protocol for a randomized controlled trial, Trials, vol. 16, p. 440, 2015.
- S.K. Dhaliwal, B.P. Meek, M.M. Modirrousta, Noninvasive brain stimulation for the treatment of symptoms following traumatic brain injury, Frontiers in Psychiatry, vol. 6, p. 119, 2015.
- S. Li, A.L. Zaninotto, I.S. Neville, W.S. Paiva, D. Nunn, F. Fregni, Clinical utility of brain stimulation modalities following traumatic brain injury: current evidence, Neuropsychiatric Disease and Treatment, vol. 11, pp. 1573–1586, 2015.
- A. Middleton, S.L. Fritz, D.M. Liuzzo, R. Newman-Norlund, T.M. Herter, Using clinical and robotic assessment tools to examine the feasibility of pairing tDCS with upper extremity physical therapy in patients with stroke and TBI: a consideration-of-concept pilot study, NeuroRehabilitation, vol. 35, no. 4, pp. 741–754, 2014.
- G. Riva, F. Mantovani, A. Gaggioli, Presence and rehabilitation: toward second-generation virtual reality applications in neuropsychology, Journal of Neuroengineering and Rehabilitation, vol. 1, no. 1, p. 9, 2004.
- F.D. Rose, B.M. Brooks, A.A. Rizzo, Virtual reality in brain damage rehabilitation: review, Cyberpsychology & Behavior, vol. 8, no. 3, pp. 241–262, 2005, 263-271.
- P.J. Standen, D.J. Brown, Virtual reality in the rehabilitation of people with intellectual disabilities: review, Cyberpsychology & Behavior, vol. 8, no. 3, pp. 272–282, 2005, 283-288.
- S.F. Tam, W.K. Man, Evaluating computer-assisted memory retraining programmes for people with post-head injury amnesia, Brain Injury, vol. 18, no. 5, pp. 461–470, 2004.
- T. Bergquist, C. Gehl, J. Mandrekar et al., The effect of internet-based cognitive rehabilitation in persons with memory impairments after severe traumatic brain injury, Brain Injury, vol. 23, no. 10, pp. 790–799, 2009. 4 Neural Plasticity
- K. Verhoeven, G. Crombez, C. Eccleston, D.M. Van Ryckeghem, S. Morley, S. Van Damme, The role of motivation in distracting attention away from pain: an experimental study, Pain, vol. 149, no. 2, pp. 229–234, 2010.
- G. Burdea, V. Popescu, V. Hentz, K. Colbert, Virtual reality-based orthopedic telerehabilitation, IEEE Transactions on Rehabilitation Engineering, vol. 8, no. 3, pp. 430–432, 2000.
- T. Hamada, T. Hayashi, T. Kimura, K. Nakao, T. Moritani, Electrical stimulation of human lower extremities enhances energy consumption, carbohydrate oxidation, and whole body glucose uptake, Journal of Applied Physiology, vol. 96, no. 3, pp. 911–916, 2004.
- M.I. Lourencao, L.R. Battistella, C.M. de Brito, G.R. Tsukimoto, M.H. Miyazaki, Effect of biofeedback accompanying occupational therapy and functional electrical stimulation in hemiplegic patients, International Journal of Rehabilitation Research, vol. 31, no. 1, pp. 33–41, 2008.
- G. Alon, A.F. Levitt, P.A. McCarthy, Functional electrical stimulation (FES) may modify the poor prognosis of stroke survivors with severe motor loss of the upper extremity: a preliminary study, American Journal of Physical Medicine & Rehabilitation, vol. 87, no. 8, pp. 627–636, 2008.
- J.S. Knutson, M.Y. Harley, T.Z. Hisel, J. Chae, Improving hand function in stroke survivors: a pilot study of contralaterally controlled functional electric stimulation in chronic hemiplegia, Archives of Physical Medicine and Rehabilitation, vol. 88, no. 4, pp. 513–520, 2007.
- M.R. Popovic, T.A. Thrasher, V. Zivanovic, J. Takaki, V. Hajek, Neuroprosthesis for retraining reaching and grasping functions in severe hemiplegic patients, Neuromodulation, vol. 8, no. 1, pp. 58–72, 2005.
- S.D. Iftime-Nielsen, M.S. Christensen, R.J. Vingborg, T. Sinkjaer, A. Roepstorff, and M.J. Grey, Interaction of electrical stimulation and voluntary hand movement in SII and the cerebellum during simulated therapeutic functional electrical stimulation in healthy adults, Human Brain Mapping, vol. 33, no. 1, pp. 40–49, 2012.
- N.S. Makowski, J.S. Knutson, J. Chae, P. Crago, Neuromuscular electrical stimulation to augment reach and hand opening after stroke, Conference Proceedings: Annual International Conference of the IEEE Engineering in Medicine and Biology Society, vol. 2011, pp. 3055–3058, 2011.
- R.S. Calabro, V.C. Nibali, A. Naro et al., Is non-invasive neuromuscular electrical stimulation effective in severe chronicneurogenic dysphagia? Reporton a post-traumatic brain injury patient, NeuroRehabilitation, vol. 38, no. 1, pp. 53–57, 2016.
- S.M. Albert, A. Im, L. Brenner, M. Smith, R. Waxman, Effect of a social work liaison program on family caregivers to people with brain injury, The Journal of Head Trauma Rehabilitation, vol. 17, no. 2, pp. 175–189, 2002.
- I. Sinnakaruppan, B. Downey, S. Morrison, Head injury and family carers: a pilot study to investigate an innovative community-based educational programme for family carers and patients, Brain Injury, vol. 19, no. 4, pp. 283–308, 2005.
- F. Baker, T. Wigram, C. Gold, The effects of a songsinging programme on the affective speaking intonation of people with traumatic brain injury, Brain Injury, vol. 19, no. 7, pp. 519–528, 2005.
- R. E. Hartman, A brief history of behavioral assessment following experimental traumatic brain injury in juveniles, Translational Stroke Research, vol. 2, no. 4, pp. 433–437, 2011.
- A. Chodobski, B.J. Zink, J. Szmydynger-Chodobska, Blood–brain barrier pathophysiology in traumatic brain injury, Translational Stroke Research, vol. 2, no. 4, pp. 492–516, 2011.
- L. Wang, X. Wang, H. Su et al., Recombinant human erythropoietin improves the neurofunctional recovery of rats following traumatic brain injury via an increase in circulating endothelial progenitor cells, Translational Stroke Research, vol. 6, no. 1, pp. 50–59, 2015.
- C. An, X. Jiang, H. Pu et al., Severity-dependent long-term spatial learning-memory impairment in a mouse model of traumatic brain injury, Translational Stroke Research, vol. 7, no. 6, pp. 512–520, 2016.
- E.S. Hald, P.W. Alford, Smooth muscle phenotype switching in blast traumatic brain injury-induced cerebral vasospasm, Translational Stroke Research, vol. 5, no. 3, pp. 385–393, 2014.
- Y. Xiong, D. Lu, C. Qu et al., Effects of erythropoietin on reducing brain damage and improving functional outcome after traumatic brain injury in mice, Journal of Neurosurgery, vol. 109, no. 3, pp. 510–521, 2008.
- Y. Xiong, A. Mahmood, D. Lu et al., Histological and functional outcomes after traumatic brain injury in mice null for the erythropoietin receptor in the central nervous system, Brain Research, vol. 1230, pp. 247–257, 2008.
- M. Chopp, Y. Li, J. Zhang, Plasticity and remodeling of brain, Journal of the Neurological Sciences, vol. 265, no. 1-2, pp. 97–101, 2008.
- Z.G. Zhang, L. Zhang, Q. Jiang, M. Chopp, Bone marrowderived endothelial progenitor cells participate in cerebral neovascularization after focal cerebral ischemia in the adult mouse, Circulation Research, vol. 90, no. 3, pp. 284–288, 2002.
- Y. Fan, F. Shen, T. Frenzel et al., Endothelial progenitor cell transplantation improves long-term stroke outcome in mice, Annals of Neurology, vol. 67, no. 4, pp. 488–497, 2010.
- B.E. Strauer, M. Brehm, T. Zeus et al., Repair of infarcted myocardium by autologous intracoronary mononuclear bone marrow cell transplantation in humans, Circulation, vol. 106, no. 15, pp. 1913–1918, 2002.
- C. Kalka, H. Masuda, T. Takahashi et al., Transplantation of ex vivo expanded endothelial progenitor cells for therapeutic neovascularization, Proceedings of the National Academy of Sciences of the United States of America, vol. 97, no. 7, pp. 3422–3427, 2000.
- M. Celik, N. Gokmen, S. Erbayraktar et al., Erythropoietin prevents motor neuron apoptosis and neurologic disability in experimental spinal cord ischemic injury, Proceedings of the National Academy of Sciences of the United States of America, vol. 99, no. 4, pp. 2258–2263, 2002.
- A.K. Junk, A. Mammis, S.I. Savitz et al., Erythropoietin administration protects retinal neurons from acute ischemiareperfusion injury, Proceedings of the National Academy of Sciences of the United States of America, vol. 99, no. 16, pp. 10659–10664, 2002.
- K. Satoh, Y. Kagaya, M. Nakano et al., Important role of endogenous erythropoietin system in recruitment of endothelial progenitor cells in hypoxia-induced pulmonary hypertension in mice, Circulation, vol. 113, no. 11, pp. 1442–1450, 2006.
- L. Calvillo, R. Latini, J. Kajstura et al., Recombinant human erythropoietin protects the myocardium from ischemia-Neural Plasticity 5 reperfusion injury and promotes beneficial remodeling, Proceedings of the National Academy of Sciences of the United States of America, vol. 100, no. 8, pp. 4802–4806, 2003.
- E. Lipsic, P. van der Meer, R.H. Henning et al., Timing of erythropoietin treatment for cardioprotection in ischemia/reperfusion, Journal of Cardiovascular Pharmacology, vol. 44, no. 4, pp. 473–479, 2004.
- M.B. Potts, S.E. Koh, W.D. Whetstone et al., Traumatic injury to the immature brain: inflammation, oxidative injury, and iron-mediated damage as potential therapeutic targets, NeuroRx, vol. 3, no. 2, pp. 143–153, 2006.
- K.J. Park, E. Park, E. Liu, A.J. Baker, Bone marrowderived endothelial progenitor cells protect postischemic axons after traumatic brain injury, Journal of Cerebral Blood Flow and Metabolism, vol. 34, no. 2, pp. 357–366, 2014.
- O.P. Akdemir, H. Oruckaptan, G.P. Ozdemir et al., Effect of erythropoietin on brain tissue after experimental head trauma in rats, Surgical Neurology, vol. 68, no. 5, pp. 547–555, 2007, 555.
- F.H. Bahlmann, K. De Groot, J.M. Spandau et al., Erythropoietin regulates endothelial progenitor cells, Blood, vol. 103, no. 3, pp. 921–926, 2004.
- L. Wang, Z. Zhang, R. Zhang et al., Erythropoietin upregulates SOCS2 in neuronal progenitor cells derived from SVZ of adult rat, Neuroreport, vol. 15, no. 8, pp. 1225–1229, 2004.
- T. Sobrino, O. Hurtado, M.A. Moro et al., The increase of circulating endothelial progenitor cells after acute ischemic stroke is associated with good outcome, Stroke, vol. 38, no. 10, pp. 2759–2764, 2007.
- N. Andelic, E. Bautz-Holter, P. Ronning et al., Does an early onset and continuous chain of rehabilitation improve the long-term functional outcome of patients with severe traumatic brain injury?, Journal of Neurotrauma, vol. 29, no. 1, pp. 66–74, 2012.