Wprowadzenie
Zawroty głowy i problemy z równowagą to częste niedomagania wśród osób starszych. Szacuje się, że około 30% osób powyżej 65. roku życia doświadcza jakiejś formy zawrotów głowy, przy czym w populacji powyżej 80 lat odsetek ten wzrasta do 50%1. Zawroty głowy u osób starszych to rosnący problem zdrowia publicznego, ponieważ osoby te obarczone są znacząco wyższym ryzykiem upadków i wynikających z nich urazów2-4. Tło przyczynowe zawrotów głowy u starszych pacjentów jest bardzo złożone, ponieważ istnieje wiele mechanizmów, które mogą przyczyniać się do tego problemu. Przedsionkowa terapia rehabilitacyjna (VRT – vestibular rehabilitation therapy) jest programem terapeutycznym opartym na ćwiczeniach mającym na celu poprawę funkcji równowagi u pacjentów ze znaczącymi deficytami pochodzenia przedsionkowego5,6. Ćwiczenia w VRT zmierzają do redukcji upośledzających objawów poprzez ośrodkowe mechanizmy neuroplastyczności, takie jak habituacja, adaptacja i substytucja, które przyspieszają proces kompensacji przedsionkowej7-9.
Od niedawna rośnie zainteresowanie modulacją korowej i podkorowej pobudliwości – poprzez metody nieinwazyjne, takie jak nieinwazyjna stymulacja mózgu – jako narzędziem do poprawiania wyników w przebiegu terapii. Przezczaszkowa stymulacja prądem stałym (tDCS – transcranial direct current stimulation) stanowi bezpieczną i nieinwazyjną technologię neuromodulacji, która może wpływać na aktywności neuronalne. Polega ona na stymulacji mózgu słabym prądem stałym poprzez anodę i katodę umieszczone na skórze głowy i może modulować pobudliwość korową oraz skutkować zmianami fizjologicznymi i behawioralnymi poprawiającymi wyniki funkcjonalne10,11. Wykazano, że stymulacja anodowa wywołuje efekt pobudzający w położonej pod anodą korze mózgowej poprzez depolaryzację neuronów, a stymulacja katodowa wywołuje hiperpolaryzację leżących pod katodą neuronów, głównie poprzez wpływ na membranowy potencjał spoczynkowy12,13.
Niedawno uzyskane dowody potwierdzają korzystny wpływ tDCS na edukację motoryczną, kontrolę postawy, chód i pamięć roboczą14-19. Niniejsze badanie ma na celu dokonanie porównania efektów terapeutycznych samej VRT i w połączeniu z tDCS w dysfunkcjach przedsionkowych u starszych pacjentów. Główna hipoteza badawcza brzmi, że połączone leczenie VRT-tDCS może prowadzić do większego efektu terapeutycznego niż sama VRT oraz że połączony protokół VRT-tDCS skutkuje większą poprawą równowagi niż samo podejście VRT u osób starszych z dysfunkcją przedsionkową. Hipotezy te wynikają z założenia, że tDCS korzystnie wpływa na ośrodkowy układ nerwowy, powodując szybsze i skuteczniejsze uczenie się podczas adaptacji do deficytów przedsionkowych.
Metody
Uczestnicy
W niniejszym badaniu uczestniczyło 36 osób starszych z przewlekłą dysfunkcją układu przedsionkowgo, leczonych przy pomocy dostosowanego programu rehabilitacji przedsionkowej. Wszyscy uczestnicy cierpieli na przewlekłe (trwające ponad 2 lata) i oporne na leki zawroty głowy. Pacjenci odstawili leki co najmniej dwa tygodnie przed pierwszą sesją terapeutyczną. Diagnoza dysfunkcji układu przedsionkowego oparta była o szczegółową historię choroby, test vHIT (Video Head Impuls Test), wideonystagmografię (VNG) łącznie z testami pozycjonowania, bitermicznym testem kalorycznym oraz testem okoruchowym, oraz szyjny test miogennych przedsionkowych potencjałów wywoławczych (VEMP – Vestibular Evoked Myogenic Potentials). Kryteria włączające obejmowały wiek od 65 do 80 lat, rozpoznanie przewlekłej dysfunkcji układu przedsionkowego i wzrok w normie lub skorygowany do normy przy pomocy okularów. Osoby z ostrą i nawracającą dysfunkcją przedsionkową w wywiadzie, stosujące leki mogące niekorzystnie wpływać na układ przedsionkowy, po urazie mózgu, z metalowymi implantami w głowie lub szyi w pobliżu stymulowanego obszaru, ograniczeniami ortopedycznymi zakłócającymi badanie, zaburzeniami psychiatrycznymi lub napadami padaczkowymi były wykluczane z badania.
Protokół badania
W tym podwójnie zaślepionym kontrolowanym badaniu randomizowanym pacjentów w sposób losowy przydzielono do grupy VRT-tDCS (terapia łączona) lub grupy z samą VRT. Obie grupy dopasowano pod względem wieku, płci i czasu trwania choroby. W celu zmniejszenia ryzyka stronniczości zarówno pacjentów, jak i naukowców poddano zaślepieniu odnośnie do typu protokołu.
Terapia rehabilitacji przedsionkowej (VRT)
Każdy pacjent wykonywał ćwiczenia przedsionkowe dopasowane do jego dolegliwości i postrzeganych ograniczeń funkcjonalnych ustalonych podczas badań wstępnych. Wszyscy pacjenci przeszli 3-tygodniowy program etapowej rehabilitacji przedsionkowej. Podczas pierwszych dwóch tygodni pacjent uczestniczył w serii sesji ćwiczeniowych trwających po 25-30 minut, 6 dni w tygodniu (w sumie 12 sesji). W ostatnim tygodniu pacjent kontynuował codzienne ćwiczenia VRT w domu, na podstawie spisanego programu ćwiczeń i instrukcji ich wykonywania. Program terapeutyczny składał się z ćwiczeń na habituację i adaptację połączonych z ćwiczeniami chodu.
Podczas treningu habituacji pacjent przesuwał głowę w lewo i w prawo, utrzymując wzrok skierowany w jedno konkretne miejsce. W celu przeprowadzenia ćwiczeń na adaptację zidentyfikowano ruchy prowokujące objawy u pacjenta, następnie pacjent wykonywał ćwiczenia do momentu, aż przestawał reagować niekorzystnie na te bodźce. W celu poprawy stabilności postawy poprzez wzmocnienie postawy statycznej i dynamicznej wykonywano także ćwiczenia chodu. W niniejszym badaniu chodzenie rozpoczynano na płaskiej powierzchni, po czym przechodzono do powierzchni nierównej. Następnie zwiększano trudność zadania poprzez dodanie rotacji głowy w postaci kiwania głową w prawo i w lewo podczas chodzenia po trudnej powierzchni.
Przezczaszkowa stymulacja prądem stałym
Procedurę tDCS przeprowadzano przy użyciu dwóch elektrod umieszczonych w gąbkach (35 cm2) nasączonych roztworem soli fizjologicznej. Do ustalenia miejsca przyłożenia elektrod używano urządzenia EEG. Anoda i katoda umieszczane były nad prawym (punkt F4) i lewym (punkt F3) obszarem grzbietowo-bocznej kory przedczołowej (DLPFC – dorsolateral prefrontal cortex), a podczas stymulacji impedancja elektrod cały czas pozostawała poniżej poziomu 3 kΩ (ryc. 1). Podczas każdej sesji tDCS przez 20 minut do elektrod dostarczany był prąd o natężeniu 2 mA. Stymulację przeprowadzano sześć razy w tygodniu przez 3 tygodnie (w sumie 18 sesji).
Ocena kliniczna
Główną miarą wyniku była zmiana wpływu zawrotów głowy na codzienne funkcjonowanie i jakość życia, które mierzono przy pomocy perskiej wersji kwestionariusza Dizziness Handicap Inventory (DHI). Kwestionariusz ten składa się z 25 pytań do pacjenta oceniających fizyczną (7 elementów), emocjonalną (9 elementów) i funkcjonalną (9 punktów) domenę niepełnosprawności związanej z zaburzeniami przedsionkowymi. Na każde pytanie możliwe są trzy odpowiedzi: „nie” (0 punktów), „czasami” (2 punkty) lub „tak” (4 punkty). Wynik DHI mieści się w zakresie od 0 do 100, przy czym 0 oznacza brak niepełnosprawności, a 100 oznacza największą możliwą niepełnosprawność postrzeganą przez pacjenta.
Przy wyniku w zakresie 0-30 objawy określano jako łagodne, w zakresie 31-60 – jako umiarkowane, a w zakresie 61-100 jako ciężkie. Jako drugorzędna miara efektu użyta była skala ABC (activities-specific balance confidence – pewność równowagi podczas konkretnych czynności). Jest to kwestionariusz wypełniany przez pacjenta dostarczający informacji na temat poczucia równowagi podczas wykonywania rozmaitych codziennych czynności. Skala ABC składa się z 16 punktów, a jej wynik mieści się w zakresie od 0% (całkowity brak pewności) do 100% (pełna pewność). W celu oszacowania lęku związanego z zaburzeniami przedsionkowymi przed i po interwencji zastosowano także kwestionariusz ryzyka lęku Becka (Beck Anxiety Inventory – BAI). Składa się on z 21 punktów ocenianych w 4-stopniowej skali Likerta od 0 (brak) do 3 (ciężkie nasilenie). Otrzymany wynik mieści się w zakresie od 0 do 63, przy czym niższy wynik BAI wskazuje na mniejszy poziom lęku związanego z zawrotami głowy. Kwestionariusze DHI, BAI i ABC wypełniano w obu grupach przed pierwszą sesją VRT oraz po 1., 2. i 3. tygodniu.
Wyniki
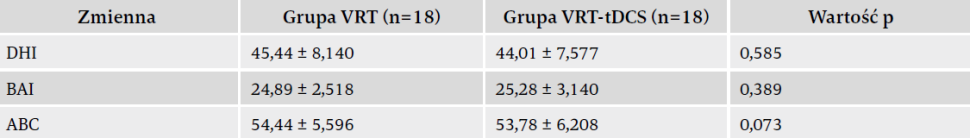
Średni wiek uczestników wynosił 71,17 lat, a proporcja kobiet do mężczyzn wynosiła 15:21. Spośród 36 pacjentów u 17 rozpoznano łagodne napadowe pozycyjne zawroty głowy (ŁPZG), u 13 – chorobę Meniere’a, a u 6 – migrenę przedsionkową. Dane demograficzne i wyjściowa charakterystyka kliniczna uczestników były podobne w obu grupach. Także wyjściowe główne i drugorzędne pomiary wyniku nie różniły się znacząco między grupami (tabele 1 i 2).
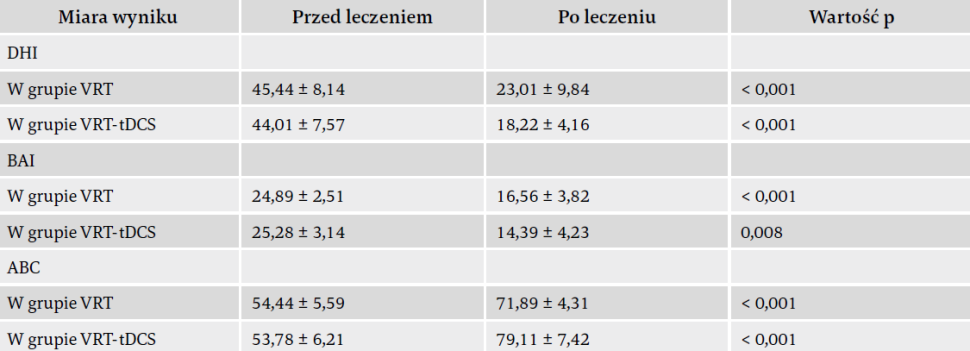
Jeśli chodzi o główny pomiar wyniku, czyli DHI, analiza RM-ANOVA wykazała znaczący efekt czasu i stymulacji, ale brak efektu interakcji „stymulacja x czas”. Porównania post-hoc obu grup ujawniły, że stymulacja tDCS skutkowała znaczącą różnicą wyniku DHI we wszystkich punktach czasowych. Ponadto jednokierunkowa analiza ANOVA ujawniła znaczący efekt czasu w grupie łączonej VRT-tDCS. Jeśli chodzi o wynik ABC, przed stymulacją tDCS nie było znaczących różnic między grupami. Analiza RM-ANOVA wykazała znaczący efekt czasu i stymulacji oraz interakcji „czas x stymulacja”. Odnośnie do wyniku BAI zaobserwowano znaczący efekt czasu, ale brak dowodów na interakcję „czas x stymulacja” oraz na efekt stymulacji, co oznacza brak znaczących różnic między grupami, jakie ujawniłyby się we wszystkich punktach czasowych.
Efekty uboczne tDCS
Autorzy badania zaprojektowali specjalny formularz do oceny efektów ubocznych tDCS20. Ich ustalenia wykazały, że najczęściej zgłaszanym efektem ubocznym w obu grupach było swędzenie (79,3% w grupie VRT-tDCS i 53,3% w grupie VRT); następnymi co do częstości pojawiania się były ból głowy i zmęczenie. Nie stwierdzono jednak znaczącej różnicy między obiema grupami odnośnie do częstotliwości pojawiania się różnych efektów ubocznych tDCS (wartość p była większa od 0,05). Żaden z pacjentów nie zgłaszał mrowienia, podrażnienia skóry ani szczypania w miejscu przyłożenia elektrod tDCS.
Omówienie
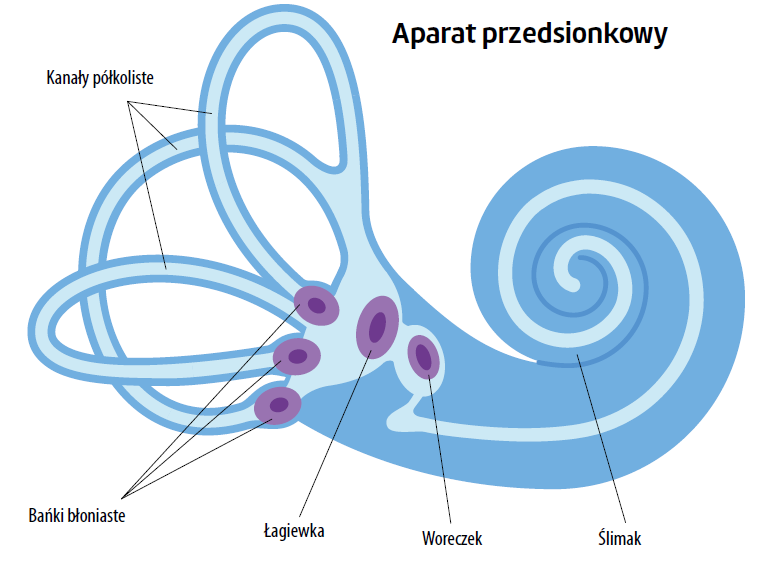
Badanie niniejsze analizuje porównawczo skuteczność łączonej terapii VRT-tDCS oraz samej VRT odnośnie do poprawiania funkcji równowagi i objawów dysfunkcji układu przedsionkowego u starszych pacjentów. Zaburzenia funkcji równowagi u osób starszych stanowią bardzo poważny problem zdrowia publicznego zarówno z punktu widzenia klinicznego, jak i ekonomicznego, a jego występowanie sięga 30% w populacji powyżej 60. roku życia. Osoby w wieku co najmniej 65 lat charakteryzują się najwyższym ryzykiem upadku. Niedawno pozyskane dowody wykazały, że upadki u osób starszych mogą skutkować nie tylko poważnym urazem albo zgonem, ale mogą również prowadzić do nasilenia się depresji i lęku i obniżenia jakości życia21,22. Wykazano, że u osób starszych liczba komórek włosowatych w układzie przedsionkowym jest zredukowana w porównaniu z osobami młodszymi. Ta redukcja liczby włosowatych komórek sensorycznych nie występuje jednak jednorodnie w całym obwodowym układzie przedsionkowym. Kanały półkoliste doznają około 40-procentowego spadku liczby komórek włosowatych, podczas gdy otolity (woreczek i łagiewka) tracą z wiekiem około 25% swoich komórek włosowatych.
Co więcej, łagiewkowe komórki sensoryczne są bardziej podatne na degenerację związaną z wiekiem niż komórki włosowate woreczka23. Rozmiar i liczba przedsionkowych włókien nerwowych także zmniejsza się z wiekiem, a proces ten rozpoczyna się około 40. roku życia. Mniejsza liczba przedsionkowych komórek sensorycznych oraz ścieżek nerwowych prowadzi do związanego z wiekiem osłabienia przedsionkowych sygnałów aferentnych wysyłanych do centralnego przedsionkowego układu nerwowego.
Dochodzi również do powiązanej redukcji liczby komórek móżdżku, która przyczynia się do modulacji przedsionkowych aferentów23-25. VRT jest zalecana jako dobroczynna opcja terapeutyczna w leczeniu osób starszych z przewlekłymi deficytami przedsionkowymi26-28. Szereg badań wykazał, że VRT może poprawiać stabilność posturalną, pewność siebie i jakość życia oraz zmniejszać objawy szkód emocjonalnych, depresji i lęku29-31. Wyniki niniejszego badania wykazały, że ćwiczenia na adaptację i habituację w połączeniu z terapią tDCS szybko złagodziły objawy, zmniejszyły niepełnosprawność związaną z zawrotami głowy oraz poprawiły pewność równowagi u osób starszych z przewlekłym zaburzeniem przedsionkowym. Uważa się, że ćwiczenia na adaptację, składające się z powtarzanych ruchów głowy i oczu, mogą pomóc centralnemu przedsionkowemu układowi nerwowemu poprzez przebudowanie sieci odruchu przedsionkowo- ocznego (VOR – vestibuar- ocular reflex). Ćwiczenia na habituację (kompensacyjne) sprzyjają procesowi kompensacji przedsionkowej przy użyciu powtarzanych ruchów lub bodźców prowokujących32.
Głównym celem niniejszego badania było stwierdzenie, czy łączona terapia VRT-tDCS skutkuje większym złagodzeniem zawrotów głowy i lepszą poprawą funkcji równowagi u osób starszych z przewlekłą dysfunkcją układu przedsionkowego niż sama VRT. W ostatniej dekadzie tDCS była szeroko wykorzystywana w różnych zaburzeniach neurologicznych i neuropoznawczych, m.in. przy depresji, szumach usznych, chorobie Alzheimera, ADHD, w rehabilitacji poudarowej oraz dla poprawiania funkcji poznawczej u osób zdrowych33- 34. W niniejszym badaniu zastosowano bifrontalną tDCS (anoda/katoda nad prawą/lewą grzbietowo-boczną korą przedczołową, czyli DLPFC) w celu złagodzenia objawów przedsionkowych. Wcześniejsze badania wykazały, że bifrontalna tDCS może zmniejszać przepływ obwodowy poprzez modulację neuronalych korelatów funkcji równowagi na różnych poziomach centralnego układu przedsionkowego, prawdopodobnie poprzez mechanizm odgórny36,37.
Zaobserwowano tutaj, że całkowite wyniki DHI w fazach po leczeniu były w obu grupach znacząco obniżone w porównaniu z wynikami wyjściowymi. Redukcja ta była bardziej zaznaczona w grupie VRT-tDCS niż w grupie z samą VRT, co sugeruje, że terapia złożona z szeregu sesji tDCS przynosi korzyści podczas leczenia dysfunkcji układu przedsionkowego u osób starszych. Pozytywny wpływ bifrontalnej tDCS na objawy przedsionkowe u osób starszych można przypisać zwiększonej pobudliwości prawej kory przedczołowej i zmniejszonej pobudliwości lewej kory przedczołowej (biorąc pod uwagę miejsca przyłożenia anody i katody). Obszary DLPFC biorą udział w funkcji poznawczej, funkcji uwagi i pamięci roboczej. Ponadto DLPFC odgrywa kluczową rolę w stabilności posturalnej i planowaniu motorycznym38,39.
Wydaje się, że stymulacja tDCS nad obszarem DLPFC może korzystnie wpływać na centralny układ przedsionkowy podczas interwencji terapeutycznej, zwiększając możliwości nasilania plastyczności synaptycznej i łagodzenia przewlekłych objawów przedsionkowych.
W podobnym badaniu Koganemaru i wsp.17 sprawdzili wyniki leczenia uzyskane przy zastosowaniu VRT połączonej z przezczaszkową stymulacją móżdżku prądem stałym (tcDCS) u pacjentów (n = 16) z przewlekłymi zwrotami głowy wywołanymi dysfunkcją przedsionkową. Jednakże, inaczej niż w niniejszym badaniu, przeprowadzili oni tDCS nad móżdżkiem i częściowo połączyli ją z VRT – pacjenci przez 5 dni przechodzili VRT oraz albo 20-minutową prawdziwą tDCS (2 mA), albo stymulację pozorowaną. Wyniki DHI w grupie tDCS wykazały znaczącą przewagę nad wynikami grupy ze stymulacją pozorowaną. Ustalenia z owego badania także wykazały, że łączona terapia VRT-tDCS wydaje się być obiecującym podejściem terapeutycznym, jeśli chodzi o przewlekłe zawroty głowy w wyniku dysfunkcji przedsionkowej.
Arshad i wsp.40 zbadali wpływ lewej katodalnej tDCS nad korą ciemieniową na modulację funkcji przedsionkowej, by ocenić, czy asymetrie spowodowane przez tDCS w pobudliwości kory ciemieniowej zmodyfikowałyby funkcję przedsionkową. Celem eksperymentu było zrozumienie roli ciemieniowej równowagi między półkulami w przetwarzaniu bodźców przedsionkowych. Autorzy ci donosili, że lewa katodalna tDCS nad korą ciemieniową prowadzi do asymetrycznej modulacji VOR. Odruch VOR stanowi ważny komponent stabilności wzroku podczas ruchów głowy i jest wytwarzany poprzez połączenie danych z układu przedsionkowego i z siatkówki oka. Mimo znaczącego wkładu ośrodków pnia mózgu w VOR kluczowa dla świadomej percepcji pozycji ciała w przestrzeni oraz ewentualnej regulacji odruchów takich jak VOR może być integracja danych wzrokowo- -przedsionkowych wyższego rzędu. Ustalenia z owego badania wykazały, że katodalna tDCS nad lewą korą ciemieniową może zaburzyć równowagę ciemieniową poprzez hamowanie lewej półkuli u osób praworęcznych, co skutkowało asymetryczną supresją odruchu VOR. Wynika z powyższego, że w korowym przetwarzaniu przedsionkowym dominująca jest półkula prawa. Dlatego też do modulacji funkcji przetwarzania przedsionkowego można wykorzystywać tDCS nad odpowiednimi obszarami mózgu. De Moura i wsp.41 przeprowadzili przegląd systematyczny i metaanalizę trzydziestu badań nad skutecznością tDCS odnośnie do kontroli posturalnej, by określić efektywność tej metody, najbardziej odpowiednie obszary docelowe mózgu oraz rezultaty uzyskane w różnych populacjach.
Ich ustalenia wykazały, że tDCS może znacząco poprawiać kontrolę równowagi, a konkretnie redukować obszar przemieszczenia środka nacisku. Efekty tDCS były największe u osób z porażeniem mózgowym (PM) i u zdrowych młodych osób dorosłych. Najczęściej stymulowanymi obszarami były pierwotna kora ruchowa (M1), kora przedczołowa i móżdżek. Analiza efektów tDCS nad różnymi obszarami mózgu wykazała, że najsilniejsze efekty przynosiła stymulacja nad M1. Wyniki odnośnie do móżdżku i kory przedczołowej były rozbieżne. Autorzy doszli do wniosku, że tDCS może poprawiać kontrolę równowagi i że wpływ ten jest najbardziej widoczny u osób zdrowych i z PM. Efekty terapeutyczne były znaczące, gdy tDCS stosowano nad pierwotną korą ruchową41.
Ustalenia z niniejszego badania ujawniły również uzyskaną z czasem po ćwiczeniach VRT poprawę związanej z równowagą pewności siebie w wykonywaniu czynności codziennych (wyniki ABC). Sugeruje to, że tDCS może regulować przedmotoryczną aktywację kory mózgowej podczas terapii i ma korzystny wpływ na równowagę i funkcję kończyn dolnych u zdrowych osób dorosłych42.
Dysfunkcje przedsionkowe u osób starszych mogą prowadzić do różnych problemów psychologicznych, m.in. lęku, depresji i szkód emocjonalnych. Przed rozpoczęciem programu VRT u większości pacjentów z tego badania wynik BAI odpowiadał niskiemu poziomowi lęku. Ustalenia z badania wskazują, że wynik BAI znacząco się obniżył po leczeniu w obu grupach badawczych. Wyniki badania świadczą o tym, że VRT skutecznie leczy zaburzenia przedsionkowe u osób z objawami stresu psychicznego, takimi jak niepokój. Szereg badań donosił, że tDCS poprawia kontrolę poznawczą nad negatywnymi bodźcami takimi jak depresja i objawy zaburzeń psychiatrycznych, jak np. lęk. Przypuszcza się, że bifrontalna tDCS nad DLPFC jest w stanie modulować objawy zawrotów głowy poprzez wzmacnianie kontroli poznawczej nad czołowo-limbicznymi sieciami neuronalnymi43,44. Nie zaobserwowano jednak znaczących różnic między grupami odnośnie do danych BAI w różnych punktach czasowych. Ustalenia niniejszego badania wykazują również, że szereg sesji tDCS to bezpieczna opcja leczenia przewlekłych deficytów przedsionkowych. Powtarzane sesje tDCS były dobrze tolerowane przez wszystkich uczestników badania i żaden z nich nie zgłaszał podrażnienia skóry ani innych efektów ubocznych, jakie skłaniałyby do zaprzestania badania.
Wnioski
Niniejsze badanie sugeruje, że zastosowanie tDCS nad DLPFC może być praktycznym podejściem neuromodulacyjnym do zmniejszania objawów przedsionkowych u osób starszych. Ustalenia te wskazują, że terapia rehabilitacji przedsionkowej połączona z tDCS skutkuje szybką poprawą stanu niepełnosprawności związanej z zawrotami głowy i wzmocnieniem pewności równowagi u osób z przewlekłym zaburzeniem przedsionkowym.
Źródło: Brazilian Journal of Otorhinolaryngology, 2020, doi: 10.1016/j.bjorl.2020.11.004 ©2020 Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico-Facial. Adaptacja: Katarzyna Bogiel Na podstawie licencji CC BY (http://creativecommons.org/ licenses/by/4.0/)
- Swift CG, Iliffe S. Assessment and prevention of falls in older people --- concise guidance. Clin Med. (Lond). 2014;14:658---62.
- Arshad Q, Seemungal BM. Age-related vestibular loss: current understanding and future research directions. Front Neurol. 2016;7:231.
- Serrador JM, Deegan BM, Geraghty MC, Wood SJ. Enhancing vestibular function in the elderly with imperceptible electrical stimulation. Sci Rep. 2018;8:336.
- Rossi-Izquierdo M, Gayoso-Diz P, Santos-Pérez S, Del-RíoValeiras M, Faraldo-García A, Vaamonde-Sánchez-Andrade I, et al. Prognostic factors that modify outcomes of vestibular rehabilitation in elderly patients with falls. Aging Clin Exp Res. 2020;32:223---8.
- Eleftheriadou A, Skalidi N, Velegrakis GA. Vestibular rehabilitation strategies and factors that affect the outcome. Eur Arch Otorhinolaryngol. 2012;269:2309---16.
- Herdman SJ. Vestibular rehabilitation. Curr Opin Neurol. 2013;26:96---101.
- Bayat A, Pourbakht A, Saki N, Zainun Z, Nikakhlagh S, Mirmomeni G. Vestibular rehabilitation outcomes in the elderly with chronic vestibular dysfunction. Iran Red Crescent Med J. 2012;4:705---8.
- Dunlap PM, Holmberg JM, Whitney SL. Vestibular rehabilitation: advances in peripheral and central vestibular disorders. Curr Opin Neurol. 2019;32:137---44.
- Rossi-Izquierdo M, Gayoso-Diz P, Santos-Pérez S, Del-RíoValeiras M, Faraldo-García A, Vaamonde-Sánchez-Andrade I. Short-term effectiveness of vestibular rehabilitation in elderly patients with postural instability: a randomized clinical trial. Eur Arch Otorhinolaryngol. 2017;274:2395---403.
- Bayat A, Mayo M, Rashidi S, Saki N, Yadollahpour A. Repeated sessions of bilateral transcranial direct current stimulation on intractable tinnitus: a study protocol for a double-blind randomized controlled trial. F1000Res. 2018;7:317.
- Nitsche MA, Cohen LG, Wassermann EM, Priori A, Lang N, Antal A, et al. Transcranial direct current stimulation: state of the art 2008. Brain Stimul. 2008;1:206---23.
- Shekhawat GS, Vanneste S. Optimization of transcranial direct current stimulation of dorsolateral prefrontal cortex for tinnitus: a non-linear dose-response effect. Sci Rep. 2018;8: 8311.
- Giordano J, Bikson M, Kappenman ES, Clark VP, Coslett HB, Hamblin MR, et al. Mechanisms and effects of transcranial direct current stimulation. Dose Response. 2017;15:1559325816685467.
- Roche N, Geiger M, Bussel B. Mechanisms underlying transcranial direct current stimulation in rehabilitation. Ann Phys Rehabil Med. 2015;58:214---9.
- de Moura MCDS, Hazime FA, Marotti Aparicio LV, Grecco LAC, Brunoni AR, Hasue RH. Effects of transcranial direct current stimulation (tDCS) on balance improvement: a systematic review and meta-analysis. Somatosen Mot Res. 2019;36:122---35.
- Kumari N, Taylor D, Signal N. The effect of cerebellar transcranial direct current stimulation on motor learning: a systematic review of randomized controlled trials. Front Hum Neurosci. 2019;13:328.
- Koganemaru S, Goto F, Arai M, Toshikuni K, Hosoya M, Wakabayashi T, et al. Effects of vestibular rehabilitation combined with transcranial cerebellar direct current stimulation in patients with chronic dizziness: an exploratory study. Brain Stimul. 2017;10:576---8.
- Poreisz C, Boros K, Antal A, Paulus W. Safety aspects of transcranial direct current stimulation concerning healthy subjects and patients. Brain Res Bull. 2007;72:208---14.
- Paulus W. Transcranial direct current stimulation (TDCS). Suppl Clin Neurophysiol. 2003;56:249---54.
- Yadollahpour A, Mayo M, Saki N, Rashidi S, Bayat A. A chronic protocol of bilateral transcranial direct current stimulation over auditory cortex for tinnitus treatment: dataset from a doubleblinded randomized controlled trial. F1000Res. 2018;7:733.
- Tricco AC, Thomas SM, Veroniki AA, Hamid JS, Cogo E, Strifler L, et al. Comparisons of interventions for preventing falls in older adults: a systematic review and meta-analysis. JAMA. 2017;318:1687---99.
- Ekvall Hansson E, Magnusson M. Vestibular asymmetry predicts falls among elderly patients with multi-sensory dizziness. BMC Geriatr. 2013;13:77.
- Anson E, Jeka J. Perspectives on aging vestibular function. Front Neurol. 2016;6:269.
- Park JJ, Tang Y, Lopez I, Ishiyama A. Age-related change in the number of neurons in the human vestibular ganglion. J Comp Neurol. 2001;431:437---43.
- Andersen BB, Gundersen HJG, Pakkenberg B. Aging of the human cerebellum: a stereological study. J Comp Neurol. 2003;466:356- --65.
- Han BI, Song HS, Kim JS. Vestibular rehabilitation therapy: review of indications, mechanisms, and key exercises. J Clin Neurol. 2011;7:184---96.
- Balaban CD, Hoffer ME, Gottshall KR. Top-down approach to vestibular compensation: translational lessons from vestibular rehabilitation. Brain Res. 2012;1482:101---11.
- Jahn K, Lopez C, Zwergal A, Zur O, Cakrt O, Kellerer S, et al. Vestibular rehabilitation therapy in Europe: chances and challenges. J Neurol. 2019;266:9---10.
- Sherrington C, Fairhall NJ, Wallbank GK, Tiedemann A, Michaleff ZA, Howard K, et al. Exercise for preventing falls in older people living in the community. Cochrane Database Syst Rev. 2019;1. CD012424.
- Avin KG, Hanke TA, Kirk-Sanchez N, McDonough CM, Shubert TE, Hardage J, et al. Management of falls in community-dwelling older adults: clinical guidance statement from the Academy of Geriatric Physical Therapy of the American Physical Therapy Association. Phys Ther. 2015;95:815---34.
- Geraghty AWA, Essery R, Kirby S, Stuart B, Turner D, Little P, et al. Internet-based vestibular rehabilitation for older adults with chronic dizziness: a randomized controlled trial in primary care. Ann Family Med. 2017;15:209---16.
- Alrwaily M, Whitney SL. Vestibular rehabilitation of older adults with dizziness. Otolaryngol Clin North Am. 2011;44:473---96.
- Paulo SB, Roberta F, Sergio PR, Priscila C, Michael N, et al. Effects of transcranial direct current stimulation on working memory in patients with Parkinson’s disease. J. Neurol Sci. 2006;249:31---8.
- Cosmo C, Baptista AF, de Araujo AN, do Rosario RS, Miranda JGV, Montoya P, et al. A randomized, double-blind, shamcontrolled trial of transcranial direct current stimulation in attention-deficit/ hyperactivity disorder. PLoS One. 2015;10: e0135371.
- Knechtel L, Thienel R, Schall U. Transcranial direct current stimulation: neurophysiology and clinical applications. Neuropsychiatry. 2013;3:89---96.
- Merzagora AC, Foffani G, Panyavin I, Mordillo-Mateos L, Aguilar J, Onaral B, et al. Prefrontal hemodynamic changes produced by anodal direct current stimulation. Neuroimage. 2010;49:2304- --10.
- Fritsch B, Reis J, Martinowich K, Schambra HM, Ji Y, Cohen LG, et al. Direct current stimulation promotes BDNF-dependent synaptic plasticity: potential implications for motor learning. Neuron. 2010;66:198---204.
- Forogh B, Madani SP, Rafiei M, Motamed MR, Sajadi S. Effect of repeated sessions of transcranial direct current stimulation on functional balance in Parkinson’s disease: a pilot randomized controlled study. J Neurol Neurosci. 2018;9:250.
- Chan RCK, Shum D, Toulopoulou T, Chen EYH. Assessment of executive functions: review of instruments and identification of critical issues. Arch Clin Neuropsychol. 2008;23: 201---16.
- Arshad Q, Nigmatullina Y, Roberts RE, Bhrugubanda V, Asavarut P, Bronstein AM. Left cathodal trans-cranial direct current stimulation of the parietal cortex leads to an asymmetrical modulation of the vestibular-ocular reflex. Brain Stimul. 2014;7:85---91.
- de Moura MCDS, Hazime FA, Marotti Aparicio LV, Grecco LAC, Brunoni AR, Hasue RH. Effects of transcranial direct current stimulation (tDCS) on balance improvement: a systematic review and meta-analysis. Somatosens Mot Res. 2019;36:122---35.
- Lee YS, Yang HS, Jeong CJ. The effects of transcranial direct current stimulation on functional movement performance and balance of the lower extremities. J Phys Ther Sci. 2012;24:1215---8.
- Palm U, Hasan A, Strube W, Padberg F. tDCS for the treatment of depression: a comprehensive review. Eur Arch Psychiatry Clin Neurosci. 2016;266:681---94.
- Shiozawa P, Leiva AP, Castro C, da Silva D, Cordeiro ME, Fregni Q, et al. Transcranial direct current stimulation for generalized anxiety disorder: a case study. Biol Psychiatry. 2014;75:e17---18.