PEMF w artroplastyce kolana
Sukces chirurgii protetycznej zależy od czynników chirurgicznych (typ, projekt i materiał implantu, umiejętności operatora, plan rehabilitacji) oraz biologicznych (reakcja zapalna, ból, obrzęk tkanek, cechy pacjenta)1-6. Okres po operacji artroplastyki stawu kolanowego często wiąże się z poważną miejscową reakcją zapalną wywołaną przez istniejącą wcześniej chorobę zwyrodnieniową, a zwłaszcza przez samą operację. Pooperacyjna odpowiedź zapalna stanowi podstawę fizjologiczną procesu zdrowienia. Jednakże, jeśli nie jest ona kontrolowana, prowadzi do trwałego uszkodzenia zwłóknieniowego tkanki, skutkując przewlekłym bólem, miejscowym obrzękiem stawu i jego sztywnością7.
Stymulacja biofizyczna przy pomocy impulsowych pól elektromagnetycznych (PEMF – pulsed electromagnetic field) wywiera działanie przeciwzapalne na cały staw. Zmniejsza to uwalnianie czynników katabolicznych i zwiększa wytwarzanie czynników anabolicznych, dzięki czemu stymulowana jest synteza macierzy chrzęstnej, wywierany jest efekt chondroprotekcyjny i wyzwalane działanie troficzne na kość podchrzęstną, co zapobiega sklerotyzacji i ułatwia reabsorpcję obrzęku kostnego8.
Wytwarzanie mediatorów katabolicznych i prozapalnych, takich jak cytokiny, tlenek azotu, prostaglandyna E2 oraz neuropeptydy, w zapalonej błonie maziowej odpowiada bezpośrednio za degenerację macierzy chrzęstnej i objawy kliniczne. Stwierdzono zwłaszcza znaczącą odwrotną korelację między wewnątrzstawowym stężeniem interleukiny-6 (IL-6) stwierdzanym w stawie pacjenta po całkowitej artroplastyce kolana (TKA – total knee arthroplasty) a pooperacyjną funkcjonalną rekonwalescencją pacjenta podczas kontroli w pierwszym miesiącu9. W kontekście wczesnej pooperacyjnej rekonwalescencji funkcjonalnej miejscowa odpowiedź zapalna jest ważniejsza od odpowiedzi układowej.
Pooperacyjna terapia ukierunkowana na maziówkę mogłaby pomóc w łagodzeniu objawów choroby i być może w zapobieganiu progresji strukturalnej choroby zwyrodnieniowej stawu8,10. Błona maziówkowa stanowi obiecujący cel nowych strategii zapobiegania zmianom strukturalnym i leczenia objawów klinicznych.
PEMF działa jak modulator adenozyny i może zwiększać funkcjonalność tego endogennego agonisty. Co ciekawe, w ludzkich fibroblastach maziówkowych dotkniętych chorobą zwyrodnieniową PEMF hamuje uwalnianie prostaglandyny E2 (PGE2), prozapalnych cytokin interleukiny-6 (IL-6) i interleukiny-8 (IL-8), podczas gdy jednocześnie stymuluje uwalnianie interleukiny-10 (IL-10), cytokiny przeciwzapalnej; efekty te zachodzą za pośrednictwem wywołanego przez PEMF zwiększenia aktywności receptorów adenozyny A2A i A311. Co więcej, PEMF przeciwdziała wpływowi interleukiny-1β (IL-1β), nasilając w ten sposób syntezę proteoglikanów i proliferację chondrocytów, działając wraz z insulinopodobnym czynnikiem wzrostu-1 (IGF-1) obecnym w mazi stawowej i w chrząstce stawowej; odgrywa on kluczową rolę jako anaboliczny czynnik wzrostu, kontrolujący metabolizm stawu12.
W ostatnich kilku latach przeprowadzono szereg badań nad wykorzystaniem PEMF po zabiegach chirurgicznych stawów, takich jak abrazja i/lub perforacja chrząstki, autologiczna implantacja chondrocytów ze wspomaganiem macierzy, osadzenie komórek ze szpiku kostnego na rusztowaniu kolagenowym, rekonstrukcja więzadła krzyżowego przedniego i alloplastyka stawu kolanowego. Wykazały one, że PEMF prowadzi do znacząco większego i szybszego złagodzenia pooperacyjnych objawów bólowych (mierzonych przy pomocy Wizualnej Skali Analogowej VAS) już w pierwszym miesiącu po operacji i skutkuje znaczącą różnicą w porównaniu z grupą kontrolną podczas kontroli długoterminowej13-16.
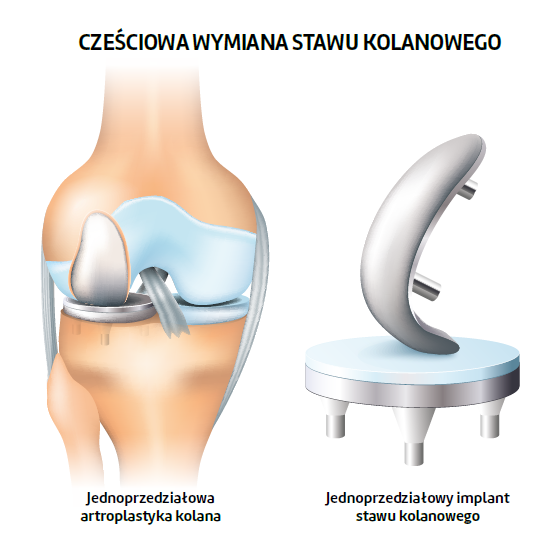
Głównym celem niniejszego prospektywnego randomizowanego badania kontrolowanego było przeprowadzenie klinicznej oceny ulgi w bólu u pacjentów przechodzących przyśrodkową jednoprzedziałową artroplastykę kolana (UKA – unicompartmental knee arthroplasty) z protezą typu mobile-bearing wraz ze stymulacją PEMF w porównaniu z grupą kontrolną. Celem drugorzędnym było oszacowanie funkcjonalnej i klinicznej poprawy stawu kolanowego podczas wizyt po 1, 2, 6, 12 i 36 miesiącach. Postawiono hipotezę, że u pacjentów leczonych przy pomocy impulsowych pól elektromagnetycznych będzie występował mniejszy ból na wizytach kontrolnych niż u pacjentów z grupy kontrolnej.
Kryteria włączające obejmowały: wiek w przedziale 60-85 lat, przewlekły i upośledzający ból kolana, choroba zwyrodnieniowa przyśrodkowego przedziału kolana z deformacją koślawą lub szpotawą nie przekraczającą 3 stopni, zakres ruchu większy niż 100 stopni, przykurcz zginania mniejszy niż 10 stopni, integralność więzadła krzyżowego przedniego i tylnego i nienaruszona łąkotka boczna. Kryteria wykluczające obejmowały: przebycie infekcji kolana, alloplastykę stawu biodrowego, obrzęk szpiku kostnego w przyśrodkowym przedziale kolana, reumatoidalne zapalenie stawów, choroby autoimmunologiczne i ogólnoustrojowe, guzy, poważne zniekształcenia, indeks masy ciała (BMI) przekraczający 30 kg/m2, przejście operacji rewizyjnej lub wcześniejszej operacji chorego kolana (z wyjątkiem artroskopowego usunięcia łąkotki).
Biofizyczna stymulacja kolana
Pacjentom z grupy eksperymentalnej polecono stosować PEMF przez 4 godziny dziennie, niekoniecznie w sposób ciągły, przez 60 dni. Leczenie rozpoczynało się 3-7 dni po operacji i było przeprowadzane w domu lub podczas rehabilitacji. Urządzenie PEMF wytwarzało impulsowy sygnał o szczytowym natężeniu 1,5 mT i częstotliwości 75 Hz, a cewkę umieszczano na zoperowanym kolanie. Pacjenci mogli nosić na sobie urządzenie (zasilane baterią) podczas dnia lub nocy i zalecono im, by przerywali leczenie w razie wystąpienia efektów niepożądanych, takich jak podrażnienie skóry lub pieczenie. Urządzenie rejestrowało czas stosowania go przez pacjentów.
Procedura chirurgiczna i rehabilitacja stawu kolanowego
Wszystkie operacje przeprowadził ortopeda posiadający doświadczenie w operacjach wymiany stawu kolanowego, przy zastosowaniu minimalnie inwazyjnej techniki u wszystkich pacjentów. U każdego z nich zaimplantowano jednoprzedziałową endoprotezę Oxford typu mobile-bearing18. Podczas procedury stosowano podejście przyśrodkowe okołorzepkowe bez przemieszczenia rzepki. W obu grupach pacjentów obowiązywał ten sam protokół rehabilitacji, obejmujący bierną mobilizację od pierwszego dnia po operacji oraz progresywną czynną mobilizację stawu i wspomagane chodzenie przy użyciu dwóch kul ortopedycznych począwszy od drugiego dnia. Ogólnie każdemu pacjentowi zalecano zwiększanie obciążenia podczas chodzenia, a następnie przeprowadzano izometryczne ćwiczenia wzmacniające mięśnie, póki pacjent nie porzucał zupełnie pomocy do chodzenia.
Ocena kliniczna pacjentów po artroplastyce kolana
Kontrolne wizyty kliniczne przeprowadzali dwaj niezależni klinicyści, którzy nie brali udziału w operacji. Pacjentów poddawano ocenie przed operacją i później w punktach czasowych 1, 2, 6, 12 i 36 miesięcy (+/- 5 dni) po operacji. Ocena kliniczna obejmowała Wizualną Skalę Analogową (VAS) dla pomiaru bólu, Oxford Knee Score (OKS – oksfordzka skala oceny stawu kolanowego) oraz kwestionariusz na temat zdrowia Short Form 36 (SF-36)19-21. Obrzęk kolana oceniano poprzez pomiar obwodu kolana na wysokości środka rzepki w pozycji na wznak przy użyciu zwykłej taśmy mierniczej i oceniano zgodnie z wytycznymi Soderberga i wsp.22 przy zastosowaniu następującej punktacji: 40 – brak różnicy obwodu kolana; 30 – mniej niż 0,5 cm; 20 – w zakresie 0,5-1 cm; 10 – w zakresie 1-1,5 cm; 0 – różnica większa niż 1,5 cm. Dla subiektywnej oceny obrzęku użyto pytań z sekcji 2. kwestionariusza Cincinnati Rating System Questionnaire dotyczącej obrzęku stawów; dostępne odpowiedzi mieściły się w zakresie od 0 (poważny problem cały czas, przy prostych czynnościach związanych z chodzeniem) do 10 (brak obrzęku)23. Stosowanie niesterydowych leków przeciwzapalnych (NLPZ) przepisywanych przez lekarza po operacji rejestrowano podczas każdej wizyty kontrolnej. Podczas wizyty po trzech latach od operacji przeprowadzono ankietę w celu sprawdzenia, czy u pacjentów utrzymuje się ból, ograniczenia codziennych czynności i stosowanie NLPZ, odnotowywano także występujące powikłania.
Odsetek zadowolenia pacjentów po artroplastyce kolana
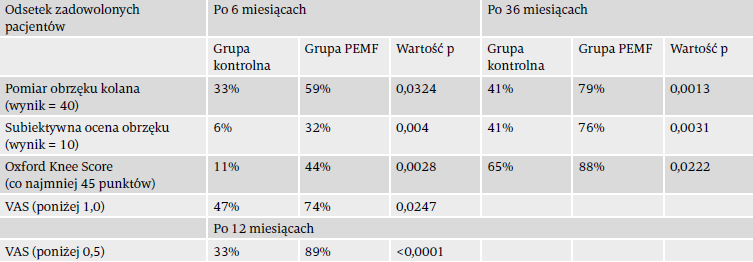
Do oceny, czy użycie stymulacji biofizycznej było w stanie zwiększyć odsetek pacjentów uzyskujących maksymalny poziom zadowolenia po tak uznanej formie leczenia, jaką jest UKA, wyliczono w obu grupach odsetek pacjentów, którzy podczas oceny klinicznej 6 miesięcy i 12 miesięcy po operacji osiągnęli wcześniej zdefiniowany próg wyniku każdego z pomiarów.
Ustalono następujące progi odzwierciedlające maksymalną satysfakcję z leczenia: dla pomiaru obwodu – 40 punktów; dla subiektywnej oceny obrzęku – 10 punktów; dla wyniku skali oksfordzkiej wynik równy co najmniej 45; dla skali VAS – poniżej 1 po 6 miesiącach i poniżej 0,5 po 12 miesiącach24.
Wyniki badań skuteczności PEMF po jednoprzedziałowej artroplastyce kolana
Do badania zrekrutowano 72 pacjentów ze wskazaniem do UKA. Spośród 36 pacjentów przydzielonych do grupy z PEMF podczas kontroli po miesiącu 2 odpadło z powodów osobistych. Spośród 36 pacjentów z grupy kontrolnej także utracono 2. W momencie wyjściowym obie grupy były jednorodne odnośnie do wieku, płci, masy ciała, wzrostu, statusu palacza, VAS, obwodu kolana, subiektywnej oceny obrzęku i oksfordzkiej skali oceny stawu kolanowego. Jedyną statystycznie znaczącą różnicę między grupami zaobserwowano w wynikach kwestionariusza SF-36, który był wyższy w grupie leczonej. Pacjenci z grupy PEMF korzystali z urządzenia PEMF średnio przez 155 godzin.
VAS po artroplastyce kolana
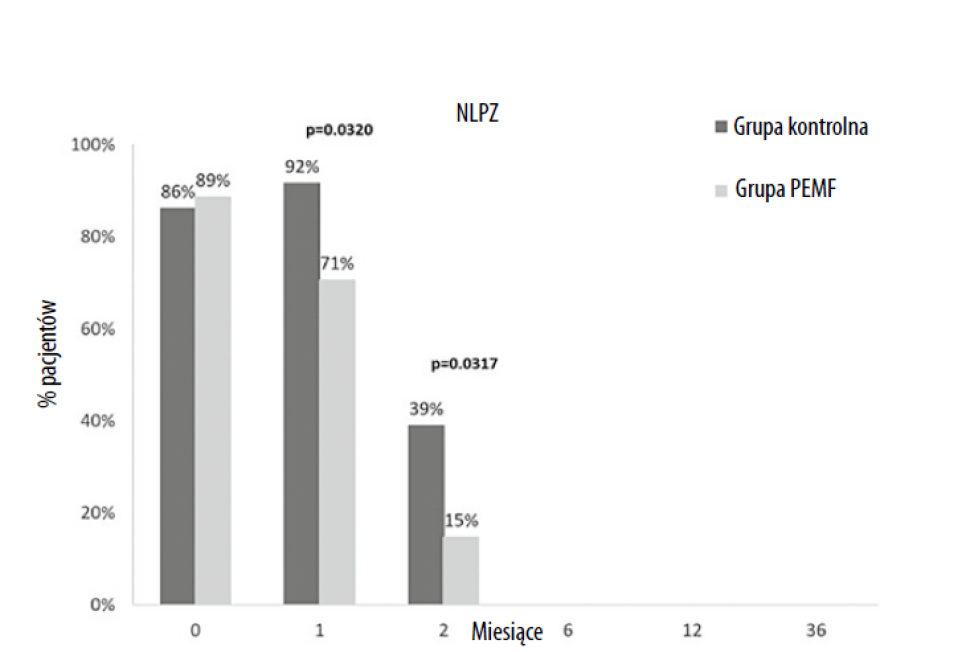
Ból przedoperacyjny w obu grupach był taki sam. Jak wykazano w tabeli 1, wartość VAS zmniejszała się podczas kolejnych wizyt kontrolnych w obu grupach, a statystycznie znaczącą różnicę między grupami zaobserwowano podczas wizyt kontrolnych 6 miesięcy po operacji (0,8 vs 0,6), 12 miesięcy po operacji (0,6 vs 0,3) oraz 36 miesięcy po operacji (0,6 vs 0,5) – na korzyść grupy PEMF. Użycie NLPZ Miesiąc po UKA odsetek pacjentów korzystających z NLPZ wyniósł 71% w grupie PEMF i 92% w grupie kontrolnej (ryc. 1). Na wizycie po 2 miesiącach zaobserwowano znaczący spadek konieczności korzystania z leków: używało ich 15% pacjentów z grupy z PEMF i 39% pacjentów z grupy kontrolnej. Po 6, 12, 36 miesiącach żaden z pacjentów nie potrzebował NLPZ.
Obrzęk po artroplastyce kolana
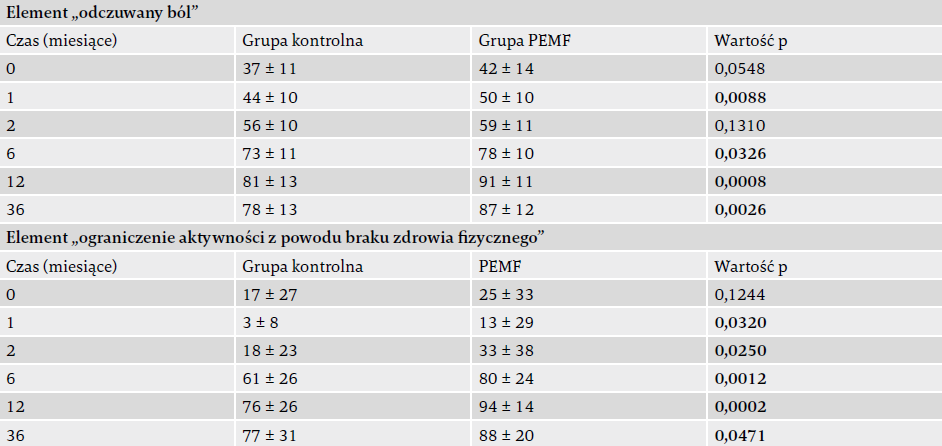
Obiektywna ocena obwodu kolana, przeprowadzona zgodnie z wytycznymi Soderberga i wsp.22, wykazała statystycznie znaczącą różnicę po 6 (32,8 vs 35,6), 12 (34,2 vs 37,9) i 36 miesiącach (34,1 vs 37,9) – wyższe wartości punktacji, a co za tym idzie mniejszy obrzęk występował w grupie PEMF. Subiektywna ocena obrzęku wykazała statystycznie znaczące różnice po 2 (4,0 vs 5,6), 6 (7,1 vs 8,4), 12 (8,2 vs 9,2) i 36 miesiącach (8,6 vs 9,5) od operacji, przy czym wyższe, a co za tym idzie korzystniejsze wartości wystąpiły w grupie PEMF. Szczegóły przedstawia tabela 1. Podczas wszystkich wizyt kontrolnych w grupie PEMF zaobserwowano mniejszy ból, mniejsze wykorzystanie NLPZ i lepsze wyniki kliniczne oraz większe zadowolenia z leczenia (…).
czasowych
Oksfordzka skala oceny stawu kolanowego w ocenie zastosowania PEMS po artroplastyce kolana
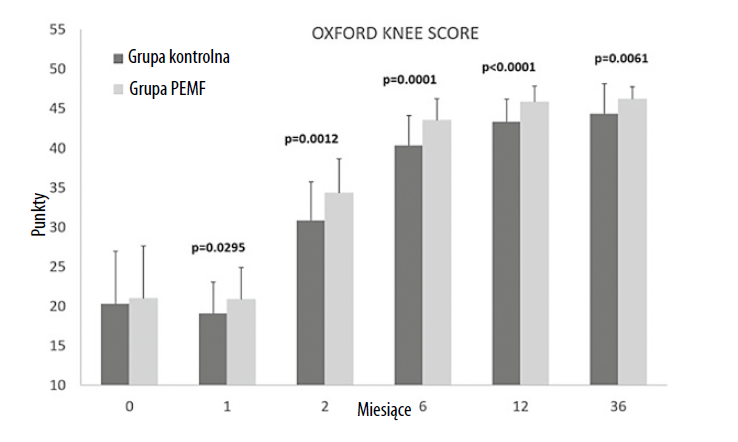
Wynik w skali Oxford Knee Score wykazał znacząco wyższe wyniki w grupie PEMF podczas wszystkich wizyt kontrolnych w porównaniu z grupą kontrolną, wskazując na lepszy stan pacjentów z tej pierwszej grupy (ryc. 2). Po jednym miesiącu od operacji średni wynik OKS wyniósł 20,9 w grupie PEMF i 19,0 w grupie kontrolnej; po 2 miesiącach wyniósł odpowiednio 34,3 vs 30,8; po 6 miesiącach wyniósł 43,5 vs 40,3, a po 12 miesiącach wyniósł 45,9 w grupie PEMF i 43,4 w grupie kontrolnej. Na ostatniej wizycie kontrolnej, po 36 miesiącach, średni wynik OKS wyniósł 46,2 w grupie PEMF i 44,3 w grupie kontrolnej (wartość p 0,0122).
kontrolnej były lepsze w grupie leczonej.
Kwestionariusz SF-36: odczuwany ból i ograniczenie aktywności z powodu braku zdrowia fizycznego
Statystyczną różnicę między grupami odnotowano w momencie wyjściowym, co przełożyło się także na znacząco wyższy wynik w grupie PEMF podczas każdej z wizyt kontrolnych. Z tego powodu osobnej ocenie poddano dwa konkretne punkty kwestionariusza SF-36: odczuwany ból i ograniczenie aktywności z powodu braku zdrowia fizycznego. Szczegóły ukazuje tabela 2. Wyższa punktacja oznacza mniejszy ból i mniej ograniczeń aktywności. Wyniki odczuwanego bólu wykazały znaczącą poprawę w grupie PEMF podczas każdej wizyty kontrolnej z wyjątkiem wizyty dwa miesiące po operacji (p = 0,131 – różnica nieznacząca statystycznie), co zgadzało się z oceną przeprowadzoną przy pomocy skali VAS. Wynik odnoszący się do aktywności był statystycznie lepszy w grupie PEMF podczas każdej wizyty kontrolnej.
fizycznego” w kwestionariuszu SF-36
Stopień satysfakcji z leczenia po artroplastyce kolana
Znaczące statystycznie różnice między grupami odnotowano podczas wizyt po 6 i 36 miesiącach, z większym odsetkiem osób zadowolonych z leczenia w grupie PEMF. Szczegółowe wyniki zawiera tabela 3.
Powikłania po zastosowaniu PEMF po artroplastyce kolana
Podczas wizyt kontrolnych nie stwierdzono żadnych niepożądanych efektów ubocznych stosowania terapii PEMF.
Omówienie badania zastosowania PEMF po artroplastyce kolana
Głównym celem niniejszego randomizowanego badania kontrolowanego było oszacowanie ulgi w bólu u pacjentów po przejściu operacji UKA z wszczepieniem protezy typu mobile-bearing oraz stymulacji przy pomocy PEMF w porównaniu z grupą bez stymulacji. Podczas wszystkich wizyt kontrolnych w grupie PEMF zaobserwowano mniejszy ból, mniejsze wykorzystanie NLPZ i lepsze wyniki kliniczne oraz większe zadowolenia z leczenia (obiektywna i subiektywna ocena obrzęku, SF-36 oraz OKS).
Niniejsze badanie ujawniło, że zastosowanie PEMF po UKA może poprawiać wyniki po tego typu operacjach; w rzeczy samej, mimo osiągniętego w ostatnich dekadach postępu i udowodnionych zalet minimalnie inwazyjnej UKA ortopedzi często niechętnie decydują się na przeprowadzanie tej procedury, mimo istniejących wskazań.
Najprawdopodobniej wynika to z obaw związanych z przeżywalnością, doborem pacjentów, idealnym modelem protezy oraz rozsądnym korzystaniem z zaawansowanych technologii25.
Jak donoszą Mathis i wsp. w kontekście alloplastyki stawu kolanowego (TKA – total knee arthroplasty), jeśli znane są przyczyny dolegliwości występujących po UKA, na wczesnym etapie, zanim ból stanie się przewlekły, można podjąć odpowiednią decyzję co do leczenia26. Zgodnie z tym stwierdzeniem terapia PEMF może stanowić ważny element uzupełniający rehabilitacji pooperacyjnej w profilaktyce przewlekłego bólu poprzez zapobieganie szkodliwym efektom stanu zapalnego wywołanego przez UKA w tkankach stawu i może ona przynosić pacjentom krótko- i długoterminowe korzyści. Jak stwierdza inny autor14, PEMF można uznać za część leczenia chirurgicznego i pooperacyjnego.
Dane z szeregu raportów z badań donoszących o przeżywalności po przyśrodkowej UKA wskazują, że 10-letnia przeżywalność wynosi 93-98% przy subiektywnej ocenie od dobrej do doskonałej27-29. Jednakże te zadowalające wyniki są wyższe od tych, jakie wynikają z najnowszych globalnych i krajowych rejestrów, które podają odsetek 10-letniej przeżywalności w zakresie 81% do 88%28.
Niedawno Barker wykazał, że ból kolana jest częstszą przyczyną rewizji po jednoprzedziałowej artroplastyce niż po alloplastyce kolana, jednak przyczyny tego zjawiska pozostają niejasne29. Jako że inne przyczyny niepowodzenia pozostają na takim samym poziomie w badaniach kohortowych i opartych na rejestrach, ewentualnym wyjaśnieniem może być fakt, że u niektórych pacjentów z niewyjaśnionym bólem występuje (wczesna) progresja choroby zwyrodnieniowej stawów. Park i wsp. odkryli, że u niektórych pacjentów z niewyjaśnionym bólem progresja choroby zwyrodnieniowej w pozostałych przedziałach kolana nie była widoczna na badaniach rentgenowskich, ale zawsze uwidoczniała się na badaniu rezonansem magnetycznym, przy czym u aż 82% z nich występował stopień 3. (na cztery) choroby zwyrodnieniowej. Może to wskazywać, że w niektórych przypadkach niewyjaśniony ból może wynikać z progresji choroby zwyrodnieniowej, której występowanie jest częstsze od spodziewanego30.
W niniejszym badaniu wykazano znaczący spadek bólu (VAS) po zastosowaniu PEMF w okresie katamnezy, co wiązało się ze zmniejszonym ryzykiem niepowodzenia ze względu na ból i zwiększonym odsetkiem pacjentów uzyskujących maksymalny poziom zadowolenia z leczenia.
Wedle wiedzy autorów jest to pierwsze randomizowane badanie kontrolowane analizujące i podające wyniki na temat zastosowania PEMF po operacji UKA z wszczepieniem protezy typu mobile-bearing, choć szereg raportów potwierdził już skuteczność tej formy leczenia po operacji ortopedycznej13,14,31. Dotyczy to zwłaszcza Adravantiego i wsp. (2014), którzy porównali wyniki 33 pacjentów przechodzących TKA, przydzielonych losowo do grupy kontrolnej lub grupy PEMF. Terapię PEMF przeprowadzano 4 godziny dziennie przez 60 dni po operacji. Pacjentów oceniano przed operacją, a następnie 1, 2 i 6 miesięcy po operacji przy pomocy międzynarodowych skal14. Miesiąc po TKA oceniono poziom bólu (VAS) i obrzęk kolana i okazało się, że wyniki funkcjonalne skali Knee Society Score (KSS) były znacząco lepsze w grupie PEMF niż w grupie kontrolnej.
Czy PEMF zmniejsza ból po artroplastyce kolana
Ulga w bólu była znacząca statystycznie w obu grupach w porównaniu z poziomem przedoperacyjnym po miesiącu od TKA, choć bardziej zaznaczona w grupie leczonej (-61% w grupie PEMF i -26% w grupie kontrolnej). Ból był znacząco mniejszy w grupie PEMF także po 6 miesiącach, gdzie spadek bólu od momentu wyjściowego wyniósł 90%. Ponadto trzy lata po operacji u znacząco mniejszej liczby pacjentów z grupy PEMF niż z grupy kontrolnej dochodziło do poważnego bólu i ograniczeń w chodzeniu14.
Wcześniej Moretti i wsp. starali się ustalić, czy terapia PEMF może być użyta w celu ograniczenia bólu i wsparcia rekonwalescencji pacjentów po TKA13. Podczas oceny przedoperacyjnej nie zaobserwowano różnic między grupami odnośnie do żadnych parametrów oprócz wyniku funkcjonalnego. W grupie PEMF wynik funkcjonalny skali Knee Society Score był znacząco wyższy podczas wizyt kontrolnych w ciągu 12 miesięcy niż w grupie kontrolnej. Znaczące różnice między grupami zaobserwowano także w stosunku do kwestionariusza SF-36 – na korzyść grupy PEMF. Ponadto wartości VAS były znacząco niższe w grupie eksperymentalnej niż w grupie kontrolnej podczas wszystkich wizyt kontrolnych. W grupie PEMF zaobserwowano zmniejszone użycie NLPZ, a obrzęk stawu ustępował szybciej niż w grupie kontrolnej. Efekt terapii PEMF utrzymywał się także po jej zakończeniu13. Badanie to potwierdziło, że po TKA należy rozważyć terapię PEMF w celu zapewnienia ulgi w bólu i przyspieszenia rekonwalescencji funkcjonalnej poprzez zapobieganie reakcji zapalnej wywołanej przez zabieg.
W 2019 r. La Verde i wsp. przeprowadzili randomizowane prospektywne badanie kontrolowane nad efektami PEMF po odwróconej endoprotezoplastyce stawu barkowego i stwierdzili, że w grupie PEMF w porównaniu z grupą kontrolną wynik skali Constant Shoulder Score (CSS) był lepszy, a poziom bólu (VAS) był niższy po jednym, dwóch i trzech miesiącach od zabiegu. Podczas kontroli po 6 miesiącach nie stwierdzono już znaczących różnic między grupami32.
Jako że jedną z głównych przyczyn niepowodzenia jednoprzedziałowej artroplastyki kolana jest progresja choroby zwyrodnieniowej w pozostałym przedziale, zastosowanie terapii PEMF po UKA wiąże się nie tylko z ulgą w bólu, ale także z przeciwdziałaniem degeneracji w pozostałym przedziale, jakiej sprzyja mikrośrodowisko zapalne w stawie.
Niedawny przegląd systematyczny 15 badań przyniósł wyniki, które stoją w zgodzie z niniejszym badaniem – terapia PEMF w porównaniu z placebo miała korzystny wpływ na ból, sztywność i sprawność fizyczną pacjentów z chorobą zwyrodnieniową stawów33.
Podobne wyniki uzyskali Viganò i wsp., których analiza 13 badań obejmujących 914 pacjentów oceniała wpływ leczenia polem elektromagnetycznym na objawy choroby zwyrodnieniowej stawu kolanowego przy użyciu VAS i/lub skali Western Ontario McMaster Universities Osteoarthritis Index (WOMAC). Po leczeniu zaobserwowano ogólny spadek bólu34.
Jak PEMF oddziałowuje na tkankę kostną i chrzęstną?
By lepiej zrozumieć kliniczną skuteczność PEMF po wymianie stawu ważne jest przeanalizowanie wpływu tej metody na mikrośrodowisko stawu, a zwłaszcza na tkankę kostną i chrzęstną. Jeśli chodzi o chrząstkę, terapia PEMF nasila dyferencjację chondrogeniczną mezenchymalnych komórek macierzystych (MSC – mesenchymal stem cells) poprzez bezpośrednią aktywację chondrogenicznych ścieżek sygnałowych i pośredni mechanizm parakrynny mediowany przez sekretom MSC. Dzięki temu PEMF może być stosowana jako terapia pomocnicza zwiększająca ekspresję genów związanych z tkanką chrzęstną oraz nasilająca chondrogeniczną dyferencjację MSC w celu pokonania przeszkód używania czynników wzrostu in vivo11. Po drugie, stymulacja PEMF może również działać jako sygnał chemotaktyczny dla MSC i chondrocytów, sprzyjający migracji komórek do miejsca urazu w celu nasilenia naprawy tkanki. Po trzecie, PEMF ma silne działanie przeciwzapalne i działanie chondroprotekcyjne na tkankę chrzęstną, która ulega degeneracji z powodu aktywności katabolicznej cytokin prozapalnych11.
Pozytywny wpływ na wzrost kości może wynikać zarówno z podstawowego działania PEMF na kość, jak i działania indukowanego w wyniku zwiększonego wzrostu naczyń, wtórnie do uwalniania czynników angiogenicznych, takich jak IL-8, zasadowy czynnik wzrostu fibroblastów (bFGF – basic fibroblast growth factor), czynnik wzrostu śródbłonka naczyniowego (VEGF – vascular endothelial growth factor) oraz syntazy tlenku azotu. Dodatkowo PEMF skutecznie zwiększyła ilość nowej tkanki kostnej wokół porowatych implantów z hydroksyapatytu w proksymalnej piszczeli królików, choć przy implantach z fosforanu wapnia wykryto pewne nieznaczące efekty, co prawdopodobnie wiązało się z innym rozmiarem porów (im większa średnica, tym większa skuteczność stymulacji)11,35.
Czy PEMF może ograniczyć stosowanie NLPZ?
Ostatnim ustaleniem niniejszego badania jest znaczący spadek stosowania leków, zwłaszcza NLPZ, wiążący się z terapią PEMF. Podczas analizy tych danych niezbędne jest oszacowanie socjoekonomicznych implikacji związanych z mniejszą konsumpcją leków; w rzeczy samej występowanie przewlekłego bólu po operacji artroplastyki kolana jest różne w poszczególnych badaniach i dotyka około 15-20% pacjentów w ciągu 1-7 lat od zabiegu36-38. W oparciu o jakościowe częściowo ustrukturyzowane wywiady Woolhead i wsp. donosili, że wysoki odsetek pacjentów uskarżał się na ból w okresie pooperacyjnym, mimo że 90% z nich było zadowolonych z wyników zabiegu39.
Ograniczenia badania wpływu PEMF po artroplastyce kolana
Przyszłe badania powinny przeanalizować, czy terapia PEMF powinna być rozwiązaniem stosowanym w celu zmniejszania przewlekłego bólu pooperacyjnego, by ograniczyć konsumpcję leków, przyspieszać rekonwalescencję i, co najważniejsze, wyeliminować efekty uboczne długoterminowego stosowania NLPZ. Ograniczeniem tego badania jest brak grupy placebo. Jednakże należy podkreślić, że wszystkie oceny kliniczne zostały przeprowadzone przez lekarzy nieświadomych przydziału pacjenta do grupy. Ponadto różnicę między grupami w momencie wyjściowym odnośnie do wyników kwestionariusza SF-36 tłumaczyć może ograniczona liczba pacjentów. Obawy budziła kwestia stosowania się pacjentów do zaleceń, ponieważ korzystanie z urządzenia PEMF 4 godziny dziennie przez 60 dni wymagało znacznego zaangażowania. Ostatnim ograniczeniem badania jest wykorzystanie zmodyfikowanego kwestionariusza Cincinnati Rating System Questionnaire do oceny satysfakcji pacjentów, ponieważ nie jest to skala zweryfikowana.
Wnioski dotyczące stosowania PEMF po artroplastyce kolana
Niniejsze badanie jest pierwszym analizującym terapię PEMF po przyśrodkowej jednoprzedziałowej artroplastyce stawu kolanowego. Wykazuje ono, że leczenie PEMF jest dobrze tolerowane i nie wiąże się z niepożądanymi efektami ubocznymi. Co więcej, stosowanie PEMF prowadzi do znaczącej poprawy klinicznej, takiej jak zmniejszenie bólu, ograniczenie konsumpcji NLPZ, mniejszy obrzęk i wyższy odsetek pacjentów, którzy osiągnęli maksymalny poziom zadowolenia z leczenia przy pomocy udokumentowanej i szeroko akceptowanej metody leczenia chirurgicznego, jaką jest UKA.
Źródło: Journal of ISAKOS. 2022 May 25; S2059-7754(22)00065-7 ©2022 The Authors Adaptacja: Katarzyna Bogiel Na podstawie licencji CC BY (http://creativecommons.org/ licenses/by/4.0/)
- Canovas F, Dagneaux L. Quality of life after total knee arthroplasty. Orthop Traumatol Surg Res 2018;104(1S):S41–6. https://doi.
org/10.1016/j.otsr.2017.04.017. - Tyagi V, Farooq M. Unicompartmental knee arthroplasty: indications, outcomes, and complications. Conn Med 2017;81(2):87–
90. pmid:29738151. - D’Ambrosi R, Anghilieri FM, Corona K, Mariani I, Valli F, Ursino N, et al. Similar rates of return to sports and BMI reduction regardless of age, gender and preoperative BMI as seen in matched cohort of hypoallergenic and standard Cobalt Chromium medial unicompartmental knee arthroplasty. Knee Surg Sports Traumatol Arthrosc 2022 Mar;30(3):890–8. https://doi.org/10.1007/
s00167-021-06467-1. - Arirachakaran A, Choowit P, Putananon C, Muangsiri S, Kongtharvonskul J. Is unicompartmental knee arthroplasty (UKA)
superior to total knee arthroplasty (TKA)? A systematic review and meta-analysis of randomized controlled trial. Eur J Orthop
Surg Traumatol 2015;25(5):799–806. https://doi.org/10.1007/ s00590-015-1610-9. - Mittal A, Meshram P, Kim WH, Kim TK. Unicompartmental knee arthroplasty, an enigma, and the ten enigmas of medial UKA.
J Orthop Traumatol 2020;21(1):15. https://doi.org/10.1186/ s10195-020-00551-x. - Postler A, Lützner C, Beyer F, Tille E, Lützner J. Analysis of total knee arthroplasty revision causes. BMC Musculoskelet Disord
2018;19(1):55. https://doi.org/10.1186/s12891-018-1977-y. - Langkilde A, Jakobsen TL, Bandholm TQ, Eugen-Olaen J, Blauenfeldt T, Petersen J, et al. Inflammation and post-operative
recovery in patients undergoing total knee arthroplasty-secondary analysis of a randomized controlled trial. Osteoarthritis
Cartilage 2017;25(8):1265–73. https://doi.org/10.1016/j. joca.2017.03.008. - Paish HL, Baldock TE, Gillespie CS, Del Carpio Pons A, Mann DA, Deehan DJ, et al. Chronic, active inflammation in patients with
failed total knee replacements undergoing revision surgery. J Orthop Res 2019;37(11):2316–24. https://doi.org/10.1002/
jor.24398. - Prince N, Penatzer JA, Dietz MJ, Boyd JW. Localized cytokine responses to total knee arthroplasty and total knee revision complications. J Transl Med 2020;8(1):330. https://doi.org/10.1186/ s12967-020-02510-w.
- Sellam J, Berenbaum F. The role of synovitis in pathophysiology and clinical symptoms of osteoarthritis. Nat Rev Rheumatol
2010;6(11):625–35. https://doi.org/10.1038/nrrheum.2010.159. - Varani K, Vincenzi F, Ravani A, Pasquini S, Merighi S, Gessi S, et al. Adenosine receptors as a biological pathway for the anti-inflammatory and beneficial effects of low frequency low energy pulsed electromagnetic fields. Mediators Inflamm 2017; 2017:2740963. https://doi.org/10.1155/2017/2740963.
- De Mattei M, Pellati A, Pasello M, Ongaro A, Setti S, Massari L, et al. Effects of physical stimulation with electromagnetic
field and insulin growth factor-I treatment on proteoglycan synthesis of bovine articular cartilage. Osteoarthritis
Cartilage 2004;12(10):793–800. https://doi.org/10.1016/j. joca.2004.06.012. Moretti B, Notarnicola A, Moretti L, Setti S, De Terlizzi F, Pesce V, et al. I-ONE therapy in patients undergoing total knee arthroplasty: a prospective, randomized and controlled study. BMC
Musculoskelet Disord 2012;13:88. https://doi.org/10.1186/1471- 2474-13-88. - Adravanti P, Nicoletti S, Setti S, Ampollini A, de Girolamo L. Effect of pulsed electromagnetic field therapy in patients undergoing
total knee arthroplasty: a randomised controlled trial. Int Orthop 2014;38(2):397–403. https://doi.org/10.1007/s00264-013-
2216-7. - Collarile M, Sambri A, Lullini G, Cadossi M, Zorzi C. Biophysical stimulation improves clinical results of matrix-assisted autologous
chondrocyte implantation in the treatment of chondral lesions of the knee. Knee Surg Sports Traumatol Arthrosc 2018;26(4):1223–
9. https://doi.org/10.1007/s00167-017-4605-8. - Benazzo F, Zanon G, Pederzini L, Modonesi F, Cardile C, Falez F, et al. Effects of biophysical stimulation in patients undergoing
arthroscopic reconstruction of anterior cruciate ligament: prospective, randomized and double blind study. Knee Surg Sports Traumatol Arthrosc 2008;16(6):595–601. https://doi.org/10.1007/s00167-008-0519-9. - Cuschieri S. The CONSORT statement. Saudi J Anaesth 2019;13(Suppl 1):S27–30.https://doi.org/10.4103/sja. SJA_559_18.
- Zhang Q, Zhang Q, Guo W, Liu Z, Cheng L, Yue D, et al. The learning curve for minimally invasive Oxford phase 3 unicompartmental knee arthroplasty: cumulative summation test for learning curve (LC-CUSUM). J Orthop Surg Res 2014;9:81. https://doi.org/10.1186/s13018-014-0081-8.
- Heller GZ, Manuguerra M, Chow R. How to analyze the visual Analogue scale: myths, truths and clinical relevance. Scand J Pain 2016;13:67–75. https://doi.org/10.1016/j.sjpain.2016.06.012.
- Padua R, Zanoli G, Ceccarelli E, Romanini E, Bondì R, Campi A. The Italian version of the Oxford 12-item Knee Questionnaire-cross-cultural adaptation and validation. Int Orthop 2003;27(4):214–6. https://doi.org/10.1007/s00264-003-0453-x.
- Apolone G, Mosconi P. The Italian SF-36 Health Survey: translation, validation and norming. J Clin Epidemiol 1998;51(11):1025–36. https://doi.org/10.1016/s0895-4356(98)00094-8.
- Soderberg GL, Ballantyne BT, Kestel LL. Reliability of lower extremity girth measurements after anterior cruciate ligament reconstruction. Physiother Res Int 1996;1(1):7–16. https://doi.org/10.1002/pri.43.
- Agel J, LaPrade RF. Assessment of differences between the modified Cincinnati and International Knee Documentation Committee patient outcome scores: a prospective study. Am J Sports Med 2009;37(11):2151–7. https://doi.org/10.1177/0363546509337698.
- Downie WW, Leatham PA, Rhind VM, Wright V, Branco JA, Anderson JA. Studies with pain rating scales. Ann Rheum Dis 1978;37(4):378–81.
- Johal S, Nakano N, Baxter M, Hujazi I, Pandit H, Khanduja V. Unicompartmental knee arthroplasty: the past, current controversies,
and future perspectives. J Knee Surg 2018;31(10):992–8. https://doi.org/10.1055/s-0038-1625961. - Mathis DT, Hauser A, Iordache E, Amsler F, Hirschmann MT. Typical pain patterns in unhappy patients after total knee arthroplasty.
J Arthroplasty 2021;36(6):1947–57. https://doi.org/10.1016/j. arth.2021.01.040. - Jennings JM, Kleeman-Forsthuber LT, Bolognesi MP. Medial unicompartmental arthroplasty of the knee. J Am Acad Orthop Surg 2019;27(5):166–76. https://doi.org/10.5435/JAAOS- -D-17-00690.
- van der List JP, Zuiderbaan HA, Pearle AD. Why do medial unicompartmental knee arthroplasties fail today? J Arthroplasty 2016;31(5):1016–21. https://doi.org/10.1016/j. arth.2015.11.030.
- Baker PN, Petheram T, Avery PJ, Gregg PJ, Deehan DJ. Revision for unexplained pain following unicompartmental and total knee
replacement. J Bone Joint Surg Am 2012;94(17):e126. https://doi.org/10.2106/JBJS.K.00791. - Park CN, Zuiderbaan HA, Chang A, Khamaisy S, Pearle AD, Ranawat AS. Role of magnetic resonance imaging in the diagnosis
of the painful unicompartmental knee arthroplasty. Knee 2015;22(4):341–6. https://doi.org/10.1016/j.knee.2015.03.007. - Ongaro A, Varani K, Masieri FF, Pellati A, Massari L, Cadossi L, et al. Electromagnetic fields (EMFs) and adenosine receptors modulate prostaglandin E(2) and cytokine release in human osteoarthritic synovial fibroblasts. J Cell Physiol 2012;227(6):2461–9.
https://doi.org/10.1002/jcp.22981. - La Verde L, Franceschetti E, Palumbo A, Giovannetti E, Ranieri R, Sorini G, et al. Applicazione dei campi magnetici pulsati nei
pazienti sottoposti a protesi inversa di spalla: valutazione clinica e funzionale. G Ital Ortop Traumatol 2019;45(1):37–46. https://doi.org/10.32050/0390-0134-116. Italian. - Yang X, He H, Ye W, Perry TA, He C. Effects of pulsed electromagnetic field therapy on pain, stiffness, physical function, and quality of life in patients with osteoarthritis: a systematic review and meta-analysis of randomized placebo-controlled trials. Phys Ther 2020;100(7):1118–31. https://doi.org/10.1093/ptj/pzaa054.
- Vigano M, Perucca Orfei C, Ragni E, Colombini A, de Girolamo L. Pain and functional scores in patients affected by knee OA after treatment with pulsed electromagnetic and magnetic fields: a meta-analysis. Cartilage 2021;13(1_suppl):1749S–61S. https://doi.org/10.1177/1947603520931168.
- Massari L, Benazzo F, Falez F, Perugia D, Pietrogrande L, Setti S, et al. Biophysical stimulation of bone and cartilage: state of the art and future perspectives. Int Orthop 2019;43(3):539–51. https://doi.org/10.1007/s00264-018-4274-3.
- Fuzier R, Serres I, Bourrel R, Palmaro A, Montastruc JL, Lapeyre-Mestre M. Analgesic drug consumption increases after knee
arthroplasty: a pharmacoepidemiological study investigating postoperative pain. Pain 2014; 155(7):1339–45. https://doi.org/10.1016/j.pain.2014.04.010. - Hawker G, Wright J, Coyte P, Paul J, Dittus R, Croxford R, etal. Health-related quality of life after knee replacement. J Bone Joint Surg Am 1998;80(2):163–73. https://doi.org/10.2106/00004623-199802000-00003.
- Wylde V, Hewlett S, Learmonth ID, Dieppe P. Persistent pain after joint replacement: prevalence, sensory qualities, and postoperative determinants. Pain 2011;152(3):566–72. https://doi.org/10.1016/j.pain.2010.11.023.
- Woolhead GM, Donovan JL, Dieppe PA. Outcomes of total knee replacement: a qualitative study. Rheumatology