Wprowadzenie Udar w okresie noworodkowym należy do spektrum udarów okołoporodowych i typowo dotyka noworodki urodzone o czasie lub niemal o czasie1. Jest to zdarzenie mózgowo-naczyniowe, do którego dochodzi w wyniku ogniskowego lub wieloogniskowego przerwania przepływu krwi tętniczej lub żylnej w mózgu, potwierdzone badaniem neuroobrazowym2,3. Spośród stwierdzanych udarów około 80% stanowią tętnicze udary niedokrwienne, dotyczące głównie tętnicy środkowej mózgu, a do pozostałych 20% dochodzi w wyniku zakrzepicy zatok żylnych mózgu lub pierwotnego krwotoku mózgowego4.
Etiologia udaru zwykle jest wieloczynnikowa i obejmuje czynniki ryzyka związane z matką, płodem oraz czynniki noworodkowe5. Jednakże w wielu przypadkach przyczyna może pozostawać nierozpoznana6-9.
Do głównych czynników ryzyka należą
- infekcje u matki,
- zaburzenia krzepnięcia krwi,
- asfiksja wewnątrzmaciczna lub okołoporodowa
- oraz wrodzone nieprawidłowości kardiologiczne10-13.
Mimo niezmiernie wielkiej wagi histopatologii łożyska w ustalaniu etiologii udaru w okresie noworodkowym, niewiele badań skupia się na nieprawidłowościach łożyska14-18. Inne badania diagnostyczne w celu ewaluacji udaru u noworodka obejmują echokardiografię i testy genetyczne w kierunku problemów prozakrzepowych.
Udar w okresie noworodkowym może przejawiać się drgawkami podczas porodu lub w ciągu kilku pierwszych dni życia. Niewielka liczba dzieci może nie wykazywać objawów klinicznych aż do późnego okresu noworodkowego19. Długoterminowe powikłania neurologiczne udaru u noworodka obejmują porażenie mózgowe i padaczkę. Badania nad długoterminowymi skutkami neurorozwojowymi (SNR) udaru w okresie noworodkowym ograniczone są dużym zróżnicowaniem narzędzi oceny neurorozwojowej, używanych podczas badań kontrolnych21-23.
Badania opisujące skutki przy użyciu standaryzowanej Skali Rozwoju Niemowlęcia Bayleya (Bayley Scale of Infant Development) w wersji III (BSID III) i konieczność stosowania terapii rehabilitacyjnych
Pierwsze dwa lata życia są ważne, jeśli chodzi o modyfikowanie deficytów poprzez odpowiednie terapie rehabilitacji fizycznej, zajęciowej, mowy i dietetycznej.
W niniejszym badaniu staraliśmy się opisać charakterystykę matki i niemowlęcia w kohorcie dotkniętej udarem w okresie noworodkowym oraz diagnostyczną ewaluację z badań nad łożyskiem, echokardiograficznych oraz genetycznych. Staraliśmy się także opisać wyniki neurorozwojowe tych dzieci przy pomocy oceny BSID III oraz potrzeby usług rehabilitacyjnych podczas pierwszych dwóch lat życia.
Projekt i metody badania
Niniejsze retrospektywne badanie kohortowe dotyczyło niemowląt przyjmowanych na neonatologiczne oddziały intensywnej opieki medycznej (NOIOM-y) ośrodka Cleveland Clinic Children’s w latach 2011-2020. Badaniem objęto noworodki w wieku poniżej 28 dni, u których zdiagnozowano udar widoczny na skanie MRI. Zebrano dane matek, obejmujące wiek, rasę, liczbę porodów, powikłania podczas ciąży i typ porodu.
Dane dzieci obejmowały:
- wiek ciążowy,
- wagę urodzeniową,
- płeć,
- wynik w skali Apgar
- i konieczność resuscytacji przy porodzie.
Zebrano także szczegóły odnośnie do objawów, diagnozy encefalopatii niedotlenieniowo-niedokrwiennej (ENN) w okresie okołoporodowym według klasyfikacji Sarnatów i potrzeby leczenia hipotermią u tych dzieci. Stan zagrożenia płodu brano pod uwagę według wytycznych postępowania klinicznego wydanych przez American College of Obstetricians and Gynecologists, jeśli utrzymywała się kategoria II zapisu czynności serca płodu lub jeśli podczas ciągłego monitorowania płodu pojawił się zapis kategorii III czynności serca.
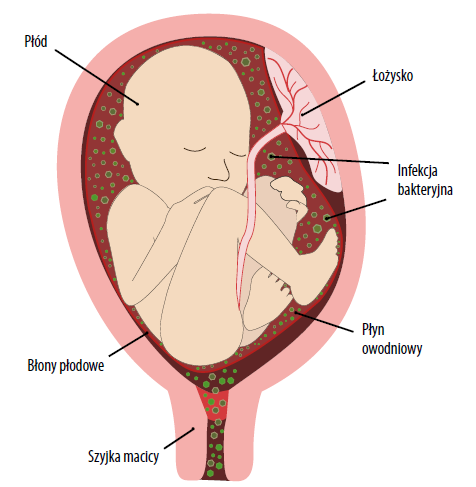
Kategoria II czynności serca płodu obejmuje przynajmniej jedno z następujących zjawisk: bradykardię, której nie towarzyszy brak zmienności podstawowej czynności serca, tachykardię płodu, minimalną zmienność czynności podstawowej, brak zmienności czynności podstawowej bez nawracających deceleracji, zaznaczoną zmienność czynności podstawowej, brak akceleracji wywołanych przez stymulację płodu, nawracające deceleracje z minimalną lub umiarkowaną zmiennością czynności podstawowej, wydłużoną decelerację trwającą więcej niż 2 minuty, ale mniej niż 10 minut, nawracające późne deceleracje z umiarkowaną zmiennością czynności podstawowej oraz deceleracje zmienne, z innymi cechami charakterystycznymi, jak wolny powrót do czynności podstawowej, objaw Gaussa czy „ramię”. Zapisy kategorii III czynności serca płodu obejmują sam wykres sinusoidalny lub brak zmienności czynności serca z jednym z następujących czynników – nawracającymi deceleracjami późnymi lub zmiennymi, bradykardią. Kliniczne zapalenie błon płodowych i łożyska stwierdzano, jeśli pojedynczy pomiar temperatury w ustach wyniósł 39°C lub więcej lub jeśli temperatura w jamie ustnej utrzymywała się na poziomie 38-38,9°C podczas pomiaru powtórzonego po 30 minutach i jeśli występował jeden z następujących czynników: leukocytoza u matki, ropny wyciek z szyjki macicy lub tachykardia u płodu.
Przedwczesne pęknięcie błon płodowych (PROM – premature rupture of membranes) zdefiniowano jako przerwanie błon płodowych na więcej niż 18 godzin przed rozpoczęciem porodu. Ustalenia z rezonansu magnetycznego mózgu klasyfikowano według lateralizacji i odnośnego obszaru ukrwienia. Ustalenia z histopatologii łożyska sklasyfikowano i opisano według klasyfikacji amsterdamskiej24. Dane echokardiograficzne zbierano w przypadkach, gdzie było to możliwe. Odnośnie do niektórych niemowląt, które były oceniane pod kątem problemów zakrzepowych i nieprawidłowości chromosomalnych, uzyskano również wyniki badań genetycznych.
Skutki krótkoterminowe obejmowały czas pobytu w szpitalu, poważne trudności z karmieniem oraz konieczność stosowania żywienia przez sondę w momencie wypisu z NOIOM-u. Dzieci były następnie badane w klinice wysokiego ryzyka neurorozwojowego do ukończenia 2. roku życia. SNR oceniano przy użyciu BSID III w wieku jednego roku (8-12 miesięcy) i dwóch lat (18-24 miesięcy) wieku poprawionego lub chronologicznego, zależnie od przypadku.
Trzema komponentami tej oceny były:
- łączna ocena kognitywna (CCS – cognitive composite score),
- łączna ocena językowa (LCS – language composite score) i
- łączna ocena motoryczna (MCS – motor composite score). W celu wykrycia ograniczeń motorycznych i porażenia mózgowego przeprowadzono serię badań neurologicznych do ukończenia 2. roku życia. Podczas wizyty w wieku 2 lat dokumentowano występowanie padaczki zdefiniowanej jako nawracające drgawki i/lub stosowanie leków przeciwpadaczkowych. Odnotowano korzystanie w ciągu pierwszych dwóch lat życia z programów rehabilitacji rozwojowej obejmujących fizjoterapię, terapię zajęciową, mowy lub dietetyczną.
Zarządzenie danymi i ich analiza
Zmienne ciągłe opisywano przy użyciu median i zakresu, a dane kategoryczne przy użyciu liczb i odsetków. Wszelkie analizy przeprowadzano wyłącznie na podstawie pełnych danych na temat przypadków; uczestnicy z brakami odnośnie do konkretnych zmiennych byli wyłączani z tych analiz, w których korzystano z owych zmiennych.
Wyniki
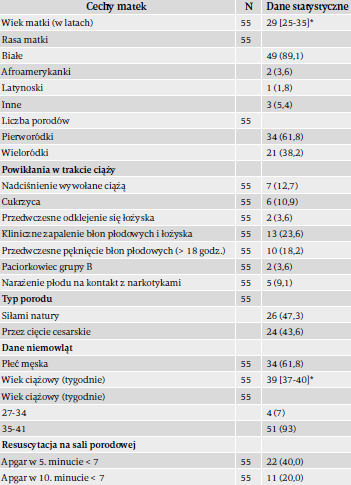
Podczas trwania badania urodziło się 80 567 dzieci, spośród których 55 doznało w okresie noworodkowym udaru, potwierdzonego skanem MRI. Dane dzieci objętych badaniem i ich matek ukazuje tabela 1.
przedstawionych jako mediana [rozstęp ćwiartkowy].
Matki niemowląt ze zdiagnozowanym udarem w większości były pierworódkami (61%) rasy białej (89%) i rodziły siłami natury (57%). Podczas trwania badania ogólne dane demograficzne noworodków przyjmowanych na nasze NOIOM-y nie odbiegały znacząco od tych danych (pierworódki – 55%, rasa biała – 80%, poród siłami natury – 63%).
Około jedna trzecia noworodków z udarem przyszła na świat przez cesarskie cięcie w trybie nagłym, a 66% noworodków doznało stanu zagrożenia w życiu płodowym. Zapalenie błon płodowych i łożyska oraz PROM obecne były odpowiednio w 24% i 18% przypadków.
Pięcioro dzieci w życiu płodowym było narażonych na kontakt z narkotykami. Żadne z nich nie wykazywało jednak objawów noworodkowego zespołu odstawiennego podczas pobytu na NOIOM-ie. U około 58% noworodków w 10. minucie życia stwierdzono wynik w skali Apgar niższy niż 7.
W sumie u 20 dzieci rozpoznano okołoporodową encefalopatię niedotlenieniowo-niedokrwienną (ENN) według klasyfikacji Sarnatów; 15 spośród nich leczono hipotermią w oparciu o standardowe kryteria selekcji. Kliniczne drgawki były pierwszym objawem uwidocznionym u większości (65%) dzieci. U pozostałych urazy wykryto na skanach MRI po zakończeniu leczenia hipotermią z powodu ENN.
W skanach MRI większość udarów (86%) zdiagnozowano jako tętnicze, a tylko 14% stanowiły udary żylne. Ustalenia z rezonansu magnetycznego w większości wykazywały urazy jednostronne, zlokalizowane w 51% przypadków w obszarze lewej tętnicy mózgowej. Zmiany obustronne widoczne były u 24% noworodków z udarem.
Echokardiografię wykonano w 87% przypadków w celu wykrycia ewentualnej wady serca. Najczęściej wykrywanymi wadami były przetrwały przewód tętniczy (PDA – patent ductus arteriosus) (29%) oraz ubytek przegrody międzykomorowej (VSD – ventricular septal defect) (7%). Przetrwały otwór owalny (PFO – patent foramen ovale), mieszczące się w normie ustalenie w echokardiografii noworodków, stwierdzono u 88% dzieci.
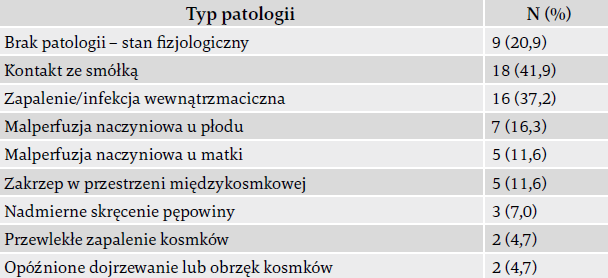
Wyniki badań histopatologicznych łożyska dostępne były odnośnie do 43 dzieci (79%), a większość z nich (80%) stwierdzała nieprawidłowości (tabela 2).
Najczęściej stwierdzano kontakt ze smółką (łożysko zaplamione na zielono, reaktywna owodnia z nekrozą, obrzęk i rzadkie barwione makrofagi) (40%) oraz infekcję wewnątrzmaciczną (zapalenie żyły i tętnicy pępowinowej, zmiany wywołane przez ostrą odpowiedź zapalną u matki i płodu, zapalenie naczyń płodu, ostre zapalenie błon płodowych i łożyska) (37%).
Badania genetyczne w kierunku problemów zakrzepowych przeprowadzono u 23 noworodków. Prawidłowe wyniki stwierdzono u 25% pacjentów. Najczęściej diagnozowanymi zaburzeniami były mutacje genów związane z reduktazą metylenotetrahydrofolianu (MTHFR) (10%), protrombiną (4%) i czynnikiem V Leiden (4%). Podczas badań genetycznych wykryto także po jednym przypadku trisomii 21. chromosomu i zespołu DiGeorge’a.
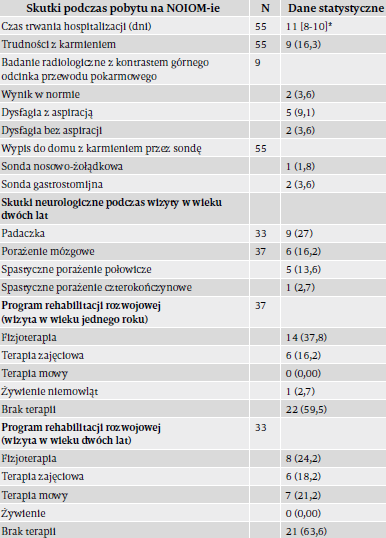
Tabela 3 opisuje krótko- i długoterminowe skutki udaru u badanych dzieci. Mediana (min., maks.) czasu hospitalizacji wyniosła 11 (8, 20) dni. Dziewięcioro dzieci (16%), które miały trudności z jedzeniem, poddano radiologicznym badaniom kontrastowym górnego odcinka przewodu pokarmowego; spośród nich troje wymagało żywienia przez sondę w momencie wypisu z NOIOM-u. Podczas kontroli po dwóch latach padaczka występowała u 27% dzieci. Porażenie mózgowe zaobserwowano u 16%, z czego pięcioro dzieci cierpiało na spastyczne porażenie połowicze, a jedno na spastyczne porażenie czterokończynowe. U żadnego z dzieci w tej kohorcie nie rozwinęła się ślepota ani głuchota odbiorcza. Nie zgłaszano przypadków śmiertelnych ani podczas początkowej hospitalizacji, ani podczas kontroli.
Podczas wizyt pod koniec 1. i 2. roku życia odpowiednio 38% dzieci i 24% dzieci nadal wymagało fizjoterapii. Podczas wizyty pod koniec 2. roku życia stwierdzono, że 21% dzieci wymaga terapii mowy.
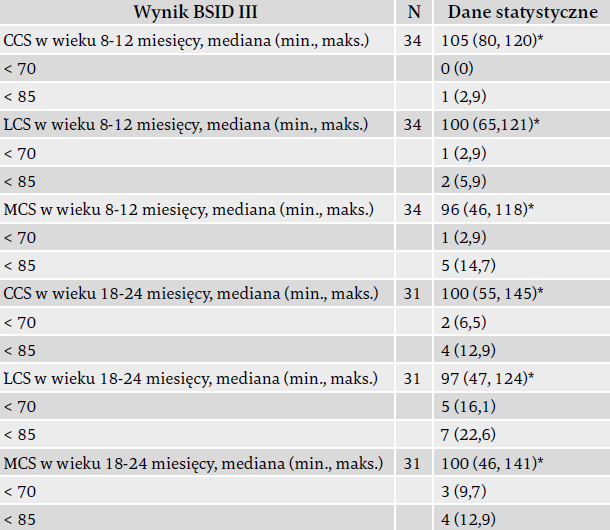
Tabela 4 opisuje SNR przy użyciu oceny BSID III w tej kohorcie. Oceny po roku i po dwóch latach przeprowadzono odpowiednio u 78% i 70% dzieci. Nie u wszystkich dzieci objętych badaniem przeprowadzono ocenę BSID III po roku i po dwóch latach, jako że niektóre z nich nie osiągnęły wtedy jeszcze wymaganego wieku. Podczas wizyty po roku wynik CCS [mediana (min., maks.)] wyniósł 105 (80, 120), wynik LCS wyniósł 100 (65, 121), a wynik MCS – 96 (46, 118). Podczas wizyty po dwóch latach wyniki te wyniosły odpowiednio: 100 (55, 145), 97 (47, 124) i 100 (46, 141).
Omówienie
Badanie niniejsze na kohorcie 55 niemowląt z udarem w okresie noworodkowym przeprowadzone w okresie 10 lat wykazało, że najczęściej obserwowanym objawem były drgawki. Skany MRI mózgu przeważnie wykazywały udział lewej tętnicy mózgowej. Powiązanymi problemami zdrowotnymi w momencie porodu były często zapalenie błon płodowych i łożyska (37%) i okołoporodowa ENN (36%).
W badaniach histopatologicznych łożyska ujawniano kontakt ze smółką (40%) oraz infekcję wewnątrzmaciczną (37%). Poważne trudności z jedzeniem, wymagające radiologii z kontrastem górnego odcinka przewodu pokarmowego, zaobserwowano u 16% noworodków podczas ich pobytu na NOIOM-ie. Podczas wizyt po dwóch latach obserwowano opóźnienia neurorozwojowe według BSID III (16%), padaczkę (27%) i porażenie mózgowe (16%). Duży odsetek dzieci w wieku dwóch lat nadal wymagał fizjoterapii (24%), terapii zajęciowej (18%) i terapii mowy (21%).
Udar w okresie noworodkowym i noworodkowa ENN to jednostki chorobowe o pokrywających się czynnikach ryzyka, takich jak zapalenie błon płodowych i łożyska, stan zagrożenia płodu i niewydolność łożyska25-27. Nie jest jasne, kiedy te czynniki ryzyka wywołują jedną z tych jednostek chorobowych. U noworodków z ENN uogólnione zaburzenie krążenia układowego, zaburzające perfuzję mózgu, może wywoływać w mózgu zmiany niedokrwienne. W niniejszym badaniu stan zagrożenia płodu i skażenie płynu owodniowego smółką odnotowano u ponad 60% dzieci, a u 37% z nich wystąpiła okołoporodowa ENN. Niewiele badań donosiło o ENN jako o czynniku ryzyka udaru w okresie noworodkowym28, 29. Spekulujemy, że uogólnione niedotlenienie-niedokrwienie prowadziłoby do ENN, podczas gdy zagrożenie ogniskowe wywołałoby udar. Warto odnotować, że u niektórych dzieci z niniejszego badania (14%) stwierdzono wieloogniskowe zmiany w mózgu.
Innym problemem zdrowotnym związanym z udarem w okresie noworodkowym było zapalenie błon płodowych i łożyska, które stwierdzono w niemal 40% przypadków. Zapalenie/infekcja łożyska może wywoływać procesy zakrzepowe poprzez działanie cytokin stanu zapalnego30. Poza zapaleniem łożyska w naszym badaniu zaobserwowano malperfuzję płodową i matczyną, zakrzep w przestrzeni międzykosmkowej oraz nadmierne skręcenie pępowiny, które są znanymi czynnikami ryzyka ograniczenia rozwoju wewnątrzmacicznego i urazu neurologicznego31,32. Zakrzep w łożysku może wywołać układową embolizację sięgającą krążenia mózgowego dziecka, która może doprowadzić do udaru w okresie noworodkowym.
Identyfikacja przyczyn prowadzących do udaru w okresie noworodkowym może pomóc w łagodzeniu przebiegu choroby i zapobiegać przyszłym udarom. Jeśli stwierdzana jest przyczyna uwarunkowana genetycznie, identyfikacja ta może również pomóc w zapobieganiu udarowi czy podobnym zdarzeniom naczyniowym u członków rodziny, a także stanowić pomoc w doradztwie genetycznym. Z naszego doświadczenia wynika, że bieżące wytyczne obejmują badanie histopatologiczne łożyska, ocenę echokardiograficzną w kierunku wad serca oraz badania w kierunku prozakrzepowych mutacji genetycznych.
Częste ustalenia kardiologiczne w naszym badaniu to PDA i VSD. PFO, który zaobserwowano u większości dzieci, może mieścić się w normie dla tego wieku. Donoszono, że wady te powodują udar u osób dorosłych, choć ich znaczenie w udarze w okresie noworodkowym jest niejasne. Zakrzep wewnątrzsercowy czy wegetacje to znane czynniki ryzyka udaru. W naszym badaniu jednak nie stwierdzono tych czynników u żadnego z dzieci. W niniejszym badaniu najczęściej identyfikowane prozakrzepowe mutacje genetyczne wiązały się z genami MFHTR (10%), protrombiny (4%) i czynnika V Leiden (4%). Wcześniejsze badanie donosiło o związku między mutacją genu MFHTR a hiperhomocysteinemią, która predysponuje do mózgowych zdarzeń zakrzepowych33. My nie stwierdziliśmy w tej kohorcie żadnych przypadków hiperhomocysteinemii.
Drgawki, bezdech, ogniskowa słabość i niedowład połowiczy stanowią częsty obraz kliniczny udaru w okresie noworodkowym34.
W sumie u 65% dzieci z udarem w niniejszym badaniu drgawki wystąpiły jako pierwszy objaw. U niektórych noworodków z udarem drgawki nie wystąpiły – zwłaszcza u tych, gdzie podłoże stanowiła ENN. Drgawki u noworodków mogą być nieznaczne i bardzo trudne do klinicznego zdiagnozowania bez elektroencefalografii (EEG). Można to również wytłumaczyć rozmiarem i umiejscowieniem urazu. Typowo zawał mózgu lub krwotok wywołuje drgawki z powodu stymulacji neuronów pobudzających. Niewielkie urazy odległe od kory ruchowej mogą nie powodować dostrzegalnych klinicznie drgawek.
W naszym badaniu 27% tych dzieci, które badano w wieku dwóch lat, miało padaczkę. Stoi to w zgodzie z niedawnymi ustaleniami z metaanalizy 10 badań nad udarem okołoporodowym, stwierdzającymi, że padaczka rozwija się u jednej trzeciej dotkniętych dzieci35.
EEG stanowi bardzo cenne narzędzie diagnozowania i leczenia drgawek za pomocą odpowiednich leków u takich dzieci. Rozmiar i zasięg uszkodzenia może odgrywać także rolę w rozwoju padaczki u dzieci.
Wedle naszej najlepszej wiedzy jest to jedno z bardzo niewielu badań donoszących o SNR udaru w okresie noworodkowym wykorzystujących wyłącznie BSID III w poprawionym lub chronologicznym wieku roku lub dwóch lat. Skala BSID III uważana jest za złoty standard narzędzi oceny rozwojowej dla tej grupy wiekowej36, 37. Wczesna identyfikacja opóźnienia rozwojowego jest niezmiernie ważna, jako że wczesna interwencja może łagodzić późniejsze zaburzenia neurorozwojowe38.
Większość dzieci z niniejszego badania w wieku roku i dwóch lat miało wyniki BSID III mieszczące się w normie. W wieku dwóch lat 16% dzieci miało znaczące opóźnienia neurorozwojowe – u pięciorga rozwinęło się połowicze porażenie mózgowe, a u jednego spastyczne porażenie czterokończynowe. Dzieci te wymagają także bacznego kontrolowania i częstych terapii rehabilitacji rozwojowej. Podczas wizyty po dwóch latach 24% dzieci nadal wymagało fizjoterapii, a 21% – terapii mowy. Jako że rozwój językowy lepiej ocenia się między ukończeniem pierwszego i drugiego roku życia, w niniejszym badaniu więcej dzieci wymagało terapii mowy w wieku dwóch lat niż w wieku jednego roku.
Siłą tego badania jest fakt, że dla większości noworodków wykonano badania histopatologiczne łożyska (78%) i echokardiografię (87%) w celu określenia etiologii udaru. Choć wiele badań donosiło o długoterminowych poudarowych skutkach u starszych dzieci, niniejsze badanie donosi o SNR z wykorzystaniem skali BSID III podczas wizyt w wieku jednego i dwóch lat.
Badanie niniejsze określiło również zapotrzebowanie na terapie rehabilitacji rozwojowej u tych dzieci w wieku dwóch lat. Informacja ta będzie odgrywała wielką rolę przy doradzaniu rodzicom odnośnie do skutków oraz odnośnie do wagi przeprowadzania kontroli neurorozwojowych. Badanie to przedstawia precyzyjne szacunki występowania udaru w okresie noworodkowym, jako że niemal wszystkie dzieci urodzone w szpitalu objęte są opieką pediatryczną w placówce medycznej. Jako że jest to badanie retrospektywne, obarczone jest ono nieodłącznymi ograniczeniami; należy zachować ostrożność przy ekstrapolowaniu lub generalizacji w oparciu o jego wyniki. Badanie to opisuje powiązane warunki i nie stanowi badania z przypadkami kontrolnymi, identyfikującego czynniki ryzyka. Ze względu na niewielką próbę nie byliśmy w stanie opisać skutków każdego typu udaru z osobna.
Wnioski
Udar w okresie noworodkowym zwykle przejawiał się drgawkami i miał pochodzenie tętnicze u większości dzieci. Najpowszechniejszymi powiązanymi jednostkami chorobowymi przy porodzie były zapalenie błon płodowych i łożyska oraz okołoporodowa ENN.
U znacznego odsetka dzieci w wieku dwóch lat odnotowano opóźnienia we wszystkich komponentach BSID III, padaczkę, porażenie mózgowe i potrzebę korzystania z terapii rehabilitacyjnej.
Przyszłe badania skupiające się na wczesnej identyfikacji zaburzeń neurorozwojowych mogłyby wziąć pod uwagę takie narzędzia jak ogólna ocena ruchu (GMA – general movement assessment) i/lub badanie neurologiczne niemowląt Hammersmith (HINE – Hammersmith infant neurological exam). Można rozważyć wykonalność zastosowania przy udarze w okresie noworodkowym środków neuroprotekcyjnych, takich jak erytropoetyna czy melatonina, w celu zmniejszenia zaburzeń neurorozwojowych.
Mineyko A., Kirton A., The black box of perinatal ischemic stroke pathogenesis. J Child Neurol 2011;26:1154-1162.- Raju T.N., Nelson K.B., Ferriero D., Lynch J.K., Ischemic perinatal stroke: summary of a workshop sponsored by the national institute of child health and human development and the national institute of neurological disorders and stroke. Pediatrics 2007; 120: 609-616.
- Dunbar M., Kirton A., Perinatal stroke: mechanisms, management, and outcomes of early cerebrovascular brain injury. Lancet Child Adolesc Health 2018; 2: 666-676.
- Kirton A., Deveber G., Stroke in the fetus and neonate. Future Cardiol 2006; 2: 593-604.
- Fluss J., Dinomais M., Chabrier S., Perinatal stroke syndromes: similarities and diversities in aetiology, outcome and management. Eur J Paediatr Neurol 2019; 23: 368-383.
- Roach E.S., Golomb M.R., Adams R., Biller J., Daniels S., Deveber G. et al., Management of stroke in infants and children: a scientific statement from a special writing group of the American heart association stroke council and the council on cardiovascular disease in the young. Stroke 2008; 39: 2644-2691.
- Curry C.J., Bhullar S., Holmes J., Delozier C.D., Roeder E.R., Hutchison H.T., Risk factors for perinatal arterial stroke: a study of 60 mother-child pairs. Pediatr Neurol 2007; 37: 99-107.
- Lee J., Croen L.A., Backstrand K.H., Yoshida C.K., Henning L.H., Lindan C. et al., Maternal and infant characteristics associated with perinatal arterial stroke in the infant. JAMA 2005; 293: 723-729.
- Li C., Miao J.K., Xu Y., Hua Y.Y., Ma Q., Zhou L.L. et al., Prenatal, perinatal and neonatal risk factors for perinatal arterial ischaemic stroke: a systematic review and meta-analysis. Eur J Neurol 2017; 24: 1006-1015.
- Chabrier S., Husson B., Dinomais M., Landrieu P., Nguyen The Tich S., New insights (and new interrogations) in perinatal arterial ischemic stroke. Thromb Res 2011; 127: 13-22.
- Cheong J.L., Cowan F.M., Neonatal arterial ischaemic stroke: obstetric issues. Semin Fetal Neonatal Med 2009; 14: 267-271.
- Benders M.J., Groenendaal F., Uiterwaal C.S., Nikkels P.G., Bruinse H.W., Nievelstein R.A. et al., Maternal and infant characteristics associated with perinatal arterial stroke in the preterm infant. Stroke 2007; 38: 1759-1765.
- Wu Y.W., March W.M., Croen L.A., Grether J.K., Escobar G.J., Newman T.B., Perinatal stroke in children with motor impairment: a population-based study. Pediatrics 2004; 114: 612-619.
- Kraus F.T., Acheen V.I., Fetal thrombotic vasculopathy in the placenta: cerebral thrombi and infarcts, coagulopathies, and cerebral palsy. Hum Pathol 1999; 30: 759-769.
- Kraus F.T., Cerebral palsy and thrombi in placental vessels of the fetus: insights from litigation. Hum Pathol 1997; 28: 246-248.
- Redline R.W., Severe fetal placental vascular lesions in term infants with neurologic impairment. Am J Obstet Gynecol 2005; 192: 452-457.
- Takenouchi T., Kasdorf E., Engel M., Grunebaum A., Perlman J.M., Changing pattern of perinatal brain injury in term infants in recent years. Pediatr Neurol 2012; 46: 106-110.
- Bernson-Leung M.E., Boyd T.K., Meserve E.E., Danehy A.R., Kapur K., Trenor C.C. 3rd et al., Placental pathology in neonatal stroke: a retrospective case-control study. J Pediatr 2018; 195: 39-47.e5.
- Kirton A., Armstrong-Wells J., Chang T., Deveber G., Rivkin M.J., Hernandez M. et al., Symptomatic neonatal arterial ischemic stroke: the international pediatric stroke study. Pediatrics 2011; 128: e1402-1410.
- Srinivasan J., Miller S.P., Phan T.G., Mackay M.T., Delayed recognition of initial stroke in children: need for increased awareness. Pediatrics 2009; 124: e227-234.
- Wagenaar N., Martinez-Biarge M., van der Aa N.E., van Haastert I.C., Groenendaal F., Benders M.J.N.L. et al., Neurodevelopment after perinatal arterial ischemic stroke. Pediatrics 2018; 142: e20174164.
- Loo S., Ilves P., Mannamaa M., Laugesaar R., Loorits D., Tomberg T. et al., Long-term neurodevelopmental outcome after perinatal arterial ischemic stroke and periventricular venous infarction. Eur J Paediatr Neurol 2018; 22: 1006-1015.
- Chabrier S., Peyric E., Drutel L., Deron J., Kossorotoff M., Dinomais M. et al., Multimodal outcome at 7 years of age after neonatal arterial ischemic stroke. J Pediatr 2016; 172: 156-161.
- Redline R.W., Classification of placental lesions. Am J Obstet Gynecol 2015; 213: S21-8.
- Novak C.M., Eke A.C., Ozen M., Burd I., Graham E.M., Risk factors for neonatal hypoxic-ischemic encephalopathy in the absence of sentinel events. Am J Perinatol 2019; 36: 27-33.
- Rossi A.C., Prefumo F., Antepartum and intrapartum risk factors for neonatal hypoxic-ischemic encephalopathy: a systematic review with meta-analysis. Curr Opin Obstet Gynecol 2019; 31: 410-417.
- Parker S.J., Kuzniewicz M., Niki H., Wu Y.W., Antenatal and intrapartum risk factors for hypoxic-ischemic encephalopathy in a US birth cohort. J Pediatr 2018; 203: 163-169.
- Michoulas A., Basheer S.N., Roland E.H., Poskitt K., Miller S., Hill A., The role of hypoxia-ischemia in term newborns with arterial stroke. Pediatr Neurol 2011; 44: 254-258.
- Harbert M.J., Tam E.W., Glass H.C., Bonifacio S.L., Haeusslein L.A., Barkovich A.J. et al., Hypothermia is correlated with seizure absence in perinatal stroke. J Child Neurol 2011; 26: 1126-1130.
- Dueck C.C., Grynspan D., Eisenstat D.D., Caces R., Rafay M.F., Ischemic perinatal stroke secondary to chorioamnionitis: a histopathological case presentation. J Child Neurol 2009; 24: 1557-1560.
- de Laat M.W., Franx A., Bots M.L., Visser G.H., Nikkels P.G., Umbilical coiling index in normal and complicated pregnancies. Obstet Gynecol 2006; 107: 1049-1055.
- Redline R.W., Ravishankar S., Fetal vascular malperfusion, an update. APMIS 2018; 126: 561-569.
- Rook J.L., Nugent D.J., Young G., Pediatric stroke and methylenetetrahydrofolate reductase polymorphisms: an examination of C677T and A1298C mutations. J Pediatr Hematol Oncol 2005; 27: 590-593.
- Rutherford M.A., Ramenghi L.A., Cowan F.M., Neonatal stroke. Arch Dis Child Fetal Neonatal Ed 2012; 97: F377-84.
- Rattani A., Lim J., Mistry A.M., Prablek M.A., Roth S.G., Jordan L.C. et al. Incidence of epilepsy and associated risk factors in perinatal ischemic stroke survivors. Pediatr Neurol 2019; 90: 44-55.
- Luttikhuizen dos Santos E.S., de Kieviet J.F., Konigs M., van Elburg R.M., Oosterlaan J., Predictive value of the Bayley Scales of Infant Development on development of very preterm/very low birth weight children: a meta-analysis. Early Hum Dev 2013; 89: 487-496.
- Del Rosario C., Slevin M., Molloy E.J., Quigley J., Nixon E., How to use the Bayley scales of infant and toddler development. Arch Dis Child Educ Pract Ed 2021; 106: 108-112.
- Pierrat V., Marchand-Martin L., Arnaud C., Kaminski M., Resche-Rigon M., Lebeaux C. et al., Neurodevelopmental outcome at 2 years for preterm children born at 22 to 34 weeks’ gestation in France in 2011: EPIPAGE-2 cohort study. BMJ 2017; 358: j3448.