Wprowadzenie
Ból kończyny dolnej może wynikać z całego szeregu problemów zdrowotnych. Dlatego też identyfikacja źródła dolegliwości pacjenta stanowi złożony proces przeprowadzany przez klinicystów podstawowej opieki zdrowotnej. Choroba tętnic obwodowych (PAD – peripheral arterial disease) to powszechna i potencjalnie poważna przyczyna bólu kończyn dolnych. Mimo wysokiej częstotliwości występowania rozpoznawanie PAD stanowi wyzwanie ze względu na jej przejawy: może ona naśladować inne problemy neuromięśniowo-szkieletowe, takie jak radikulopatia lędźwiowo-krzyżowa (LSR – lumbosacral radiculopathy), lub z nimi współwystępować.
Choroba tętnic obwodowych
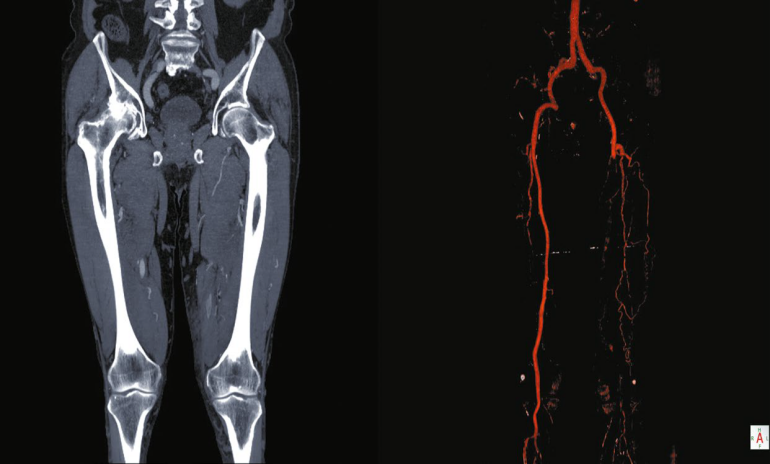
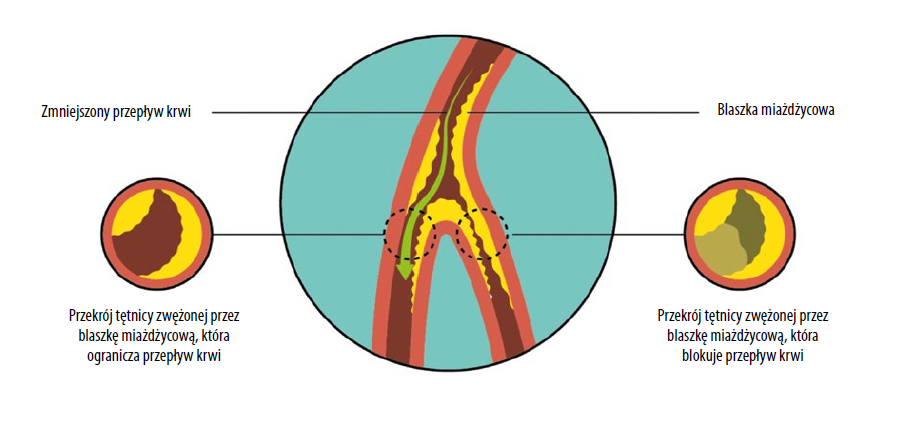
PAD definiowana jest jako całkowita lub częściowa blokada naczyń dostarczających krew z serca do naczyń obwodowych (ryc. 1). Ten patologiczny proces często powodowany jest przez miażdżycę – stwardnienie tętnicy z powodu nagromadzenia blaszek miażdżycowych (Firnhaber and Powell, 2019). PAD najczęściej dotyka kończyn dolnych, a jej występowanie wynosi 7% osób w wieku 55-59 lat. Odsetek ten rośnie wraz z wiekiem populacji i sięga niemal 25% u osób w przedziale 95-99 lat8. Warto zauważyć, że aż 20-50% przypadków PAD nie daje objawów. Jednak jeśli zaopatrzenie w krew jest niewystarczające dla zaspokojenia potrzeb metabolicznych, objawy się pojawiają17.
Wywiad z pacjentem
Wskazówki, jakie mogą nasuwać podejrzenie PAD, można odnaleźć głównie podczas wywiadu z pacjentem. PAD jest postępującym zaburzeniem wieloczynnikowym, które wiąże się z co najmniej jednym czynnikiem ryzyka sercowo-naczyniowego12,21, najczęściej z miażdżycą6. Stwierdzono, że także cukrzyca i palenie tytoniu zwiększają prawdopodobieństwo zachorowania na PAD23,25. Inne czynniki ryzyka to: płeć męska, nadciśnienie, dyslipidemia, hiperhomocysteinemia, podwyższony poziom białka c-reaktywnego i niewydolność nerek17.
Według wytycznych American College of Cardiology/American Heart Association (ACC/AHA) na ryzyko PAD kończyn dolnych narażone są następujące osoby:
- w wieku co najmniej 65 lat,
- w wieku 50-64 lat z czynnikami ryzyka miażdżycy lub z PAD w wywiadzie rodzinnym,
- w wieku poniżej 50 lat z cukrzycą i innym czynnikiem ryzyka miażdżycy
- oraz wszystkie osoby z rozpoznaną chorobą miażdżycową w innym umiejscowieniu (np. w naczyniach wieńcowych lub szyjnych)9.
U wielu pacjentów z PAD nie występują objawy2,6. Jeśli objawy się pojawiają, najczęstszym z nich jest ból kończyn dolnych o następujących trzech różnych wzorcach: chromanie, ból niedokrwienny i ból atypowy. W 10-35% przypadków zgłaszane jest chromanie. Chromanie może być jednostronne lub obustronne, a opisywane jest jako zmęczenie lub ból, skurcze i pieczenie w mięśniach kończyny dolnej. Umiejscowienie bólu zależy od miejsca okluzji – okluzja na poziomie aorty prawdopodobnie spowoduje chromanie obustronne pośladków, ud i łydek. Okluzja tętnicy biodrowej wspólnej, tętnicy udowej wspólnej czy tętnicy udowej powierzchownej powoduje jednostronne chromanie odpowiednio pośladka, uda lub łydki16. Chromanie jest stale wywoływane przez wysiłek i ustępuje po 10-minutowym odpoczynku10.
W przypadku ciężkiego spadku perfuzji kończyny pacjent może uskarżać się na ból niedokrwienny, który jest ciągły i utrzymuje się nawet w spoczynku. Ból niedokrwienny często umiejscowiony jest w przodostopiu. Należy zauważyć, dla celów diagnostyki różnicowej, że w spoczynku ból niedokrwienny pogarsza się, gdy kończyna dolna jest uniesiona, i często trudno go odróżnić od neuropatii9. Ostre niedokrwienie typowo przejawia się nagłym/ostrym pojawieniem się tzw. „sześciu P” (pain, pallor, pulseless, paraesthesia, paralysis, „perishingly” cold – czyli bólu, bladości, braku pulsu, parestezji, porażenia i ostrego zimna), które stanowią sygnał ostrzegawczy istnienia ryzyka amputacji kończyny16. Z powodu chorób współistniejących i zmian w postrzeganiu bólu ból może być również „atypowy” i przybierać mieszane modele przejawiania się10. Objawy atypowe mogą różnić się od klasycznego opisu chromania z punktu widzenia jakości (np. pacjenci mogą opisywać dyskomfort łydki jako jej napięcie) lub umiejscowienia (np. pieczenie mięśnia czworogłowego uda)20. Warto zwrócić uwagę, że atypowe objawy mogą być częstsze od klasycznego chromania, co dla mniej doświadczonych klinicystów może stanowić utrudnienie rozpoznania3,11. Choć atypowe objawy ograniczają zdolność chodzenia, mało jest wciąż dowodów na poparcie raportowania tego ograniczenia i potrzebne są dalsze badania w celu zweryfikowania związku atypowych objawów ze zmianami niedokrwiennymi podczas ćwiczeń10,20. W celu zapoznania się z głównymi objawami PAD autorzy sugerują czytelnikom zapoznanie się z infografiką zaproponowaną przez Morleya i wsp.16 Profil ryzyka i konkretne objawy stwierdzone podczas wywiadu zasygnalizują potrzebę pogłębienia wywiadu i bezpośredniego badania fizykalnego.
Badanie fizykalne
Badanie fizykalne u pacjentów z ryzykiem PAD opisane jest krok po kroku w ramce obok. Badanie takie powinno obejmować oględziny skóry, paznokci i sprawdzenie temperatury kończyn. Pacjenci z PAD mają cieńszą skórę, hipertroficzne paznokcie z wypukłościami i obniżoną temperaturę kończyn dolnych9. Mogą także występować przebarwienia i utrata włosów3,13. Gdy przepływ krwi tętniczej jest niewystarczający do zaspokojenia potrzeb metabolicznych mięśni lub tkanek w spoczynku, PAD może także doprowadzać do powstawania ogniskowych obszarów niedokrwienia z martwicą skóry na całej jej grubości5. Choć test nawrotu kapilarnego jest często stosowany, ma on ograniczoną dokładność diagnostyczną3,13. Najbardziej wrażliwym badaniem jest natomiast palpacja tętna na tętnicy udowej, podkolanowej, grzbietowej stopy i piszczelowej tylnej3,9,13. Badanie powinno obejmować pomiar czynności życiowych, w tym ciśnienia krwi na obu kończynach górnych, oraz tętna w celu sprawdzenia profilu sercowo-naczyniowego9. Wytyczne praktyki klinicznej zalecają również, by zawsze przeprowadzać pomiar wskaźnika kostkowo-ramiennego (ABI – ankle- -brachial index) w spoczynku. ABI to stosunek ciśnienia skurczowego na stawie skokowym do ciśnienia skurczowego na tętnicy ramiennej. Przy pomocy arteriografii jako punktu odniesienia wykazano, że ABI niższy niż 0,90 ma wyższy stopień wrażliwości i specyficzności dla PAD. Ponadto stwierdzono związek między ABI a poziomem ciężkości choroby – wskaźnik między 0,5 a 0,9 związany jest z chromaniem, wskaźnik między 0,2 a 0,5 związany jest z bólem w spoczynku, a wskaźnik między 0 a 0,2 związany jest z utratą tkanki9,13.
Rozumowanie kliniczne
Wszystkie mające znaczenie informacje zebrane przez fizjoterapeutę podczas wywiadu i badania fizykalnego mogą potwierdzać podejrzenie PAD lub skłaniać do jego odrzucenia. Choć obliczanie ABI nie jest powszechnie stosowane w praktyce fizjoterapeutycznej, jego znajomość i umiejętność interpretacji są ważne dla celów interdyscyplinarnego porozumiewania się i postępowania. Jako że pacjenci z PAD zwykle cierpią na choroby współistniejące (np. sercowo-naczyniowe lub neuromięśniowo- -szkieletowe), rozpoznanie to nie oznacza automatycznie, że PAD jest źródłem objawów pacjenta; a jednak wczesne postawienie diagnozy jest niezbędne dla zrozumienia objawów i ułatwienia ustalenia priorytetów na ścieżce dalszego postępowania16. Dlatego też wymagana jest diagnoza różnicowa w celu ustalenia wszystkich patologii przyczyniających się do występowania bólu nogi. Zwłaszcza u pacjentów obciążonych ryzykiem (np. cukrzyków) należy przeprowadzić badanie przy pomocy monofilamentu w celu zidentyfikowania neuropatii obwodowej16. Pacjenci z czynnikami ryzyka PAD i jednym z następujących elementów: nagłe pojawienie się „sześciu P”, ból spoczynkowy w stopie od ponad dwóch tygodni, niegojące się rany lub gangrena, powinni być pilnie kierowani do specjalisty naczyniowego. Pomocne powinno być także, zwłaszcza jeśli podejrzewa się ból neuropatyczny związany z dolną częścią pleców, neurologiczne badanie obwodowe (np. w kierunku obniżonych odruchów głębokich ścięgien oraz zmian motorycznych i sensorycznych) i badanie czułości mechanosensorycznej nerwów (np. uniesienie wyprostowanej nogi lub test SLUMP) w kierunku radikulopatii lędźwiowo- krzyżowej lub scrining objawów prodromalnych stenozy lędźwiowej (tzn. typowo obustronnego drętwienia i osłabienia nóg, utraty czucia i słabości stopy, ustępowania objawów podczas zgięcia lędźwiowego)15,19.
Zakres fizjoterapii przy PAD
W codziennej praktyce możemy spotykać pacjentów z rozpoznaną lub nierozpoznaną PAD. Odpowiednie przeprowadzenie oceny i postępowania przy PAD stanowi odpowiedzialność zawodową fizjoterapeuty. Po pierwsze, jako że praktyka fizjoterapeutyczna zbliża się do modelu bardziej niezależnej opieki medycznej (World Confederation for Physical Therapy, 2019), jej rola w pierwotnym rozpoznawaniu cech budzących podejrzenia co do wcześniej nierozpoznanej PAD staje się niezwykle ważna z punktu widzenia zapewnienia pacjentowi bezpieczeństwa i skutecznego postępowania medycznego9,16.
Pacjenci z czynnikami ryzyka PAD i jednym z następujących elementów: nagłe pojawienie się „sześciu P”, ból spoczynkowy w stopie od ponad dwóch tygodni, niegojące się rany lub gangrena, powinni być pilnie kierowani do specjalisty naczyniowego. Osoby z obniżonym tętnem, objawami bólu atypowego lub chromaniem powinny być kierowane do lekarza podstawowej opieki zdrowotnej9,16. Po drugie, czujność fizjoterapeuty w zapewnianiu wczesnego wykrywania i kierowania na badania lekarskie jest jeszcze ważniejsza w przypadku pogorszenia się stanu pacjenta9,16. Po trzecie, fizjoterapeuci są osobami prowadzącymi terapię pacjentów z PAD i zalecającymi im niezbędne ćwiczenia16.
Postępowanie
Pacjentów bezobjawowych i z chromaniem przestankowym generalnie kieruje się do podstawowej opieki zdrowotnej. Fundament postępowania z PAD stanowi wczesna modyfikacja tych czynników ryzyka, na które mamy wpływ (rzucenie palenia, kontrola ciśnienia i hemoglobiny glikowanej, leki przeciwpłytkowe i utrata zbędnych kilogramów)16. Początkowe postępowanie obejmuje także terapię ćwiczeniową w celu zredukowania objawów16. Fizjoterapeuci odgrywają centralną rolę w zalecaniu i przeprowadzaniu programów ćwiczeniowych. Choć zarówno nadzorowane, jak i nienadzorowane ćwiczenia poprawiają objawy u pacjentów z PAD, wytyczne praktyki klinicznej zalecają nadzorowaną terapię ćwiczeniową jako leczenie pierwszego wyboru9. Jednakże skuteczną i bezpieczną alternatywą, jaką można brać pod uwagę, jest także program ćwiczeń w domu24, jako że często pacjenci nie są kierowani na ćwiczenia nadzorowane ze względu na niedostępność takich programów1. Istnieją niezgodności między wytycznymi, jeśli chodzi o dawkowanie ćwiczeń. ACC/AHA zaleca, by każda sesja trwała co najmniej 30-45 minut, przynajmniej 3 razy w tygodniu przez co najmniej 12 tygodni. Zalecenia niewiele jednak mówią na temat intensywności ćwiczeń. Niedawny przegląd systematyczny wykazał, że niska do umiarkowanej intensywność ćwiczeń przynosi więcej korzyści, jeśli chodzi o dystans marszu pokonywany bez bólu7. A jednak bardziej energiczne ćwiczenia dają lepsze wyniki, jeśli chodzi o maksymalny dystans marszu i wydolność krążeniowo-oddechową. Odnośnie do typów ćwiczeń najodpowiedniejsze dla poprawiania zdolności chodzenia jest chodzenie, podczas gdy inne formy ćwiczeń (np. jazda na rowerze i ćwiczenia kończyn górnych) lepiej poprawiają wydolność krążeniowo-oddechową. Dlatego też wskazane jest spersonalizowane podejście dostosowane do cech pacjenta i jego celów7. Jeśli program ćwiczeń nie jest skuteczny w kontrolowaniu objawów, zaleca się stosowanie leków naczynioaktywnych (np. naftidrofurylu lub cilostazolu)16. W razie pogorszenia się objawów, chromania wpływającego na jakość życia lub obecności krytycznego niedokrwienia kończyny zalecana jest konsultacja u specjalisty naczyniowego w celu przeprowadzenia dalszych badań (np. badania dopplerowskiego) i rozważenia procedury rewaskularyzacyjnej. Jak dotąd brak jest badań ustalających wpływ prerehabilitacji na procedury rewaskularyzacyjne18.
Wnioski i zalecenia
Rosnący wiek populacji, wysokie występowanie chorób sercowo-naczyniowych i PAD oraz typowa prezentacja kliniczna choroby – która może naśladować objawy innych powszechnych problemów neuromięśniowo-szkieletowych – to czynniki skłaniające do koncepcji, że fizjoterapeuci powinni być przeszkoleni do wykrywania i odpowiedniego kierowania pacjentów z PAD. Niniejszy artykuł podkreśla rolę czujności fizjoterapeuty w braniu pod uwagę tej choroby i przeprowadzaniu badań w jej kierunku oraz inicjowaniu odpowiedniej ścieżki postępowania. Zwraca on także uwagę, że układ naczyniowy należy rozpatrywać jako całość: konieczne jest przeprowadzenie pełnego badania naczyniowego w celu zebrania niezbędnych wskazówek anatomicznych i zrozumienia objawów pacjenta, brak rozpoznania w tej kwestii może mieć bowiem poważne konsekwencje.
Źródło: Musculoskeletal Science and Practice 2022; 61: 102611 ©2022 The Authors Adaptacja: Katarzyna Bogiel Na podstawie licencji CC BY (http://creativecommons.org/licenses/by/4.0/)
- Abaraogu, U.O., Abaraogu, O.D., Dall, P.M., Tew, G., Stuart, W., Brittenden, J., Seenan, C.A., 2020. Exercise therapy in routine management of peripheral arterial disease and intermittent claudication: a scoping review. Therapeutic Adv. Cardiovascular Disease 14, 1753944720924270. https://doi.org/10.1177/ 1753944720924270.
- Alahdab, F., Wang, A.T., Elraiyah, T.A., Malgor, R.D., Rizvi, A.Z., Lane, M.A., Prokop, L. J., Montori, V.M., Conte, M.S., Murad, M.H., 2015. A systematic review for the screening for peripheral arterial disease in asymptomatic patients. J. Vasc. Surg. 61, 42S–53S. https://doi.org/10.1016/j.jvs.2014.12.008.
- Boyko, E.J., Ahroni, J.H., Davignon, D., Stensel, V., Prigeon, R.L., Smith, D.G., 1997. Diagnostic utility of the history and physical examination for peripheral vascular disease among patients with diabetes mellitus. J. Clin. Epidemiol. 50, 659–668. https://doi.org/10.1016/s0895-4356(97)00005-x.
- Collins, T.C., Petersen, N.J., Suarez-Almazor, M., Ashton, C.M., 2003. The prevalence of peripheral arterial disease in a racially diverse population. Arch. Intern. Med. 163, 1469–1474. https://doi.org/10.1001/archinte.163.12.1469.
- Conte, S.M., Vale, P.R., 2018. Peripheral arterial disease. Heart Lung Circ. 27, 427–432. https://doi.org/10.1016/j.hlc.2017.10.014.
- Crawford, F., Welch, K., Andras, A., Chappell, F.M., 2016. Ankle brachial index for the diagnosis of lower limb peripheral arterial disease. Cochrane Database Syst. Rev. 9, CD010680. https://doi.org/10.1002/14651858.CD010680.pub2.
- Fassora, M., Calanca, L., Jaques, C., Mazzolai, L., Kayser, B., Lanzi, S., 2021. Intensity-dependent effects of exercise therapy on walking performance and aerobic fitness in symptomatic patients with lower-extremity peripheral artery disease: a systematic review and meta-analysis. Vasc. Med., 1358863X211034577 https://doi.org/ 10.1177/1358863X211034577. Firnhaber, J.M., Powell, C.S., 2019. Lower extremity peripheral artery disease: diagnosis and treatment. AFP 99, 362–369.
- Fowkes, F.G.R., Rudan, D., Rudan, I., Aboyans, V., Denenberg, J.O., McDermott, M.M., Norman, P.E., Sampson, U.K.A., Williams, L.J., Mensah, G.A., Criqui, M.H., 2013. Comparison of global estimates of prevalence and risk factors for peripheral artery disease in 2000 and 2010: a systematic review and analysis. Lancet 382, 1329–1340. https://doi.org/10.1016/S0140-6736(13)61249-0.
- Gerhard-Herman, M.D., Gornik, H.L., Barrett, C., Barshes, N.R., Corriere, M.A., Drachman, D.E., Fleisher, L.A., Flowkes, F.G.R., Hamburg, N.M., Kinlay, S., Lookstein, R., Misra, S., Mureebe, L., Olin, J.W., Patel, R.A.G., Regensteiner, J.G., Schanzer, A., Shishehbor, M.H., Stewart, K.J., Treat-Jacobson, D., Walsh, M.E., Halperin, J.L., 2017. 2016 AHA/ACC guideline on the management of patients with lower extremity peripheral artery disease. Circulation 135, e726–e779. https://doi. org/10.1161/CIR.0000000000000471.
- Hamburg, N.M., Creager, M.A., 2017. Pathophysiology of intermittent claudication in peripheral artery disease. Circ. J. 81, 281–289. https://doi.org/10.1253/circj.CJ-16- 1286.
- Hirsch, A.T., Criqui, M.H., Treat-Jacobson, D., Regensteiner, J.G., Creager, M.A., Olin, J. W., Krook, S.H., Hunninghake, D.B., Comerota, A.J., Walsh, M.E., McDermott, M.M., Hiatt, W.R., 2001. Peripheral arterial disease detection, awareness, and treatment in primary care. JAMA 286, 1317–1324. https://doi.org/10.1001/jama.286.11.1317.
- Joosten, M.M., Pai, J.K., Bertoia, M.L., Rimm, E.B., Spiegelman, D., Mittleman, M.A., Mukamal, K.J., 2012. Associations between conventional cardiovascular risk factors and risk of peripheral artery disease in men. JAMA 308, 1660–1667. https://doi. org/10.1001/jama.2012.13415.
- Khan, N.A., Rahim, S.A., Anand, S.S., Simel, D.L., Panju, A., 2006. Does the clinical examination predict lower extremity peripheral arterial disease? JAMA 295, 536–546. https://doi.org/10.1001/jama.295.5.536.
- Ko, S.H., Bandyk, D.F., 2013. Interpretation and significance of ankle-brachial systolic pressure index. Semin. Vasc. Surg. 26, 86–94. https://doi.org/10.1053/j. semvascsurg.2014.01.002.
- Kreiner, D.S., Hwang, S.W., Easa, J.E., Resnick, D.K., Baisden, J.L., Bess, S., Cho, C.H., DePalma, M.J., Dougherty, P., Fernand, R., Ghiselli, G., Hanna, A.S., Lamer, T., Lisi, A.J., Mazanec, D.J., Meagher, R.J., Nucci, R.C., Patel, R.D., Sembrano, J.N., Sharma, A.K., Summers, J.T., Taleghani, C.K., Tontz, W.L., Toton, J.F., North American Spine Society, 2014. An evidence-based clinical guideline for the diagnosis and treatment of lumbar disc herniation with radiculopathy. Spine J. 14, 180–191. https://doi.org/10.1016/j.spinee.2013.08.003.
- Morley, R.L., Sharma, A., Horsch, A.D., Hinchliffe, R.J., 2018. Peripheral artery disease. BMJ 360, j5842. https://doi.org/10.1136/bmj.j5842.
- Norgren, L., Hiatt, W.R., Dormandy, J.A., Nehler, M.R., Harris, K.A., Fowkes, F.G.R., TASC II Working Group, 2007. Inter-society consensus for the management of peripheral arterial disease (TASC II). J. Vasc. Surg. 45 (Suppl. S), S5–S67. https:// doi.org/10.1016/j.jvs.2006.12.037.
- Palmer, J., Pymer, S., Smith, G.E., Harwood, A.E., Ingle, L., Huang, C., Chetter, I.C., 2020. Presurgery exercise-based conditioning interventions (prehabilitation) in adults undergoing lower limb surgery for peripheral arterial disease. Cochrane Database Syst. Rev. 9, CD013407. https://doi.org/10.1002/14651858.CD013407. pub2.
- Schmid, A.B., Hailey, L., Tampin, B., 2018. Entrapment neuropathies: challenging common beliefs with novel evidence. J. Orthop. Sports Phys. Ther. 48, 58–62. https://doi.org/10.2519/jospt.2018.0603.
- Schorr, E.N., Peden-McAlpine, C., Treat-Jacobson, D., Lindquist, R., 2015. Characterization of the peripheral artery disease symptom experience. Geriatr. Nurs. 36, 293–300. https://doi.org/10.1016/j.gerinurse.2015.03.004.
- Selvin, E., Erlinger, T.P., 2004. Prevalence of and risk factors for peripheral arterial disease in the United States: results from the National Health and Nutrition Examination Survey, 1999-2000. Circulation 110, 738–743. https://doi.org/ 10.1161/01.CIR.0000137913.26087.F0.
- Selvin, E., Marinopoulos, S., Berkenblit, G., Rami, T., Brancati, F.L., Powe, N.R., Golden, S.H., 2004. Meta-analysis: glycosylated hemoglobin and cardiovascular disease in diabetes mellitus. Ann. Intern. Med. 141, 421–431. https://doi.org/ 10.7326/0003-4819-141-6-200409210-00007.
- Selvin, E., Wattanakit, K., Steffes, M.W., Coresh, J., Sharrett, A.R., 2006. HbA1c and peripheral arterial disease in diabetes: the Atherosclerosis Risk in Communities study. Diabetes Care 29, 877–882. https://doi.org/10.2337/diacare.29.04.06.dc05- 2018.
- Waddell, A., Seed, S., Broom, D.R., McGregor, G., Birkett, S.T., Harwood, A.E., 2021. Safety of home-based exercise for people with intermittent claudication: a systematic review. Vasc. Med., 1358863X211060388 https://doi.org/10.1177/ 1358863X211060388.
- Willigendael, E.M., Teijink, J.A.W., Bartelink, M.-L., Kuiken, B.W., Boiten, J., Moll, F.L., Büller, H.R., Prins, M.H., 2004. Influence of smoking on incidence and prevalence of peripheral arterial disease. J. Vasc. Surg. 40, 1158–1165. https://doi.org/10.1016/j. jvs.2004.08.049.
World Confederation for Physical Therapy, 2019. Policy Statement: Direct Access and Patient/client Self-Referral to Physical Therapy.