Sarkopenia - definicja
Przyspieszona utrata masy i funkcji mięśni szkieletowych stanowi przewidywalny element towarzyszący starzeniu się. Ten proces fizjologiczny atrofii mięśni, zmniejszania się siły i szybkości chodu nazywany jest łącznie sarkopenią. Do jego funkcjonalnych powiązań i konsekwencji należą: częste występowanie upadków i złamań, zaburzenia poruszania się, zespół słabości, zwiększona śmiertelność ogólna oraz znaczące indywidualne i społeczne obciążenie finansowe. Skurcze mięśni szkieletowych zależą od regulacji i koordynacji ich komponenty neuronowej, która również przechodzi znaczące adaptacje w reakcji na starzenie się. Końcową częścią układu nerwowo-ruchowego związaną ze skurczami mięśni jest jednostka motoryczna (MU – motor unit), która składa się z eferentnego motoneuronu oraz wszystkich unerwianych przez niego włókien mięśniowych.
W szeregu starzejących się ludzkich mięśni stwierdzono zmniejszoną liczbę jednostek motorycznych, co oznacza odnerwienie niektórych włókien mięśniowych, oraz wynikającą z tego zjawiska utratę masy mięśniowej i pogorszenie funkcji. Do odnerwienia włókien mięśniowych dochodzi nie tylko w procesie starzenia się, ale także w niektórych chorobach neuropatologicznych, takich jak stwardnienie zanikowe boczne czy automosalny recesywny rdzeniowy zanik mięśni u dzieci.
Elektrostymulacja nerwowo-mięśniowa dla osób starszych
Wykazano, że ćwiczenia oporowe stanowią skuteczny środek przeciwdziałający pogorszeniu układu nerwowo-mięśniowego m.in. u osób starszych. Jednakże w pewnych sytuacjach, takich jak uraz i/lub dłuższe pozostawanie w łóżku, niemożliwe jest zastosowanie interwencji polegającej na ćwiczeniach oporowych, zwłaszcza w populacji osób starszych. Jako terapię zastępczą łagodzącą lub leczącą utratę mięśni i spadek siły stosuje się elektrostymulację nerwowo-mięśniową (NMES – neuromuscular electrical stimulation).
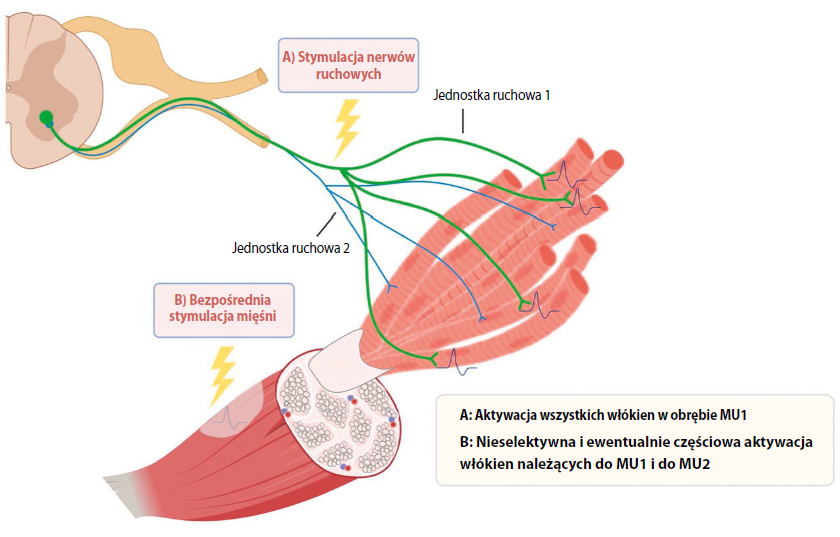
Skurcze mięśni szkieletowych wywoływane przez urządzenia elektrostymulacyjne są wynikiem depolaryzacji aksonów motoneuronów i ich odgałęzień. Można je wywołać na różne sposoby, na przykład poprzez bodźce docierające do powierzchownego brzuśca mięśnia przy pomocy samoprzylepnych elektrod powierzchniowych lub działające bezpośrednio nad nerwem ruchowym. W zależności od celów interwencji terapia NMES, złożona z cykli stymulacji i odpoczynku, prowadzona jest tygodniami lub miesiącami w takim zakresie częstotliwości, by wywoływać skurcze mięśni. Zgodnie z zasadą wielkości Hennemana rekrutacja jednostek motorycznych podczas skurczów dowolnych odbywa się według czasowo asynchronicznego, przestrzennie rozpraszającego się wzorca od włókien mięśniowych wolnokurczliwych do szybkokurczliwych, od małych jednostek motorycznych do większych, natomiast wzorzec rekrutacji podczas NMES jest czasowo zsynchronizowany, stały przestrzennie i nieselektywny, czego dowodzi wczesna rekrutacja dużej liczby łatwo męczących się szybkokurczliwych włókien mięśniowych.
W odróżnieniu od stymulacji nerwów motorycznych aktywujących wszystkie włókna mięśniowe w obrębie jednostki motorycznej bezpośrednia stymulacja mięśni nieselektywnie aktywuje włókna znajdujące się w pobliżu elektrod stymulujących, które mogą nie obejmować pełnych jednostek motorycznych (ryc. 1). Pobudzenie mięśnia czy nerwu w dużej mierze zależy od bliskości elektrody stymulującej, a depolaryzacja aksonu zależy także od oporności błony. Pokrótce rzecz ujmując, NMES wywołuje słabo określoną rekrutację jednostek motorycznych przebiegającą w kolejności niefizjologicznej.
Choć metodę NMES stosuje się jako leczenie kliniczne w celu utrzymania lub zwiększenia siły mięśni i złagodzenia ich napięcia, ocena jej skuteczności oparta jest głównie na nielicznych parametrach, zmierzonych w badaniach w większości z udziałem osób młodych. Dane te nie tłumaczą różnorodnych adaptacji, tzn. odpowiedzi molekularnych we włóknach mięśniowych oraz adaptacji uznawanych za mające znaczenie kliniczne, czyli wpływające na takie aspekty jak kontrola motoryczna czy równowaga. Co ważne, mechanizmy NMES zachodzące podczas oddziaływania na obwodowy ruchowy układ nerwowy i wywoływane przez tę metodę zmiany adaptacyjne w złączu nerwowo-mięśniowym (inaczej płytce ruchowej, NMJ – neuromuscular junction) u ludzi pozostają w dużym stopniu niezbadane.
Dlatego też celem niniejszego przeglądu jest zgłębienie fizjologii NMES odnośnie do adaptacji nerwowych i mięśniowych w badaniach na zwierzętach i na ludziach z zamierzeniem utworzenia solidniejszych podstaw dla przyszłych badań nad starzeniem się.
Jakie działanie ma elektrostymulacja nerwowo-mięśniowa na neuroplastyczność
Elektromiografia (EMG), czyli rejestrowanie elektrycznej aktywności mięśni, to metoda powszechnie akceptowana i wykorzystywana do badania struktury i funkcji jednostki ruchowej. Metody elektromiograficzne różnią się złożonością, ale generalnie polegają na pomiarach powierzchniowych i/lub wewnątrzmięśniowych w celu wygenerowania odzwierciedlenia wymiany jonowej zachodzącej w błonie włókna mięśniowego.
Zsumowany potencjał czynnościowy pojedynczej jednostki ruchowej określany jest jako potencjał jednostki ruchowej (MUP – motor unit potential) i stanowi on sumę depolaryzacji z włókien unerwionych przez ten sam akson znajdujących się w zasięgu elektrody rejestrującej. Cechy MUP, takie jak amplituda, czas trwania, fazy, itd., odzwierciedlają poszczególne aspekty MU, takie jak wielkość, gęstość włókien oraz złożoność, rutynowo wykorzystywane w zastosowaniach klinicznych. Zastosowanie znajdują również pomiary złożonego potencjału czynnościowego mięśnia (CMAP – compound muscle action potential) wywoływanego przez maksymalną elektrostymulację w celu oszacowania pobudliwości mięśni podczas skurczów mimowolnych; jest on związany z fizyczną słabością w populacjach osób starszych. Obliczanie czynnych jednostek ruchowych (MUNE – motor unit number estimates) stosuje się ogólnie w celu śledzenia utraty jednostek ruchowych w przebiegu rozmaitych patologii lub w celu porównania różnych populacji, np. osób młodych ze starszymi.
Mimowolne skurcze mięśni generowane przez NMES uważa się za potencjalną strategię ograniczania utraty włókien mięśniowych spowodowanej odnerwieniem i utrzymania funkcji mięśni, przy udziale ścieżek eferentnych i aferentnych. Depolaryzacja aksonów motorycznych wywołana przez NMES przenosi sygnały zstępujące bezpośrednio do motorycznej płytki końcowej, a równolegle neurony czuciowe depolaryzują i przesyłają do rdzenia kręgowego sygnały wstępujące otrzymane z bezpośredniej depolaryzacji, wrzecionek nerwowo-mięśniowych, narządów ścięgnistych Golgiego i receptorów skórnych. Powtarzająca się aktywacja aferentów generuje bodźce somatosensoryczne, skutkujące zaangażowaniem układu ośrodkowego i obwodowego.
W badaniach nad plastycznością obwodowego układu nerwowego wywoływaną przez elektrostymulację nerwowo-mięśnioą brakuje przekonujących dowodów z badań na ludziach i większość danych pochodzi z modeli zwierzęcych. Na przykład elektrostymulacji poddano mięśnie ud szczurów po przecięciu nerwu kulszowego, uzyskując w dużym stopniu ponowne unerwienie odnerwionych włókien mięśniowych. Podobnie u królików zaobserwowano większy rozmiar MUP po NMES o wysokim natężeniu, co sugeruje, że NMES poprawiła zdolność neuronów ruchowych do regeneracji.
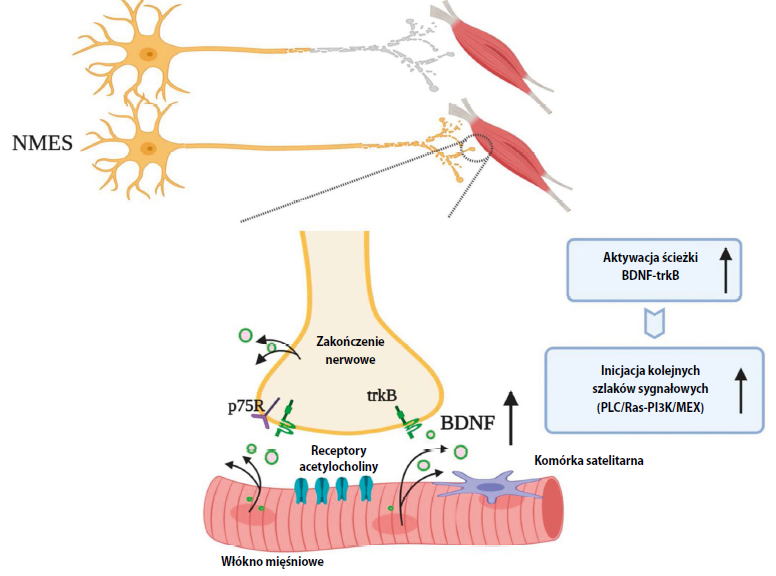
Udana regeneracja nerwów i ponowne unerwienie mięśni po NMES ostatecznie zależą od homeostatycznej plastyczności złącza nerwowo-mięśniowego. Ekspansja MU wymaga kiełkowania aksonów oraz zdolności pierwotnych nienaruszonych aksonów do tworzenia dodatkowych połączeń nerwowo- -mięśniowych w synapsach. Do procesu regeneracji aksonów po NMES przyczynia się ciągłe dostarczanie czynników neurotroficznych, takich jak neurotroficzny czynnik pochodzenia mózgowego (BDNF – brain- derived neurotrophic factor), neurotroficzny czynnik pochodzenia glejowego (GDNF – glial-derived neurotrophic factor) oraz czynnik wzrostu nerwów (NGF – nerve growth factor). Spośród wszystkich czynników neurotroficznych najważniejszą molekułą biorącą udział w regeneracji aksonów jest BDNF, a udowodniono, że po NMES jego ekspresja rośnie. Zwiększona ekspresja BDNF może sprzyjać kiełkowaniu aksonów poprzez ścieżkę sygnałową receptoru trkB (ryc. 2), po czym następuje inicjacja kolejnych szlaków sygnałowych, między innymi ścieżek BDNF-PLC/Ras-PI3K/MEX, a gdy już kiełek aksonu sięgnie do włókna mięśniowego i ukończy formację nienaruszonego złącza nerwowo-mięśniowego, rola BDNF ulegnie modyfikacji i czynnik ten będzie się teraz wiązał z receptorem p75 zakończenia nerwowego w celu zahamowania wzrostu aksonu i przywrócenia połączeń funkcjonalnych w złączu nerwowo-mięśniowym.
Pewna intensywność i czas trwania ćwiczeń celowych przyczyniają się do zwiększenia poziomu BDNF, a takie zwiększenie ma związek ze stężeniem mleczanu we krwi, które, jak wiadomo, rośnie podczas ćwiczeń. W badaniach zarówno na zwierzętach, jak i z udziałem ludzi obserwowano, że NMES zwiększała poziom BDNF i mleczanu, przy czym poziom BDNF osiągał podobną lub nawet wyższą wartość niż podczas ćwiczeń celowych, a podwyższenie poziomu mleczanu było pozytywnie skorelowane ze zwiększeniem ilości BDNF. Zwiększenie poziomu BDNF i stężenia mleczanu po mimowolnych skurczach mięśni o niskiej intensywności prawdopodobnie wynika z nieselektywnego wzorca rekrutacji jednostek ruchowych, przy czym NMES aktywuje dodatkowe szybkokurczliwe jednostki ruchowe. Nawet jeśli elektrostymulacja nie przebiega według odwróconej kolejności rekrutacji, obowiązująca podczas niej zasada nieselektywności ma potencjał aktywowania większego odsetka jednostek ruchowych o wysokim progu.
Biorąc pod uwagę rosnącą liczbę dowodów podkreślających adaptacje do obwodowego układu ruchowego jako główny czynnik przyczyniający się do utraty masy mięśniowej i funkcji u ludzi, dane z eksperymentów na zwierzętach pozwoliły na utworzenie mechanistycznych podstaw eksploracji korzyści z NMES jako strategii pre/rehabilitacji w celu sprzyjania adaptacjom nerwowym w badaniach z udziałem ludzi.
Efekty morfologiczne elektrostymulacji nerwowo-mięśniowej
Głównymi konsekwencjami niedoborów nerwowo-mięśniowych są atrofia mięśni i niezdolność do wytwarzania skutecznej siły. Budowa mięśni oceniana jest na podstawie fizjologicznego lub anatomicznego obszaru przekroju poprzecznego (CSA – cross-sectional area), długości włókien mięśniowych i kąta pennacji. Choć dane z badań są niejednoznaczne ze względu na udział różnych populacji, różnice między protokołami NMES oraz włączanie ćwiczeń oporowych i/lub interwencji żywieniowych, ogólnie prawdopodobne jest, że NMES pozytywnie wpływa na całkowity rozmiar mięśni u ludzi.
Osiem tygodni terapii NMES wysokiej częstotliwości (75 Hz) mięśnia obszernego bocznego i mięśnia obszernego przyśrodkowego u zdrowych osób starszych skutkowało znaczącym zwiększeniem CSA.
Stymulacja NMES prowadzona przez 4 miesiące wywołała także zwiększenie CSA prostowników kolana, przy czym większą zmianę obserwowano przy połączeniu terapii z ćwiczeniami celowymi. Na poziomie poszczególnych włókien mięśniowych badania histochemiczne i morfologiczne po dziewięciu tygodniach NMES ujawniły, że doszło do zwiększenia średnicy włókien szybkich i ich odsetka, natomiast średnica włókien wolnych się zmniejszyła.
Dystrybucja i klasyfikacja włókien mięśniowych u ludzi oparta jest o kontekst trzech głównych zidentyfikowanych izoform łańcuchów ciężkich miozyny (MHC – myosin heavy chain), czyli typu 1, 2A i 2X. U osób starszych przechodzących ośmiotygodniową terapię NMES zaobserwowano zwiększenie ekspresji MHC-2A i zmniejszenie ekspresji MHC-1. Różnice w plastyczności MHC po terapii NMES można przypisać różnicom w poziomach stymulacji i/lub zmienności nieselektywnej kolejności rekrutacji MU. Bez względu na bodźce nerwowe czy zakres stosowanych protokołów istnieje również szereg czynników, które przyczyniają się do zmiany fenotypu MHC, jak na przykład poziom aktywności fizycznej danej osoby (siedzący lub aktywny tryb życia), które mogą wpływać na dystrybucję izoform MHC istniejącą w momencie początkowym.
W połączeniu ze zmianami adaptacyjnymi w architekturze mięśni przedmiotem zainteresowania są zachodzące pod wpływem NMES adaptacje włośniczek włókien mięśniowych ze względu na ich rolę w dostarczaniu substratów, takich jak tlen, co jest bezpośrednio związane z wielkością włókna mięśniowego.
Wykazano, że zarówno proliferacja włośniczek, jak i wzrost włókien mięśniowych w mięśniach szkieletowych u ludzi zachodzą według podobnego planu czasowego, co sugeruje istnienie związku między kapilaryzacją a hipertrofią włókien mięśniowych. Choć niewiele jest danych na temat adaptacji zaopatrzenia włośniczkowego u zdrowych osób starszych, stwierdzono, że NMES wysokiej częstotliwości poprawia kapilaryzację mięśni i poprzedza konwersję fenotypu włókien mięśniowych, co podkreśla znaczenie angiogenezy i kapilaryzacji włókien mięśniowych, szczególnie w mięśniach osób starszych.
Molekularne efekty elektrostymulacji nerwowo-mięśniowej
Synteza białek mięśniowych
Brak równowagi między syntezą białek mięśniowych (MPS – muscle protein synthesis) a rozpadem białek mięśniowych (MPB – muscle protein breakdown) prowadzi bezpośrednio do atrofii poszczególnych włókien i ogólnej atrofii mięśniowej. Głównymi środkami zaradczymi łagodzącymi atrofię mięśniową lub jej zapobiegającymi są żywienie bogate w białko oraz ćwiczenia. Bez względu na sposób odżywiania się nawet ćwiczenia o niewielkiej objętości są w stanie utrzymać masę mięśni szkieletowych, co jeszcze bardziej podkreśla potencjał NMES jako terapii interwencyjnej.
Udowodniono, że NMES odgrywa ważną rolę w minimalizowaniu spadku czynnościowego spowodowanego starzeniem się. U zdrowych osób starszych terapia NMES i suplementacja białka podczas pięciu dni leżenia w łóżku zapobiegła znaczącemu ubytkowi masy mięśniowej, jakiego można by się spodziewać bez interwencji. Dirks i wsp. sprawdzili skuteczność NMES połączonej z przyjmowaniem białka przed snem odnośnie do MPS u osób starszych. Przed podaniem 20 g białka przeprowadzono 70-minutową sesję NMES na jednej kończynie dolnej, a biopsja mięśni wykonana po czterech godzinach nie wykazała żadnych różnic między nogą stymulowaną i nogą kontrolną odnośnie do MPS włókien mięśniowych. Jednakże ten sam protokół NMES obejmujący podanie 40 zamiast 20 g białka wykazał nasilenie syntezy białek mięśniowych 8 godzin po spożyciu białka, co sugeruje, że odpowiedź metaboliczna na NMES jest wrażliwa na interwencję żywieniową i zależy od czasu. Przeprowadzono także pojedynczą sesję NMES u osób starszych z cukrzycą typu 2, które, jak wiadomo, są bardziej narażone na utratę mięśni i pogorszenie funkcjonowania. W eksperymencie wykazano, że NMES przyniosła duży wzrost (o 27%) MPS. Cztery tygodnie codziennej domowej terapii NMES u pacjentów z chorobą zwyrodnieniową kolana skutkowały zwiększeniem wielkości włókien mięśniowych, któremu towarzyszyła nasilona synteza białek mięśniowych. Według ograniczonych dostępnych danych na temat NMES i MPS elektrostymulacja neuromięśniowa używana bezpośrednio jako terapia izolowana lub jako terapia wspomagająca interwencje żywieniowe (oparte na białku) może nasilać MPS, a przez to pomagać w łagodzeniu oporu anabolicznego często obserwowanego w starzejących się mięśniach.
Adaptacje metaboliczne
Termin „ćwiczenia” zwykle odnosi się do dwóch ich typów – aerobowego treningu wytrzymałościowego oraz anaerobowego treningu oporowego lub ich połączenia. Każdy z tych rodzajów treningu wiąże się z odrębnymi adaptacjami fizjologicznymi, między innymi z wewnątrzmięśniowymi zmianami metabolicznymi, takimi jak zmiany w aktywności enzymów oksydacyjnych przy treningu wytrzymałościowym i aktywności enzymów glikolitycznych przy treningu oporowym.
Najpowszechniejszą reakcją enzymatyczną w ludzkim organizmie jest cykl Krebsa (cykl kwasów trikarboksylowych), podczas którego bardzo ważną rolę odgrywa syntaza cytrynianowa (CS – citrate synthase). Dane z czterech badań, w których stosowano NMES o niskiej częstotliwości przez 4-10 tygodni, wykazały wzrost poziomu aktywności CS o 9-31%, przy czym większe wzrosty obserwowano u kobiet niż u mężczyzn.
Ponadto Theriault i wsp. zbadali odpowiedź enzymów metabolicznych na różne długości interwencji NMES i wykazali, że poziom aktywności CS wzrósł po czterech tygodniach i nie zmienił się po dodatkowych czterech tygodniach. Podobnie poziom dehydrogenazy izocytrynianowej (IDH – isocitrate dehydrogenase), innego enzymu biorącego udział w cyklu Krebsa, także wzrósł po ośmiu tygodniach terapii NMES o wysokiej częstotliwości. Warunkiem uzyskania energii w cyklu Krebsa jest β-oksydacja kwasów tłuszczowych, a po NMES o niskiej częstotliwości zaobserwowano 30-procentowy wzrost poziomu HADH (dehydrogenazy 3-hydroksyacylo-koenzymu A).
Jednakże po zastosowaniu NMES o wysokiej częstotliwości wynik ten się odwrócił i zaobserwowano trend spadkowy. Ustalenia z tego samego badania obejmowały również wzrost w drugim kroku β-oksydacji – wyższy poziom hydratazy enoilo-koenzymu A. Jeśli chodzi o inne enzymy oksydacyjne, po kilkutygodniowej stymulacji NMES wzrósł poziom dehydrogenazy bursztynianowej, oksydazy cytochromowej oraz dehydrogenazy pirogronianowej. Inaczej niż w przypadku enzymów oksydacyjnych, których poziom znacząco wzrósł w większości eksperymentów, ilość enzymów glikolitycznych po NMES się nie zmieniła lub nawet spadła. Na przykład chociaż po dzięsięciotygodniowej interwencji NMES stwierdzono spadek poziomu aktywności dehydrogenazy aldehydu 3-fosfoglicerynowego (GAPDH), odrębne badanie wykazało, że nie zmienił się on po sześciu tygodniach NMES o niskiej częstotliwości. Jednakże inny enzym glikolityczny, fosfofruktokinaza (PFK), wykazał łagodny spadek aktywności po 6 tygodniach interwencji, wyraźny u mężczyzn (spadek o 10%), a nieznaczny u kobiet.
NMES o wysokiej częstotliwości u młodych osób aktywnych oraz prowadzących siedzący tryb życia przyniosła różne wyniki, jeśli chodzi o beta enolazę, enzym glikolityczny biorący udział w procesie glikolizy kwasu 2-fosfoglicerynowego do fosfoenolopirogronianu (PEP) – zaobserwowano wzrost tego enzymu u osób aktywnych i brak zmiany w grupie prowadzącej siedzący tryb życia.
Jednakże większość badań sprawdzających aktywność enzymów metabolicznych skupiała się na NMES o niskiej częstotliwości, a dostępne dane na temat NMES o wysokiej częstotliwości są ograniczone. Ponadto choć niektóre badania z długoterminowym zastosowaniem NMES o niskiej częstotliwości wykazały korzystny wpływ na zdolność do oksydacji, niektóre z tych protokołów mogą być zbyt uciążliwe i niepraktyczne do stosowania w populacji osób starszych.
Efekty funkcjonalne elektrostymulacji nerwowo-mięśniowej
Udowodniono, że NMES odgrywa ważną rolę w minimalizowaniu spadku czynnościowego spowodowanego starzeniem się. Moment mięśniowy u osób starszych, ustalony przez pomiar maksymalnych izometrycznych skurczów celowych (MVC – maximal voluntary contractions), zwiększył się po kilku tygodniach interwencji NMES. Poza bezpośrednim pomiarem siły mięśni w praktyce klinicznej czy badaniach zaleca się stosowanie szeregu testów funkcjonalnych, takich jak na przykład test „wstań i idź” (TUG – timed up and go), skalę równowagi Berg (BBS – Berg balance scale) oraz baterię krótkich testów sprawności fizycznej (SPPB – short physical performance battery).
Okazało się, że interwencje oparte o NMES skracają czas wykonywania czynności życia codziennego, takich jak wchodzenie po schodach, co może wskazywać na zwiększenie siły mięśni i kończyn dolnych u osób starszych. Przy zastosowaniu podobnej częstotliwości stymulacji i podwojonej liczby sesji treningowych NMES poprawiła prędkość chodu i równowagę, natomiast wynik testu „wstań i idź” poprawił się jedynie w grupie łączącej NMES z ćwiczeniami celowymi.
Choć patologie związane ze starzeniem się mięśni i ich nieużywaniem są różne, często są one silnie ze sobą powiązane. Nierzadko dochodzi do unieruchomienia osób starszych, jako że pogorszenie się ich możliwości funkcjonalnych zwiększa ryzyko upadków i złamań. Terapia NMES stosowana w celu poprawy odzyskiwania sprawności u starszych kobiet po operacji z powodu złamania biodra przyniosła szybsze odzyskanie mobilności.
Ponadto ocena przeprowadzona po sześciu dodatkowych tygodniach katamnezy ujawniła, że NMES przyniosła długoterminowy efekt funkcjonalny w postaci większej prędkości chodzenia oraz lepszej stabilności posturalnej i zwiększonej siły mięśni. Liczne badania wykazały, że NMES wywołuje znaczące złagodzenie atrofii mięśniowej podczas unieruchomienia lub po nim, choć ze względu na dużą różnorodność procedur i protokołów przeprowadzenie wiarygodnych bezpośrednich porównań nie jest możliwe. Ogólnie rzecz biorąc, dostępne dane świadczą o tym, że NMES wywiera korzystny wpływ na rehabilitację funkcjonalną.
Wnioski z badań nad związkiem elektrostymulacji nerwowo-mięśniowej na neuroplastyczność
Przegląd niniejszy opisuje adaptacje do NMES zachodzące na poziomie poszczególnych włókien mięśniowych oraz w obrębie obwodowego układu nerwowo-ruchowego. Choć praca ta nie wyczerpuje tematu licznych patologii, przy których NMES ma zastosowanie, większość ustaleń wskazuje, że NMES wywiera korzystny wpływ na przebudowę neuronalną i mięśniową odnośnie do morfologicznych, molekularnych i funkcjonalnych aspektów u osób starszych. Pozyskana dotąd wiedza mechanistyczna pochodzi głównie z eksperymentów na zwierzętach, a danych z badań z udziałem ludzi jest niewiele, co wskazuje ewentualny kierunek przyszłych dociekań.
Źródło: Mechanisms of Ageing and Development. 2021; 193: 111402
©2020 The Authors Adaptacja: Katarzyna Bogiel
Na podstawie licencji CC BY (http://creativecommons.org/ licenses/by/4.0/)
Oryginalny tekst wraz z bibliografią: https://www.sciencedirect. com/science/article/pii/ S0047637420301986?via%3Dihub