W tym celu 14 pacjentów z cLBP i 14 zdrowych ochotników zostało poproszonych o wykonanie 120 sekundowej próby wysiłkowej o niskiej intensywności z zaangażowaniem mięśnia prostownika grzbietu. Wyniki tego badania ujawniły, że brak odczucia ciężkości wykonanego wysiłku ma wpływ na pojawienie się bólu w dolnej części pleców. Osoby doświadczające cLBP przeszacowały wysiłek związany z prostowaniem pleców, a błąd ten wzrastał wraz z postępem wykonywanego wysiłku. Jednak dzięki wizualnej informacji zwrotnej osoby z cLBP były w stanie skompensować tę nieprawidłowość i wykonać zadanie tak dokładnie, jak osoby zdrowe.
Wprowadzenie
Propriocepcja (czucie głębokie) to zdolność do odczuwania położenia poszczególnych stawów oraz ruchy w nich zachodzące (kinestezja), a także odczuwanie siły nacisku, ciężaru czy wysiłku (Proske i Gandevia, 2012). Wrzecionka mięśniowe wraz z receptorami skóry i stawów są odpowiedzialne za odczucie położenia i ruchu, a receptory zlokalizowane w ścięgnach zapewniają odczucie skurczu mięśni. Odczucie wysiłku lub ciężkości różni się od innych doznań, ponieważ uważa się, że generowane jest w ośrodkowym układzie nerwowym i nie wymaga udziału receptorów obwodowych (de Morree i in., 2012).
Zaburzenia propriocepcji są często zgłaszane u osób z LBP, chociaż kilka badań nie wykazało ich istnienia u osób z tymi dolegliwościami (Laird i in., 2014; Tong i in., 2017). Argumentowano to w taki sposób, że wrzecionka mięśniowe nie pełnią swojej funkcji jako sensory położenia (Proske i Allen, 2019). Zatem hipoteza o tym, że wrzecionka mięśniowe odgrywają główną rolę w kinestezji może być niepoprawna. Podobnie pogląd, że zaburzenia proprioceptywne u osób z LBP odzwierciedlają błędy w przetwarzaniu impulsów nerwowych może wymagać ponownej analizy. Wykazano również, że informacje o położeniu pochodzą z komendy mózgu dotyczącej wykonania ruchu i wysiłku związanego z ruchem (Gandevia i in., 2006; Smith i in., 2009; Walsh et al., 2004; Weerakkody i wsp., 2003). (Brooks i in., 2013; Luu i in., 2011; Monjo i in., 2018). Badania wskazują, że gdy ruchy są wykonywane świadomie, centralnie generowane komendy motoryczne są źródłem informacji kinestetycznych (Proske i Allen, 2019). Alternatywną hipotezą jest to, że zaburzenie propriocepcji w cLBP wynika z niepoprawnie wydanych komend motorycznych lub niepoprawnego odczucia wykonania wysiłku, które przyczyniają się do błędów w "odczycie" położenia.
Uczestnicy tego badania mieli wizualne informacje zwrotne na temat siły użytej podczas eksperymentu, zatem mogli polegać na wizualnym, a nie proprioceptywnym sprzężeniu zwrotnym.
Materiały i metody
Uczestnicy
W badaniu wzięło udział 28 ochotników (grupa badana – 14 osób z cLBP, grupa kontrolna - 14 zdrowych ochotników) w wieku od 18 do 50 lat, bez zaburzeń neurologicznych i oddechowych.
Kryteriami włączenia do grupy badanej była obecność LBP przez co najmniej 6 miesięcy, która ograniczała aktywność życia codziennego i dla której poszukiwano jakiejś formy leczenia, takiej jak leki, konsultacja lekarska lub fizjoterapia. Zgodnie z wcześniejszymi badaniami nad kontrolą motoryczną w cLBP (np. Pranata i in., 2017; van den Hoorn i in., 2012), rekrutowano osoby z łagodnym cLBP (tj. natężenie bólu między 0,5 a 4,4 cm w 10-centymetrowej wizualnej skali analogowej (Jensen i in., 2003), w zakresie od 0 (brak bólu) do 10 (najgorszy możliwy ból)).
Kryteria wykluczenia obejmowały wcześniej przebytą operację kręgosłupa, deformacje kręgosłupa, takie jak skolioza, lub umiarkowany lub ciężki wskaźnik natężenia bólu (ponad 4,4 cm w wizualnej skali analogowej (Jensen i in., 2003).
Uczestnicy kontrolni nie mogli mieć znaczącego LBP w ciągu ostatnich dwóch lat.
Skale bólu i funkcji
Uczestnicy wypełnili przed sesją testową Kwestionariusz Oswestry oraz Kwestionariusz Roland-Morris’a oceniające wpływ bólu kręgosłupa na codzienne funkcjonowanie. Ocenili swój obecny i najgorszy poziom bólu w ciągu ostatniego tygodnia w 10-centymetrowej wizualnej skali analogowej (od 0 (brak bólu) do 10 (najgorszy możliwy ból, jaki można sobie wyobrazić). Uczestnicy wypełnili również Kwestionariusz Baecke’a oceniający poziom aktywności fizycznej będącej częścią ich życia codziennego (Carvalho i in., 2017).
Opis przeprowadzonego zadania wysiłkowego
Uczestnicy utrzymywali pozycję półsiedzącą poprzez dociśnięcie miednicy aluminiową ramą (Ryc.1). Wykonywano przez 120 sekund ćwiczenie prostowania tułowia przeciwko stalowej lince zapewniającej zmienną siłę oporu. Wartość siły oporu zmieniana była w sposób pseudolosowy od 3 do 10% średniej, maksymalnej siły izometrycznego rozciągnięcia tułowia określonej dla osób zdrowych.
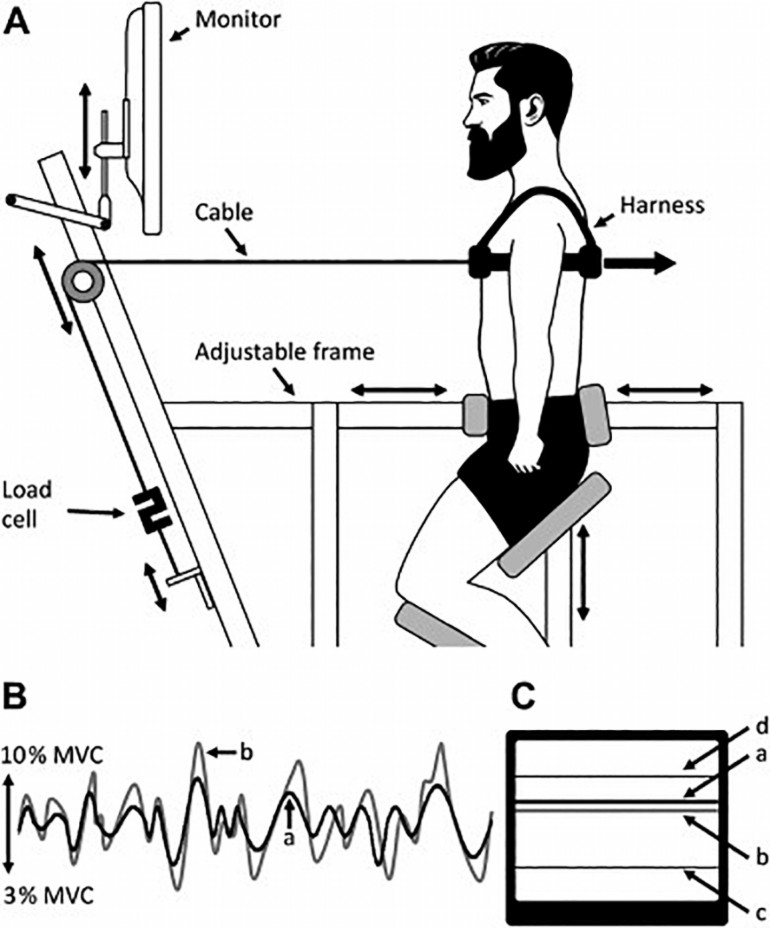
Ryc. 1. (A) Układ doświadczalny przedstawiający uczestnika w pozycji półsiedzącej ustabilizowanej aluminiową ramą (B) Wartość siły docelowej zmienianej w sposób pseudolosowy (czarna linia) oraz wartość siły rozciągnięcia tułowia wygenerowanej przez uczestnika (szara linia). (C) Monitor wyświetlał siłę docelową jako poziomą linię (a), która poruszała się w górę i w dół w sposób pseudolosowy. W próbach z wizualnym sprzężeniem zwrotnym druga pozioma linia (b) wyświetlała wygenerowaną siłę rozciągnięcia tułowia. Maksymalne i minimalne wartości, między którymi zmieniała się siła docelowa (c: 3% MVC; d: 10% MVC) były wyświetlane podczas wszystkich prób.
Aby ocenić średni Maksymalny Dobrowolny Skurcz (maximum voluntary contraction - MVC), przeprowadzono eksperyment testowy z udziałem 9 mężczyzn (średni wiek: 25,8) i 7 kobiet (średni wiek: 23 lat). Uczestnicy zostali umieszczeni w tej samej pozycji jak podczas głównego eksperymentu. Dla każdego uczestnika określono maksymalną wartość siły rozciągnięcia tułowia podczas trzech 3 sekundowych prób MVC (średnia siła wyprostu określona dla mężczyzn: 70,3 kg; i dla kobiet: 39,5 kg). Na podstawie wyników osiągniętych w tym teście określono, że siła oporu linki wahała się od 2,5 kg (3%) do 7,5 kg (10%) dla mężczyzn i od 1,5 kg (3%) do 7,5 kg (10%) dla kobiet. Zdecydowano się na niski % MVC, aby uniknąć możliwego zaostrzenia się cLBP, aby odzwierciedlić poziomy aktywności fizycznej wykonywanej zarówno przez osoby z cLBP, jak i zdrowych uczestników i aby zminimalizować wpływ możliwych zmian funkcjonalnych i strukturalnych w mięśniu prostownika grzbietu (Hodges i Danneels, 2019).
Każda 120-sekundowa próba głównego eksperymentu była następnie przeprowadzona przy wartości średniej siły docelowej tj. 6,5% MVC. Przed każdą próbą poziom siły z 6,5% MVC był wyświetlany przez 15 sekund, aby umożliwić uczestnikom wygenerowanie wymaganej siły początkowej.
Próbę dopasowania użytej siły do siły docelowej wykonano w dwóch różnych warunkach. W pierwszym przypadku uczestnik otrzymał wizualną informację o sile docelowej i sile wygenerowanej. Obie siły były wyświetlane na monitorze komputera jako poziome linie o różnych kolorach (rys. 1C). W drugim przypadku zaś, wizualna informacja o sile wygenerowanej została usunięta, aby wyeliminować odruch eksteroreceptywny. Wyświetlano natomiast minimalną (3%) i maksymalną (10%) granicę siły docelowej. Wizualna informacja zwrotna na temat generowania siły została usunięta, gdy uczestnik utrzymał początkowy poziom siły z 6,5% MVC przez 2-3 sekundy. Obie metody dopasowania siły docelowej były oferowane w losowej kolejności, a każda próba była wykonywana raz z 2-minutowym odpoczynkiem między nimi. Przed rozpoczęciem badania przeprowadzono jedną próbę praktyczną z wizualną informacją zwrotną, aby zapoznać uczestników z konfiguracją eksperymentalną, zadaniami i wymaganym poziomem siły.
Analiza danych
Na podstawie wykresów generowanej siły określono 3 następujące parametry: (1) dokładność wykonania próby wysiłkowej, (2) przekroczenie minimalnej lub maksymalnej wartości siły docelowej oraz (3) dryf danych.
Dokładność: Obszar między dwoma wykresami (siły docelowej i wygenerowanej) został obliczony jako miara dokładności wygenerowania siły (tj. obszar błędu). Większy obszar błędu reprezentuje większe rozbieżności między siłą docelową a generowaną i odzwierciedla niższą dokładność.
Przewartościowanie lub niedoszacowanie siły generowanej: Aby określić, czy uczestnicy prawidłowo oszacowali wartość siły generowanej, obliczono średni błąd pomiaru (różnica między siłą docelową a wygenerowaną siłą). Dało to średnią wartość dodatnią lub ujemną. Wartości dodatnie wskazują, że średnia wartość siły wygenerowanej przekroczyła wartość docelową, co oznacza, że uczestnik nie docenił siły, którą generował. Wartości ujemne reprezentują przewartościowanie generowanej siły.
Oba błędy zostały zinterpretowane jako zaburzone poczucie wysiłku.
Dryft: Całkowite odchylenie wartości siły generowanej od wartości siły docelowej przeanalizowano poprzez dopasowanie linii trendu do wykresu odpowiadającemu wygenerowanej sile. Linia trendu nachylona w górę reprezentuje trend progresywnego wzrostu siły generowanej przez uczestnika (tj. progresywnego wzrostu niedoszacowań siły generowanej). Z kolei linia trendu nachylona w dół oznacza trend progresywnego spadku siły generowanej przez uczestnika.
Wyniki
Odczucie wykonanego wysiłku
Dokładność wygenerowanej siły
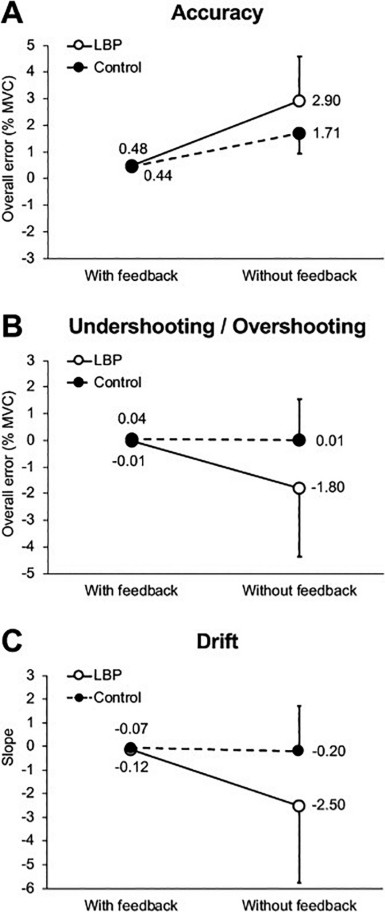
Nie było różnicy w obszarze błędu między grupą cLBP a grupą kontrolną, gdy dostępna było wizualna informacja o wartościach siły generowanej (p=0.38).
Natomiast usunięcie takiej informacji miało wpływ na zwiększenie obszaru błędu dla obu grup (p < 0,0001) i wzrost obszaru błędu był znacznie większy dla grupy cLBP w porównaniu z grupą kontrolną (p = 0,023).
Ryc. 2. (A) Dokładność: Brak informacji zwrotnej miało wpływ na zwiększenie obszaru błędu dla obu grup, przy czym wzrost obszaru błędu był znacznie większy dla grupy cLBP w porównaniu z grupą kontrolną. (B) Niedoszacowanie lub przewartościowanie generowanej siły: W przeciwieństwie do grupy kontrolnej, która nie wykazała żadnej różnicy po usunięciu informacji wizualnej, grupa cLBP znacznie przekroczyła minimalną wartość siły docelowej, co wskazuje, że przeszacowała swoją siłę generowaną w prostowanie tułowia. (C) Dryf: Bez informacji wizualnej, nachylenie linii trendu znacznie się zmniejszyło dla grupy LBP, podczas gdy pozostało w dużej mierze niezmienione dla grupy kontrolnej.
Niedoszacowanie lub przewartościowanie siły generowanej
Nie stwierdzono sytuacji użycia niedoszacowanej lub przeszacowanej wartości siły, gdy dostępne były wizualne informacje dotyczące wartości siły generowanej. Jej usunięcie miało natomiast odmienny efekt w grupie badanej i kontrolnej (p = 0,036), (Rys. 2B). W przypadku uczestników z grupy kontrolnej usunięcie informacji nie doprowadziło do konsekwentnego zaniżania lub przekraczania siły docelowej (p = 0,93). Natomiast uczestnicy z grupy badanej znacznie przekraczali minimalną wartość siły docelowej przy braku wizualnej informacji o generowanej sile w porównaniu do próby z taką informacji (p = 0,020). Oznacza to, że uczestnicy z cLBP przeszacowali wygenerowaną siłę prostowania tułowia podczas wykonywanego zadania.
Dryft danych
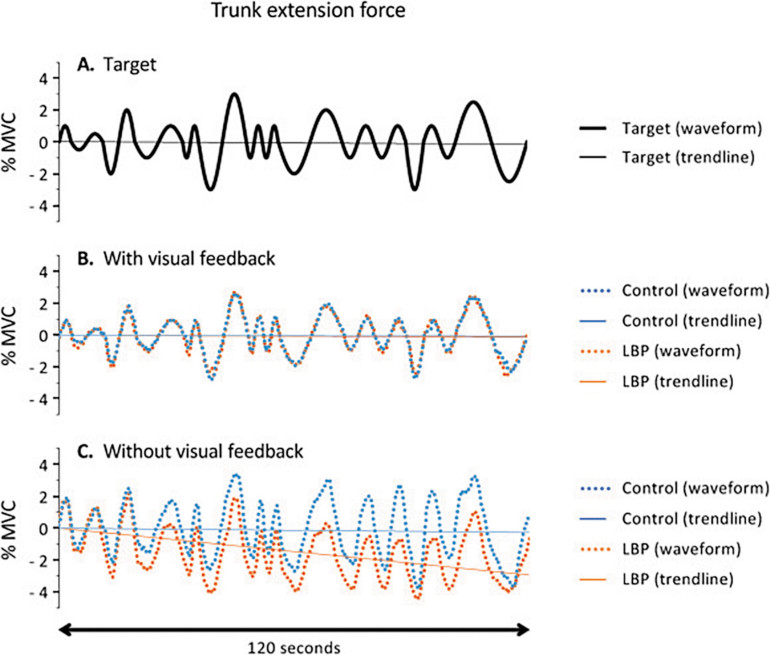
Rys. 3 ilustruje średnią siłę użytą do prostowania tułowia i linie trendu dopasowane do wykresów tej siły dla grupy badanej i grupy kontrolnej. Odpowiednie wartości nachylenia linii trendu przedstawiono na rys. 2C. W obecności informacji wizualnej linia trendu była prawie pozioma zarówno dla uczestników z grupy kontrolnej, jak i grupy badanej. Usunięcie informacji o generowanej sile miało odmienny efekt u zdrowych uczestników i osób z cLBP (p = 0,034). Podczas gdy nachylenie linii trendu pozostało w dużej mierze niezmienione po usunięciu informacji wizulanej w grupie kontrolnej (nachylenie: 0,00002; p = 0,80), to nachylenie linii trendu znacznie zmniejszyło się przy braku takiej informacji u osób z cLBP (nachylenie: 0,00025; p = 0,016). Oznacza to, że uczestnicy z cLBP przewartościowali swoją siłę prostowania tułowia z coraz większą ilością błędów ujawniających się w miarę postępu badania.
Ryc. 3. Średnie siły wyprostu tułowia dla grupy LBP i uczestników kontrolnych podczas badań z informacją o wartościach użytej siły (B) i bez takiej informacji (C). Dzięki przekazywaniu informacji o wartościach użytej siły, nachylenie linii trendu było poziome, a linie trendu obu grup nakładały się na siebie. Bez informacji o wartościach siły generowanej linia trendu dla uczestników kontrolnych pozostała pozioma, ale nachylenie linii trendu dla grupy LBP stało się ujemne, co wskazuje, że uczestnicy grupy LBP stopniowo przeszacowywali swoją siłę wkładaną w prostowanie tułowia. Wykres (A) pokazuje wartości siły docelowej.
4. Dyskusja
Wyniki tego badania potwierdzają hipotezę, że odczucie wykonanego wysiłku fizycznego jest zaburzone u osób z cLBP. Badania z wizualną informacją o generowanej sile podczas ćwiczeń fizycznych wykazały, że uczestnicy z cLBP i osoby zdrowe mogą wykonać ćwiczenie, z taką siłą jaka była zadana. Jednak po usunięciu takiej informacji uczestnicy z cLBP dopasowywali siłę mniej dokładnie (przeszacowali swoją siłę) w porównaniu do osób zdrowych. Rozbieżność między wartościami siły docelowej a generowanej rosła wraz z postępem wykonywania zadania.
Deficyty proprioceptywne w LBP związane są z zaburzonym przesyłaniem impulsów nerwowych z wrzecionek mięśni przykręgosłupowych lub ze zmianami w ich ośrodkowym przetwarzaniu (Brumagne i in., 2000; Parkhurst i Burnett, 1994). Chociaż uważa się, że kinestezja zależy od obwodowych sygnałów z receptorów skórnych i stawowych (Skoglund, 1973) oraz że wrzecionka mięśniowe odgrywają kluczową rolę w detekcji położenia i ruchu (Goodwin i in., 1972), to pomimo tego, wrzecionka mięśniowe mają kilka wad jako czujniki położenia. Najważniejsze jest to, że wrzecionka dostarczają niejednoznaczne informacje, gdyż wyładowania elektryczne zachodzące w neuronach mogą być modulowane przez skurcze włókien infrafuzalnych (budujących wrzecionka) lub rozciąganie mięśni (Proske, 2005). Jeśli wrzecionka mięśniowe nie są efektywnymi proprioreceptorami, obecna interpretacja deficytów proprioceptywnych w LBP może wymagać rewizji. Przekonujące dowody na to, że polecenia motoryczne wydawane przez mózg, a także wysiłek fizyczny przyczyniają się do odczucia położenia, zostały wcześniej ujawnione (Gandevia et al., 2006; Smith i in., 2009). Gandevia i in., (2006) wykazali, że u osób ze sparaliżowanym przedramieniem i dłonią (w wyniku niedokrwienia) postrzegany kąt nadgarstka zmienił się o ~20° podczas próby zgięcia lub wyprostu nadgarstka. Ponadto Smith et al., (2009) wykazali, że błędne postrzeganie położenia zależy od ciężkości wysiłku.
Jest prawdopodobne, że zaburzone poczucie wysiłku może, przynajmniej częściowo, wyjaśnić istnienie deficytów proprioceptywnych w LBP.
Większość dotychczas przeprowadzonych badań mających na celu ocenę odczucia położenia w LBP wykorzystywała wysiłek związany ze zmianami pozycji tułowia (Brumagne et al., 2000; Field i in., 1997; Gill i Callaghan, 1998; Koumantakis i in., 2002; Lam i in., 1999; Newcomer et al., 2000a; Newcomer et al., 2000b; O’Sullivan et al., 2003; Parkhurst i Burnett, 1994). Pomimo tego, że wyniki z tych badań interpretowane były przez pryzmat zaburzeń w przekazywaniu impulsów nerwowych z włókienek mięśniowych, to istnieje również możliwość, że uczestnicy badania dopasowywali siłę wkładaną w wykonanie określonego wysiłku do zrealizowania wartości docelowej. Ponieważ zadania obejmują ruch, trudno jest wywnioskować, czy obserwowane deficyty są wynikiem niepoprawnie przesłanych sygnałów z proprioreceptorów, ich zaburzonym przetwarzaniem w ośrodkowym układzie nerwowym, błędnym odczuciem wysiłku czy też ich kombinacją.
Aby zminimalizować udział proprioreceptorów, a dokładniej ocenić tylko odczucie wysiłku, w niniejszym badaniu zaprojektowano zadanie polegające na dopasowywaniu generowanej siły. Wyniki tego testu wykazały konsekwentne przekraczanie minimalnej wartość siły docelowej u uczestników z cLBP. Interpretacja tych wyników jest taka, że osoby z cLBP zauważyły, iż mięśnie pleców generują większą siłę niż jaka byłaby potrzebna (docelowa). Oznacza to przeszacowanie siły u osób z cLBP. Obserwacje autorów tego badania nie wykluczają jednoczesnego udziału wrzecionek mięśniowych w wyczuciu położenia. Wcześniejsze prace wykazały, że drgania kurczących się mięśni podczas zadania dopasowywania siły zwiększają błąd (Boucher i in., 2015), wykazując udział komponentu obwodowego w odczuciu generowanej siły lub położenia (Cafarelli i Kostka, 1981; McCloskey i in., 1974). Jest natomiast mało prawdopodobne, aby wyniki te można było wyjaśnić zaburzeniami w odczuciu bólu (Moseley i Hodges, 2005) lub zmianami w morfologii lub funkcji mięśni (Hodges i Danneels, 2019) w grupie cLBP, ponieważ nie było problemu w wykonywaniu zadania, gdy dostarczono informacje wizualne.
W kilku badaniach oceniano także odczucie napięcia mięśni w LBP (Flor i in. 1992, 1999) i wykazano, że osoby z LBP i bez LBP różnią się zdolnością rozróżniania poziomów napięcia mięśni (Flor i in., 1999). Ze względu na to, że pacjenci z LBP mieli trudności z oszacowaniem napięcia mięśni zarówno w obszarze dotkniętym chorobą, jak i w regionie niedotkniętym chorobą, argumentowano, że deficyt czuciowy może nie być spowodowany dysfunkcją lokalnych receptorów mięśniowych, ale może być związany z centralnym deficytem percepcyjnym (Flor i in., 1999).
Ograniczeniem obecnego badania jest to, że dopasowanie siły generowanej do siły docelowej mogło zależeć od zapamiętania związku pomiędzy odczuciem ciężkości wykonanego wysiłku a wymaganą siłą docelową w czasie prób testowych z informacją wizualną. Chociaż proces ten może być zaburzony w cLBP (Ling et al., 2007; Lourenco Jorge i in., 2009), oczekuje się, że doprowadzi to do błędu charakteryzującego się zarówno przekroczeniem, jak i niedostatecznym użyciem siły, a nie głównie tym ostatnim. Następnym celem badawczym będzie zatem badanie interakcji między ośrodkowo wywodzącym się odczuciem ciężkości wysiłku a informacjami proprioceptywnymi dostarczanymi z receptorów obwodowych (Proske, 2005) oraz określenie mechanizmów leżących u podstaw zaburzenia czucia głębokiego w LBP. Będzie to zależało od lepszego zrozumienia zachodzących w mózgu mechanizmów zaangażowanych w odczuwanie ciężkości wysiłku. Eksperymenty wykorzystujące przezczaszkową stymulację magnetyczną wykazały, że reakcji motorycznej wywołanej stymulacją kory ruchowej nie towarzyszy żadne odczucie wykonanego wysiłku (Ellaway i in., 2004; Gandevia i in., 1993). Zatem, przypuszcza się, że odczucie wykonanego wysiłku nie jest generowane w korze ruchowej i pochodzi z innych obszarów mózgów. Dalsze badania powinny dostarczyć informacji skąd wywodzi się to odczucie, jak przemienia się ono w ból i czy LBP może być leczony poprzez rehabilitację.
Źródło: Musculoskeletal Science and Practice, 2021, June, vol. 53, p. 102376
Copyright: ©2021 The Authors
Adaptacja: Dorota Kacprzak
Na podstawie licencji CCBY (http://creativecommons.org/licenses/by/4.0/)
- Boucher et al., 2015 J.A. Boucher, M.C. Normand, E. Boisseau, M. Descarreaux. Sensorimotor control during peripheral muscle vibration: an experimental study. J. Manip. Physiol. Ther., 38 (2015), pp. 35-43
- Brooks et al., 2013 J. Brooks, T.J. Allen, U. Proske. The senses of force and heaviness at the human elbow joint. Exp. Brain Res., 226 (2013), pp. 617-629
- Brumagne et al., 2000. S. Brumagne, P. Cordo, R. Lysens, S. Verschueren, S. Swinnen. The role of paraspinal muscle spindles in lumbosacral position sense in individuals with and without low back pain. Spine, 25 (2000), pp. 989-994
- Cafarelli and Kostka, 1981. E. Cafarelli, C.E. Kostka. Effect of vibration on static force sensation in man. Exp. Neurol., 74 (1981), pp. 331-340
- Carson et al., 2002. R.G. Carson, S. Riek, N. Shahbazpour. Central and peripheral mediation of human force sensation following eccentric or concentric contractions. J. Physiol., 539 (2002), pp. 913-925
- Carvalho et al., 2017. F.A. Carvalho, P.K. Morelhao, M.R. Franco, C.G. Maher, R. Smeets, C.B. Oliveira, I.F. Freitas Junior, R.Z. Pinto. Reliability and validity of two multidimensional self-reported physical activity questionnaires in people with chronic low back pain. Musculoskelet. Sci. Pract., 27 (2017), pp. 65-70
- Chiarotto et al., 2018. A. Chiarotto, M. Boers, R.A. Deyo, R. Buchbinder, T.P. Corbin, L.O.P. Costa, N.E. Foster, M. Grotle, B.W. Koes, F.M. Kovacs, C.C. Lin, C.G. Maher, A.M. Pearson, W.C. Peul, M.L. Schoene, D.C. Turk, M.W. van Tulder, C.B. Terwee, R.W. Ostelo. Core outcome measurement instruments for clinical trials in nonspecific low back pain. Pain, 159 (2018), pp. 481-495
- de Morree et al., 2012. H.M. de Morree, C. Klein, S.M. Marcora. Perception of effort reflects central motor command during movement execution. Psychophysiology, 49 (2012), pp. 1242-1253
- Ellaway et al., 2004. P.H. Ellaway, A. Prochazka, M. Chan, M.J. Gauthier. The sense of movement elicited by transcranial magnetic stimulation in humans is due to sensory feedback. J. Physiol., 556 (2004), pp. 651-660
- Field et al., 1997. E. Field, E. Abdel-Moty, J. Loudon. The effect of back injury and load on ability to replicate a novel posture. J. Back Musculoskelet. Rehabil., 8 (1997), pp. 199-207
- Flor et al., 1999. H. Flor, M. Furst, N. Birbaumer. Deficient discrimination of EMG levels and overestimation of perceived tension in chronic pain patients. Appl. Psychophysiol. Biofeedback, 24 (1999), pp. 55-66
- Flor et al., 1992. H. Flor, M.M. Schugens, N. Birbaumer. Discrimination of muscle tension in chronic pain patients and healthy controls. Biofeedback Self. Regul., 17 (1992), pp. 165-177
- Gandevia et al., 1993. S.C. Gandevia, K. Killian, D.K. McKenzie, M. Crawford, G.M. Allen, R.B. Gorman, J.P. Hales. Respiratory sensations, cardiovascular control, kinaesthesia and transcranial stimulation during paralysis in humans. J. Physiol., 470 (1993), pp. 85-107
- Gandevia et al., 2006. S.C. Gandevia, J.L. Smith, M. Crawford, U. Proske, J.L. Taylor. Motor commands contribute to human position sense. J. Physiol., 571 (2006), pp. 703-710
- Gill and Callaghan, 1998. K.P. Gill, M.J. Callaghan. The measurement of lumbar proprioception in individuals with and without low back pain. Spine, 23 (1998), pp. 371-377
- Goodwin et al., 1972. G.M. Goodwin, D.I. McCloskey, P.B.C. Matthews. The contribution of muscle afferents to kinaesthesia shown by vibration induced illusions of movement and by the effects of paralysing joint afferents. Brain, 95 (1972), pp. 705-748
- Hodges and Danneels, 2019. P.W. Hodges, L. Danneels. Changes in structure and function of the back muscles in low back pain: different time points, observations, and mechanisms. J. Orthop. Sports Phys. Ther., 49 (2019), pp. 464-476
- Jensen et al., 2003. M.P. Jensen, C. Chen, A.M. Brugger. Interpretation of visual analog scale ratings and change scores: a reanalysis of two clinical trials of postoperative pain. J. Pain, 4 (2003), pp. 407-414
- Jones et al., 2012. S.L. Jones, J.R. Hitt, M.J. DeSarno, S.M. Henry. Individuals with non-specific low back pain in an active episode demonstrate temporally altered torque responses and direction-specific enhanced muscle activity following unexpected balance perturbations. Exp. Brain Res., 221 (2012), pp. 413-426
- Koumantakis et al., 2002. G.A. Koumantakis, J. Winstanley, J.A. Oldham. Thoracolumbar proprioception in individuals with and without low back pain: intratester reliability, clinical applicability, and validity. J. Orthop. Sports Phys. Ther., 32 (2002), pp. 327-335
- Laird et al., 2014. R.A. Laird, J. Gilbert, P. Kent, J.L. Keating. Comparing lumbo-pelvic kinematics in people with and without back pain: a systematic review and meta-analysis. BMC Muscoskel. Disord. (2014), p. 229
- Lam et al., 1999. S.S. Lam, G. Jull, J. Treleaven. Lumbar spine kinesthesia in patients with low back pain. J. Orthop. Sports Phys. Ther., 29 (1999), pp. 294-299
- Ling et al., 2007. J. Ling, C. Campbell, T.M. Heffernan, C.G. Greenough. Short-term prospective memory deficits in chronic back pain patients. Psychosom. Med., 69 (2007), pp. 144-148
- Lourenco Jorge et al., 2009. L. Lourenco Jorge, C. Gerard, M. Revel. Evidences of memory dysfunction and maladaptive coping in chronic low back pain and rheumatoid arthritis patients: challenges for rehabilitation. Eur. J. Phys. Rehabil. Med., 45 (4) (2009), pp. 469-477
- Luu et al., 2011. B.L. Luu, B.L. Day, J.D. Cole, R.C. Fitzpatrick. The fusimotor and reafferent origin of the sense of force and weight. J. Physiol., 589 (2011), pp. 3135-3147
- Macefield and Knellwolf, 2018. V.G. Macefield, T.P. Knellwolf. Functional properties of human muscle spindles. J. Neurophysiol., 120 (2018), pp. 452-467
- McCloskey et al., 1974. D.I. McCloskey, P. Ebeling, G.M. Goodwin. Estimation of weights and tensions and apparent involvement of a "sense of effort". Exp. Neurol., 42 (1974), pp. 220-232
- Monjo et al., 2018. F. Monjo, J. Shemmell, N. Forestier. The sensory origin of the sense of effort is context-dependent. Exp. Brain Res., 236 (2018), pp. 1997-2008
- Moseley and Hodges, 2005. G.L. Moseley, P.W. Hodges. Are the changes in postural control associated with low back pain caused by pain interference? Clin. J. Pain, 21 (2005), pp. 323-329
- Newcomer et al., 2000a. K. Newcomer, E.R. Laskowski, B. Yu, D.R. Larson, K.N. An. Repositioning error in low back pain. Comparing trunk repositioning error in subjects with chronic low back pain and control subjects. Spine, 25 (2000), pp. 245-250
- Newcomer et al., 2000b. K.L. Newcomer, E.R. Laskowski, B. Yu, J.C. Johnson, K.N. An. Differences in repositioning error among patients with low back pain compared with control subjects. Spine, 25 (2000), pp. 2488-2493
- O’Sullivan et al., 2003. P.B. O’Sullivan, A. Burnett, A.N. Floyd, K. Gadsdon, J. Logiudice, D. Miller, H. Quirke. Lumbar repositioning deficit in a specific low back pain population. Spine, 28 (2003), pp. 1074-1079
- Parkhurst and Burnett, 1994. T.M. Parkhurst, C.N. Burnett. Injury and proprioception in the lower back. J. Orthop. Sports Phys. Ther., 19 (1994), pp. 282-295
- Pols et al., 1995. M.A. Pols, P.H. Peeters, H.B. Bueno-De- Mesquita, M.C. Ocke, C.A. Wentink, H.C. Kemper, H.J. Collette. Validity and repeatability of a modified Baecke questionnaire on physical activity. Int. J. Epidemiol., 24 (1995), pp. 381-388
- Pranata et al., 2017. A. Pranata, L. Perraton, D. El-Ansary, R. Clark, K. Fortin, T. Dettmann, R. Brandham, A. Bryant. Lumbar extensor muscle force control is associated with disability in people with chronic low back pain. Clin. Biomech., 46 (2017), pp. 46-51
- Proske, 2005. U. Proske. What is the role of muscle receptors in proprioception? Muscle Nerve, 31 (2005), pp. 780-787
- Proske and Allen, 2019.U. Proske, T. Allen. The neural basis of the senses of effort, force and heaviness. Exp. Brain Res., 237 (2019), pp. 589-599
- Proske and Gandevia, 2012. U. Proske, S.C. Gandevia. The proprioceptive senses: their roles in signaling body shape, body position and movement, and muscle force. Physiol. Rev., 92 (2012), pp. 1651-1697
- Proske et al., 2004. U. Proske, J.E. Gregory, D.L. Morgan, P. Percival, N.S. Weerakkody, B.J. Canny. Force matching errors following eccentric exercise. Hum. Mov. Sci., 23 (2004), pp. 365-378
- Skoglund, 1973. S. Skoglund. Joint receptors and kinaesthesis. A. Iggo (Ed.), Handbook of Sensory Physiology, Springer, Berlin (1973), pp. 111-136
- Smith et al., 2009. J.L. Smith, M. Crawford, U. Proske, J.L. Taylor, S.C. Gandevia. Signals of motor command bias joint position sense in the presence of feedback from proprioceptors. J. Appl. Physiol., 106 (2009), pp. 950-958
- Tong et al., 2017. M.H. Tong, S.J. Mousavi, H. Kiers, P. Ferreira, K. Refshauge, J. van Dieen. Is there a relationship between lumbar proprioception and low back pain? A systematic review with meta-analysis. Arch. Phys. Med. Rehabil., 98 (2017), pp. 120-136 e2
- van den Hoorn et al., 2012. W. van den Hoorn, S.M. Bruijn, O.G. Meijer, P.W. Hodges, J.H. van Dieen. Mechanical coupling between transverse plane pelvis and thorax rotations during gait is higher in people with low back pain. J. Biomech., 45 (2012), pp. 342-347
- Walsh et al., 2004. L.D. Walsh, C.W. Hesse, D.L. Morgan, U. Proske. Human forearm position sense after fatigue of elbow flexor muscles. J. Physiol., 558 (2004), pp. 705-715
- Weerakkody et al., 2003. N. Weerakkody, P. Percival, D.L. Morgan, J.E. Gregory, U. Proske. Matching different levels of isometric torque in elbow flexor muscles after eccentric exercise. Exp. Brain Res., 149 (2003), pp. 141-150