Wprowadzenie
Osłabienie funkcji motorycznych kończyn górnych występuje u 77% osób z udarem w fazie ostrej i u 55-75% osób z udarem w fazie przewlekłej i znacząco wpływa na jakość ich życia (Coscia i in., 2019, Lawrence i in., 2001). Odzyskanie ruchu ręki jest istotnym elementem zachowania niezależności w życiu codziennym i dlatego jest głównym celem programów rehabilitacyjnych.
Większość tradycyjnych strategii terapeutycznych wykorzystuje treningi polegające na aktywizacji kończyny górnej w celu przyspieszenia regeneracji określonych obszarów mózgu (Belda-Lois i in., 2011), np. terapia ruchowa wywołana ograniczeniami (constraint induced movement therapy - CIMT) (Wolf i in., 2008), trening z zastosowaniem ramienia robotycznego (Lo i in., 2010), obustronny trening ramion (Whitall i in., 2000) lub funkcjonalna elektrostymulacja (Makowski i in., 2014 ). W wielu badaniach opisano również zastosowanie różnego rodzaju technik wspierających neuroplastyczność mózgu po udarze w celu aktywizacji kończyn górnych, co jest szczególnie pomocne u osób, które przeszły udar z ciężkimi deficytami w zakresie funkcji motorycznych, poprzez np. stymulację mózgu (Dimyan i Cohen, 2010, Liew i in., 2014), trening obrazowania motorycznego (López i in., 2019) czy trening z zastosowaniem interfejsu mózg-komputer (brain-computer interface - BCI) (Daly i Wolpaw, 2008).
Wykazano również, że łączenie BMI/BCI z technikami neurorehabilitacyjnymi, tj. egzoszkielety kończyn górnych i dłoni lub elektryczną stymulacją mięśni, wpływają na znacznie lepszą poprawę funkcji motorycznych w porównaniu z grupami poddawanymi terapii pozorowanej lub grupami kontrolnymi (Ang i in., 2014, Biasiucci i in., 2018, Frolov i in., 2017, Pichiorri i in., 2015, Ramos-murguialday i in., 2013 ). Pomimo tych obiecujących odkryć, dowody na występowanie zmian w korze mózgowej po zastosowaniu terapii neurorehabilitacyjnej pozostają w dużej mierze niepotwierdzone, a neuronalny korelat lub biomarker, który może przewidzieć zakres regeneracji motorycznej, nadal pozostaje nieuchwytny.
Cel i uczestnicy badania
Przeprowadzono badanie kliniczne w celu oceny skuteczności egzoszkieletów wzmocnionych systemem BMI w regeneracji funkcji motorycznych kończyn górnych po udarze i zmianie aktywności elektrycznej mózgu.
Uczestnicy badania zostali zakwalifikowani do badania biorąc pod uwagę następujące kryteria: pacjenci z udarem w fazie podostrej lub przewlekłej (> 3 miesiące od wystąpienia udaru); stabilna funkcja ręki na początku badania; niedowład połowiczny kończyny górnej; brak przykurczu stawów lub ciężkiej spastyczności; brak podejścia pacjenta, które wykluczałoby udział w protokole treningowym; występowanie czucia głębokiego; brak w historii medycznej pacjenta procedury z użyciem środka neurolitycznego w ciągu ostatnich czterech miesięcy i brak przeciwwskazań do MRI.
Osoby z ograniczeniem ruchomości kończyny górnej, która miała bezpośredni wpływ na sprawność ruchową, a także pacjenci wykazujący brak motywacji z powodu nieleczonej depresji zostali wykluczeni z badania.
Aby ocenić początkową kontrolę motoryczną ręki, przeprowadzono ocenę za pomocą testu FMA-UE (Fugl-Meyer motor assessment scale for upper extremity - FMA-UE) podczas badań przesiewowych i powtórzono go miesiąc później. Uczestnik został uwzględniony w badaniu tylko wtedy, gdy różnica w wynikach FMA-UE podczas tych wizyt wynosiła ≤3 punkty (Klamroth-Marganska i in., 2014).
Grupa badana składała się z 10 pacjentów (4 pacjentów z uszkodzeniami kory mózgowej, 4 pacjentów z uszkodzeniami struktur podkorowych mózgu oraz 2 pacjentów z uszkodzeniami zarówno kory mózgowej, jak i struktur podkorowych).
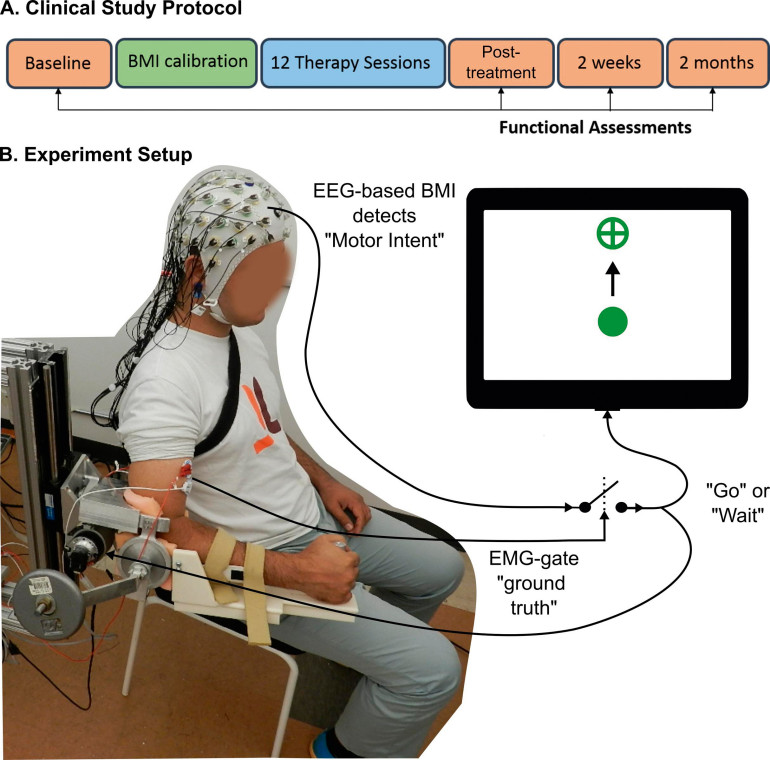
Protokół badania i projekt eksperymentu
Terapia rehabilitacyjna z wykorzystaniem egzoszkieletu wzmocnionego systemem BMI była wykonywana podczas 12 sesji, 3 razy w tygodniu, przez 4 tygodnie. Oceny funkcjonalne przeprowadzono dwukrotnie: na początku i na końcu terapii, a także po 2-tygodniowej i 2-miesięcznej obserwacji licząc od zakończenia badania.
Głównym celem klinicznym była poprawa funkcjonalna ruchów rąk i dłoni oceniana za pomocą testu FMA-UE, modulacja aktywności neuronalnej mierzona za pomocą EEG oraz poprawa jakości ruchu analizowana na podstawie kinematyki ruchu egzoszkieletu. Dodatkowo oceniano regenerację funkcji motorycznych przy użyciu testów klinicznych tj. test ARAT (Action Research Arm Test), test JTHFT (Jebsen-Taylor Hand Function Test) czy ocenę siły ścisku i chwytu. Ponadto zarejestrowano dane z elektromiografii powierzchniowej (EMG) mięśnia dwugłowego i trójgłowego ramienia zarówno niesprawnego, jak i sprawnego.
Podczas terapii uczestnicy mieli za zadanie poruszyć ręką z pozycji środkowej do jednego z dwóch wyświetlanych na ekranie komputera punktów w pozycji w górę lub w dół, tak aby prowokować ruchy zgięcia i wyprostu w stawie łokciowym. Niesprawna ręka była wspierana przez egzoszkielet MAHI Exo-II (Fitle i in., 2015). Po trafieniu w cel egzoszkielet automatycznie wracał do środka, a po okresie spoczynku (4-6 s) przedstawiono kolejną próbę. Aby wykonać ruch, uczestnicy zostali poinstruowani, aby "najpierw pomyśleć o ruchu, a następnie spróbować delikatnie poruszyć ramieniem". Każda próba trwała do 15 sekund, a uczestnicy mogli próbować poruszać ręką wiele razy w czasie 1 próby. Jeśli algorytm BMI z powodzeniem wykrył intencję wykonania ruchu, co zostało potwierdzone przez zmianę zapisu aktywności elektrycznej w mięśniach poprzez EMG, wówczas egzoszkielet został uruchomiony, aby pomóc w ruchu. W przeciwnym razie egzoszkielet pozostawał nieruchomy i opierał się ruchowi. Protokół ten zmusił uczestników do pozostania mentalnie zaangażowanymi w zadanie, aby zmaksymalizować korzyści płynące z terapii.
Wyniki
Efektywność działania BMI
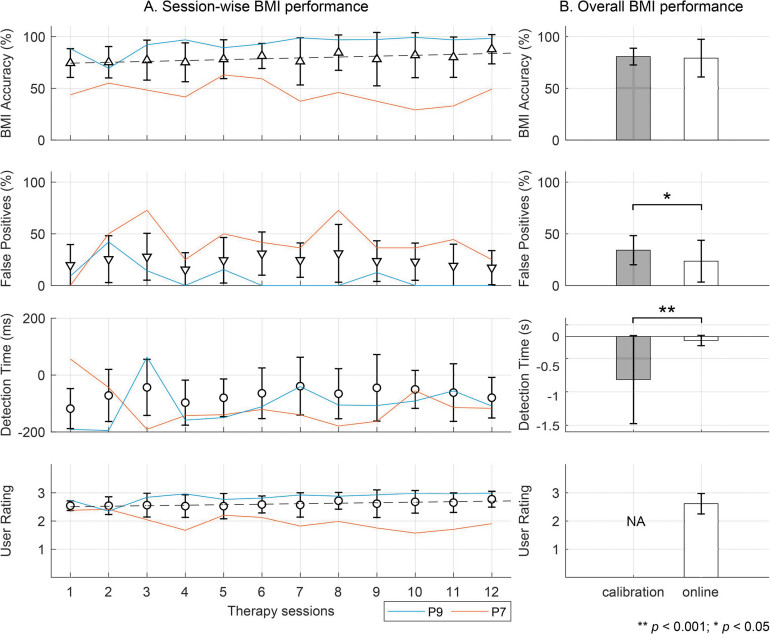
Podczas obserwacji trwającej 4-6 tygodni uczestnicy wykonywali średnio 132 ± 22 powtórzenia na sesję, uruchamiając ruch egzoszkieletu za pomocą BMI. Podczas ostatnich 5 sesji terapeutycznych, dokładność przewidywania ruchu za pomocą danych z EEG wynosiła więcej niż 90% u 4 pacjentów. Na wykresie znajdującym się na Ryc. 2A przedstawione są dane uczestników z najlepszą (P9) i najgorszą (P7) przewidywalnością ruchu podczas sesji. Pozostałe wykresy na tym rysunku pokazują zdolność BMI do unikania błędów (wykrywania ruchu, kiedy tak naprawdę nie został on wykonany), czas wczesnego wykrywania ruchu (określający z jakim wyprzedzeniem można przewidzieć ruch z samego EEG, zanim ręka faktycznie się poruszy) i oceny użytkowników (3 - pełna aprobata, 2 - nie jestem pewien, 1 - brak aprobaty).
Ryc.2B porównuje dokładność przewidywania ruchu wykonanego w trakcie sesji terapeutycznych z dokładnością podczas kalibracji algorytmu BMI wykonywanego na początku badania dla każdego pacjenta (odpowiednio, 79 ± 18% w porównaniu z 81 ± 8%, n.s.). Średnia liczba fałszywie dodatnich wyników podczas sesji terapeutycznych była znacznie mniejsza niż w trakcie kalibracji systemu (23 ± 20% w porównaniu z 34 ± 14%, p<0.05). Podczas kalibracji systemu zamiar motoryczny można było wykryć już 723 ± 740 ms przed rozpoczęciem wykonania ruchu, podczas gdy w przypadku terapii czas wykrycia zamiaru motorycznego to 66 ± 86 ms (p < 0,001). Wreszcie, średnia ocena pacjentów była wysoka i spójna dla wszystkich użytkowników i wynosiła 2,6 ± 0,4 punktu w 3-punktowej skali Likerta.
Funkcja motoryczna kończyny górnej
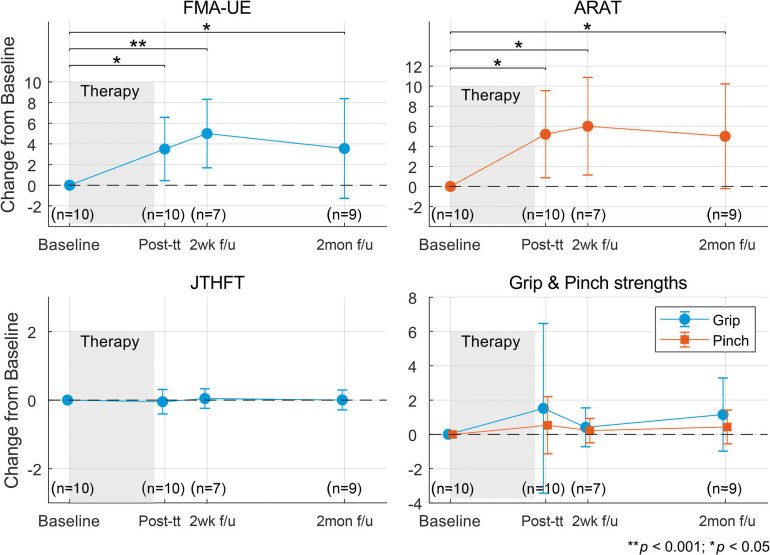
Rycina 3 pokazuje wartości parametrów klinicznych analizowanych przed i zaraz po przeprowadzeniu terapii rehabilitacyjnej, a także 2 tygodnie i 2 miesiące po zakończeniu badania. Analiza statystyczna wykazała, że wyniki FMA-UE i ARAT zaraz po leczeniu i w dalszych punktach czasowych były znacznie lepsze niż na początku badania. Ponadto, 8 uczestników osiągnęło tzw. minimalną różnicę istotną klinicznie (minimal clinically important difference - MCID) po terapii lub w trakcie dalszych obserwacji, w oparciu o wyniki FMA-UE i ARAT. Progi MCID dla FMA-UE ustalono na 5,2 punktu, a dla ARAT na 5,7 punktu w stosunku do wartości wyjściowej (Lee i in., 2001, Page i in., 2007). Nie zaobserwowano zmiany wartości parametru JTHFT. Odnotowano nieznaczną poprawę siły chwytu i szczypania, ale różnica między wynikiem osiągniętym po zakończeniu terapii w porównaniu do wartości wyjściowej nie była istotna statystycznie.
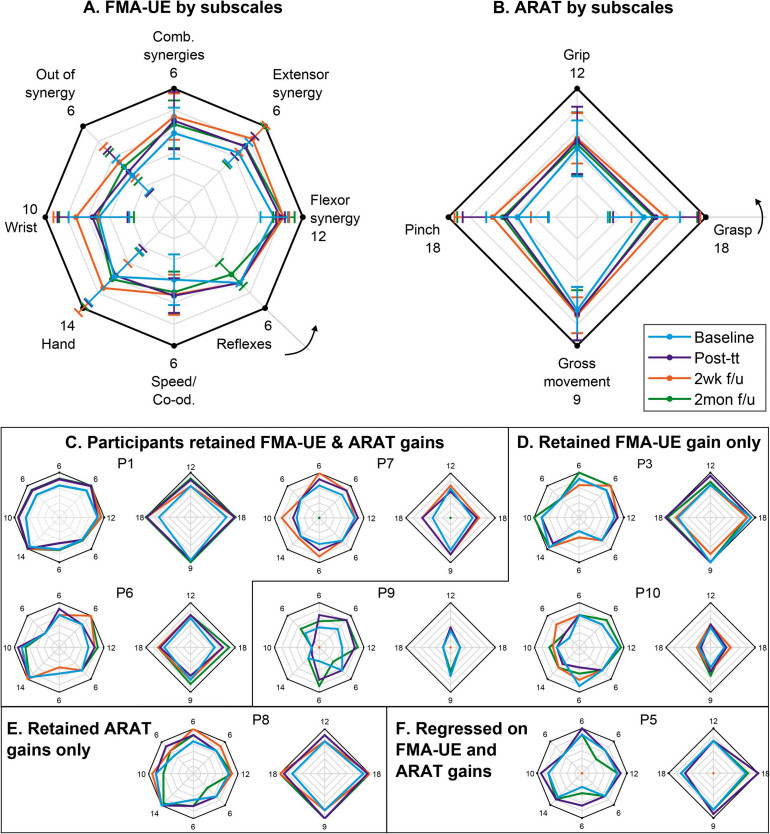
Na Ryc. 4 wyniki FMA-UE i ARAT zostały dodatkowo podzielone według określonych podskal. Dla każdego z wykresów pokazanych na Ryc. 4 czarny zewnętrzny wielokąt reprezentuje maksymalny wynik możliwy do osiągnięcia w każdej podskali. Maksymalny wynik w każdej pozycji punktacji jest również podawany obok każdego wierzchołka na wykresach A i B, a także na wszystkich pozostałych wykresach. Kolorowe wielokąty reprezentują 4 różne punkty czasowe badania, a mianowicie linię wyjściową, bezpośrednio po leczeniu, 2-tygodniową i 2-miesięczną obserwację po zakończeniu terapii.
Jak widać na wykresach 4A i 4B, pacjenci poprawili synergie ruchowe kończyn górnych, szybkość, koordynację, funkcje motoryczne nadgarstka i dłoni (według FMA-UE), a także siłę chwytu i szczypnięcia (według ARAT).
Poprawa była najbardziej zauważalna 2 tygodnie po zakończeniu badania, choć później cofnęła się. Wyniki osiągnięte po 2-miesięcznej obserwacji od zakończenia badania były podobne do wyników zaraz po leczeniu, choć lepsze niż wartość wyjściowa. Wykresy 4C-F śledzą natomiast postępy poszczególnych uczestników, którzy byli w stanie osiągnąć MCID w zakresie analizowanych parametrów. W szczególności, wykres 4C grupuje osoby, które uzyskały korzyści zarówno w wynikach FMA-UE, jak i ARAT po 2 miesiącach od zakończenia badania (z wyjątkiem P7). Wykres 4D grupuje osoby, które uzyskały korzyści według testu FMA-UE, ale albo nie poprawiły wyników w ARAT albo korzyści w ARAT cofnęły się. Podobnie, wykres 4E pokazuje uczestnika, który odniósł korzyści według ARAT, ale postęp cofnął się według FMA-UE. Wreszcie, wykres 4F pokazuje uczestnika, którego postępy cofnęły się zarówno w skali FMA-UE, jak i ARAT po 2 miesiącach od zakończenia badania. Ponieważ uczestnicy P2 i P4 nie osiągnęli MCID w żadnym momencie badania, ich wyniki nie zostały pokazane na Ryc. 4.
Kinematyka ruchu
Porównano wartości parametrów dotyczących jakości wykonywanego ruchu między początkiem i końcem sesji terapeutycznej i wykazano, że zarejestrowane zmiany wskazują na poprawę jakości wykonywanego ruchu (ruch był mniej gwałtowny) na końcu interwencji terapeutycznej w porównaniu do wartości wyjściowej.
Obecność synkinezy
Analiza aktywności elektrycznej mięśni wykazała, że mimowolna aktywacja sprawnej ręki podczas używania ręki z upośledzoną funkcją motoryczną (synkineza) istniała u 2 uczestników: P4 (wyjściowa FMA-UE = 21, ARAT = 4) i P8 (wyjściowa FMA-UE = 49, ARAT = 42). Synkinezę obserwowano głównie podczas prostowania ręki w stawie łokciowym. Ponadto, nie zaobserwowano zmian w stopniu zaawansowania synkinezy między początkiem i końcem leczenia.
Korelacja amplitudy i opóźnienia czasowego MRCP z wynikami klinicznymi
Aby określić zmiany ilościowe w aktywności neuronalnej, przeanalizowano wyniki uśrednionego, korowego potencjału wywołanego zdarzeniem ruchowym (movement related cortical potentials - MRCP) między początkiem i końcem interwencji terapeutycznej. MRCP obliczono w odniesieniu do czasu rozpoczęcia ruchu zidentyfikowanego na podstawie aktywności EMG ręki z upośledzoną funkcją motoryczną. Ponadto, przeanalizowano różnicę w amplitudach szczytowych MRCP i opóźnieniu z elektrod EEG zlokalizowanych nad korą ruchową.
Następnie skorelowano zmiany w wynikach FMA-UE i ARAT z różnicami w sygnałach MRCP otrzymanymi na początku i na końcu interwencji terapeutycznej. Jak zauważono, amplituda MRCP z kontrlateralnych elektrod EEG silnie korelowała z wynikami oceny funkcjonalnej. W szczególności zmiana średniej amplitudy MRCP dla centralnej elektrody kontrlateralnej (lokalizacja C1 or C2) istotnie korelowała z wynikami ARAT (ρ = 0,72, p < 0,05). Podobnie, zauważono korelację między amplitudą MRCP z centralnej i ciemieniowej elektrody kontrlateralnej i wynikami z FMA-UE, (ρ = 0,63, p = 0,051). Nie zaobserwowano istotnej korelacji między opóźnieniami czasowymi MRCP a poprawą kliniczną pacjentów.
Dyskusja
Zaangażowanie pacjentów poudarowych w proces leczenia rehabilitacyjnego ma zasadnicze znaczenie w promowaniu neuroplastyczności mózgu zależnej od aktywności fizycznej (Venkatakrishnan i in., 2014). Wiadomo również, że neurorehabilitacja oparta na BMI daje lepsze rezultaty kliniczne w tym zakresie niż jakiekolwiek inne współczesne terapie rehabilitacyjne (np. CIMT, stymulacja wspomagana robotem lub EMS itp.) (Cervera i in., 2018).
Wyniki z niniejszego badania potwierdziły, że rehabilitacja z użyciem robota wzmocnionego interfejsem mózg-maszyna przyczyniła się do poprawy funkcji motorycznych kończyn górnych u większości badanych pacjentów z udarem w fazie przewlekłej (7 uczestników z umiarkowanym lub łagodnym upośledzeniem funkcji motorycznych i u 1 pacjenta z ciężkim upośledzeniem funkcji motorycznych) porównując wyniki na początku i na końcu terapii. Zauważono przede wszystkim poprawę funkcji motorycznych nadgarstka i dłoni (według FMA-UE) oraz siły chwytu i szczypania (według ARAT). Dodatkowo, poprawa funkcji motorycznych kończyn górnych nadal była zauważalna po 2 tygodniach od zakończenia badania (co nigdy nie zostało zaobserwowane w innym badaniu klinicznym (Klamroth-Marganska et l.., 2014, Biasiucci el.al., 2018). Poprawa ta mogła wynikać ze zwiększonego użycia rąk w życiu codziennym. Co więcej, utrzymanie poprawy po 2 miesiącach (w porównaniu do wartości wyjściowej) od zakończenia badania wskazuje na długofalowe korzyści takiej formy leczenia. Nie zgłoszono żadnych zdarzeń niepożądanych bezpośrednio związanych z interwencją, chociaż jeden uczestnik (P5) doświadczył 2 miesiące po zakończeniu terapii niewyjaśnionego zmęczenia, zapominania i nadmiernego spadku sprawności ruchowej (Ryc. 4F).
Pomimo tego, że poprawa wartości parametrów klinicznych jest niepodważalnym dowodem poprawy funkcji motorycznej, często jest ona niezauważalna w korze ruchowej podczas jej obrazowania. Dlatego też, aby określić skuteczność jakiejkolwiek terapii neurorehabilitacyjnej, ważne jest, aby zidentyfikować neuronalne korelaty lub biomarkery poprawy funkcjonowania motorycznego, które mogą wyjaśnić, a nawet przewidzieć poprawę kliniczną po leczeniu. Rzeczywiście, wcześniejsze badania zidentyfikowały korelaty neuronalne oparte na odpowiedzi BOLD (Ramos-murguialday i in., 2013) wskaźniku anizotropii istoty białej (Song i in., 2015), wskaźniku asymetrii mózgu (Ang i in., 2014) oraz analizy widma mocy rytmów EEG (Bundy i in., 2017). Z kolei, analiza MRCP przeprowadzona w tym badaniu na początku i na końcu terapii wykazała, że amplituda MRCP z kontrlateralnych elektrod EEG silnie korelowała z poprawą funkcji motorycznych. Dokładniej mówiąc, amplitudy MRCP z pierwszorzędowej kory ruchowej i zakrętu zaśrodkowego (obszary Brodmanna 4 i 7) kontrlateralne do ręki z upośledzoną funkcją motoryczną skorelowane były z pozytywnymi wynikami ARAT (ρ = 0,72, p < 0,05) i FMA-UE (ρ = 0,63, p = 0,051) (Koessler i in., 2009). Nie zaobserwowano istotnej korelacji między opóźnieniami czasowymi MRCP a poprawą kliniczną pacjentów. Ponieważ uważa się, że amplituda MRCP koduje informacje o wykonanym wysiłku i uwadze (Cui i MacKinnon, 2009), wzrost amplitudy MRCP sugeruje wyższą aktywność półkuli ipsilateralnej (uszkodzonej) lub hamowanie aktywności półkuli kontrlateralnej. Jednak nadal nie jest jasne czy wyższa aktywność półkuli ipsilateralnej jest konsekwencją reorganizacji kory mózgowej lub zjawiska neuroplastyczności mózgu, zatem powinna zostać zbadana w przyszłych badaniach.
Co ciekawe, mimo że uczestnicy tego badania wykonywali niewielką liczbę ruchów ręką na sesję (132 ± 22), ich wyniki funkcjonalne i kinematyka ruchu były porównywalne z wynikami osiągalnymi w czasie terapii z wykorzystaniem robotów o wysokiej intensywności (Klamroth-Marganska i in., 2014, Lo i in., 2010). Prawdopodobnie ułatwiła to duża dokładność interfejsu mózg-maszyna (średnio = 79 ± 18%), niewielka ilość wyników fałszywie dodatnich (23 ± 20%) i wczesne wykrywanie ruchu (-66 ± 86 ms). To z kolei pozwoliło egzoszkieletowi płynnie reagować na intencjonalny zamiar ruchu uczestnika i zapewnić przyczynową, aferentną informację zwrotną, promując w ten sposób plastyczność korową. Ważne jest, aby pamiętać, że podczas gdy intencję ruchową można było przewidzieć przed rozpoczęciem ruchu fizycznego, wykrycie jej w trakcie terapii nastąpiło znacznie później (-66 ± 86 ms) niż wykrycie podczas kalibracji (-723 ± 740 ms). Ta różnica w opóźnieniach detekcji wynika bardziej z czułości klasyfikatora niż ze zmienności amplitudy MRCP. W scenariuszu kalibracji parametry klasyfikatora: próg prawdopodobieństwa przewidywania (τc) oraz liczba kolejnych wymaganych decyzji Go (Nc), zostały ustalone odpowiednio na 0,5 i 3. Natomiast podczas dostosowywania BMI w trakcie terapii parametry te były stopniowo zwiększane, aby poprawić specyfikę klasyfikatora. To nieumyślnie spowodowało, że klasyfikator potrzebował więcej czasu, aby zadeklarować decyzję Go, co spowodowało krótszy czas wczesnego wykrywania.
Zidentyfikowanymi ograniczeniami badania było: brak grupy kontrolnej, który uniemożliwił zrozumienie indywidualnych korzyści płynących z zastosowania BMI i terapii robotycznej. Upewniano się jednak, że włączeni pacjenci byli stabilni w momencie początkowym badania, a wszelkie ulepszenia można przypisać połączonemu efektowi BMI i terapii robotycznej. Wielkość grupy badanej była mała (n = 10), co uniemożliwiło uogólnienie wyników na większą próbę. Było to częściowo spowodowane wąskimi kryteriami włączenia, które wykluczyły około 75% uczestników zakwalifikowanych do badania. Kontrola BMI była jednowymiarowa (Go vs. No-go), co mogło nie być wystarczająco angażujące dla niektórych uczestników (np. P7). Dla przyszłych uczestników priorytetem powinno być zatem osiągnięcie wielowymiarowej kontroli BMI i połączenie jej z wirtualną lub rozszerzoną rzeczywistością, aby zapewnić motywujące środowisko do nauki.
Większość istniejących BMI wykorzystuje modulację mocy sygnału w paśmie mu lub beta, podczas gdy BMI przedstawione w tym badaniu wykorzystywało MRCP do wykrywania intencji ruchowych, co było dodatkowo potwierdzane przez aktywność EMG. Ponieważ te konfiguracje BMI występują w różnych pasmach częstotliwości (odpowiednio wyższe i niższe częstotliwości) i różnią się dziedziną, w której są obliczane (odpowiednio częstotliwość i domena czasu), nie jest możliwe ich bezpośrednie porównanie, ponieważ określają zupełnie inne cechy fizjologiczne. Wreszcie, uznawanie MRCP jako markera neurofizjologicznego dla poprawy klinicznej musi być traktowane z ostrożnością (u 3 uczestników (P5, P6 i P7) amplituda MRCP zmniejszyła się po terapii, podczas gdy ich wyniki ARAT wzrosły). Niemniej jednak niniejsze badanie znalazło przekonujące dowody na skuteczność kliniczną rehabilitacji poudarowej wspomaganej robotem z BMI.
Źródło: NeuroImage: Clinical, 2020, vol. 28, pp. 102502
Copyright: ©2021 The Authors
Adaptacja: Dorota Kacprzak
Na podstawie licencji CCBY (http://creativecommons.org/licenses/by/4.0/)
- Ang, K.K., Chua, K.S.G., Phua, K.S., Wang, C., Chin, Z.Y., Kuah, C.W.K., Low, W., Guan, C., 2014. A randomized controlled trial of EEG-based motor imagery brain-computer interface robotic rehabilitation for stroke. Clin. EEG Neurosci. 46 (4), 310-320. https://doi.org/10.1177/1550059414522229.
- Balasubramanian, S., Melendez-Calderon, A., Roby-Brami, A., Burdet, E., 2015. On the analysis of movement smoothness. J. NeuroEng. Rehabil. 12 (1), 112. https://doi. org/10.1186/s12984-015-0090-9.
- Bates, D., M¨achler, M., Bolker, B., Walker, S., 2015. Fitting Linear Mixed-Effects Models Using {lme4}. J. Stat. Softw. 67 (1), 1-48. https://doi.org/10.18637/jss.v067.i01.
- Belda-Lois, J.-M., Mena-del Horno, S., Bermejo-Bosch, I., Moreno, J.C., Pons, J.L., Farina, D., Iosa, M., Molinari, M., Tamburella, F., Ramos, A., Caria, A., Solis- Escalante, T., Brunner, C., Rea, M., 2011. Rehabilitation of gait after stroke: a review towards a top-down approach. J. NeuroEng. Rehabil. 8 (1), 66. https://doi.org/ 10.1186/1743-0003-8-66.
- Bhagat, N.A., Venkatakrishnan, A., Abibullaev, B., Artz, E.J., Yozbatiran, N., Blank, A.A., French, J., Karmonik, C., Grossman, R.G., O’Malley, M.K., Francisco, G., Contreras- Vidal, J.L., 2016. Design and optimization of an EEG-based brain machine interface (BMI) to an upper-limb exoskeleton for stroke survivors. Front. Neurosci. 10 (122) https://doi.org/10.3389/fnins.2016.00122.
- Biasiucci, A., Leeb, R., Iturrate, I., Perdikis, S., Al-Khodairy, A., Corbet, T., Schnider, A., Schmidlin, T., Zhang, H., Bassolino, M., Viceic, D., Vuadens, P., Guggisberg, A.G., Mill´an, J., d. R., 2018. Brain-actuated functional electrical stimulation elicits lasting arm motor recovery after stroke. Nat. Commun. 9 (1), 2421. https://doi.org/ 10.1038/s41467-018-04673-z.
- Bundy, David T., Souders, Lauren, Baranyai, Kelly, Leonard, Laura, Schalk, Gerwin, Coker, Robert, Moran, Daniel W., Huskey, Thy, Leuthardt, Eric C., 2017. Contralesional Brain-Computer Interface Control of a Powered Exoskeleton for Motor Recovery in Chronic Stroke Survivors. Stroke 48 (7), 1908-1915. https://doi.org/10.1161/STROKEAHA.116.016304.
- Cervera, María A., Soekadar, Surjo R., Ushiba, Junichi, Mill´an, Jos´e del R., Liu, Meigen, Birbaumer, Niels, Garipelli, Gangadhar, 2018. Brain-computer interfaces for post-stroke motor rehabilitation: a meta-analysis. Ann. Clin. Transl. Neurol. 5 (5), 651-663. https://doi.org/10.1002/acn3.544.
- Coscia, M., Wessel, M. J., Chaudary, U., Mill´an, J. del R., Micera, S., Guggisberg, A., Vuadens, P., Donoghue, J., Birbaumer, N., Hummel, F.C. (2019). Neurotechnology-aided interventions for upper limb motor rehabilitation in severe chronic stroke. Brain. https://doi.org/10.1093/brain/awz181.
- Cui, Rongqing, MacKinnon, Colum D., 2009. The effect of temporal accuracy constraints on movement-related potentials. Exp. Brain Res. 194 (3), 477-488. https://doi.org/10.1007/s00221-009-1725-5.
- Daly, Janis J., Wolpaw, Jonathan R., 2008. Brain-computer interfaces in neurological rehabilitation. Lancet Neurol. 7 (11), 1032-1043. https://doi.org/10.1016/S1474- 4422(08)70223-0.
- Dimyan, Michael A., Cohen, Leonardo G., 2010. Contribution of Transcranial Magnetic Stimulation to the Understanding of Functional Recovery Mechanisms After Stroke. Neurorehabil Neural Repair 24 (2), 125-135. https://doi.org/10.1177/1545968309345270.
- Fawcett, Tom, 2006. An introduction to ROC analysis. Pattern Recogn. Lett. 27 (8), 861-874. https://doi.org/10.1016/j.patrec.2005.10.010.
- Fitle, K.D., Pehlivan, A.U., O’Malley, M.K., 2015. A robotic exoskeleton for rehabilitation and assessment of the upper limb following incomplete spinal cord injury. IEEE International Conference on Robotics and Automation (ICRA) 2015, 4960-4966. https://doi.org/10.1109/ICRA.2015.7139888.
- Frolov, A.A., Mokienko, O., Lyukmanov, R., Biryukova, E., Kotov, S., Turbina, L., Nadareyshvily, G., Bushkova, Y., 2017. Post-stroke rehabilitation training with a motor-imagery-based brain-computer interface (BCI)-controlled hand exoskeleton: A randomized controlled multicenter trial. Front. Neurosci. 11 (JUL) https://doi.org/10.3389/fnins.2017.00400.
- Hwang, I.-S., Tung, L.-C., Yang, J.-F., Chen, Y.-C., Yeh, C.-Y., Wang, C.-H., 2005. Electromyographic Analyses of Global Synkinesis in the Paretic Upper Limb After Stroke. Phys. Ther. 85 (8), 755-765. https://doi.org/10.1093/ptj/85.8.755.
- Klamroth-Marganska, Verena, Blanco, Javier, Campen, Katrin, Curt, Armin, Dietz, Volker, Ettlin, Thierry, Felder, Morena, Fellinghauer, Bernd, Guidali, Marco, Kollmar, Anja, Luft, Andreas, Nef, Tobias, Schuster-Amft, Corina, Stahel, Werner, Riener, Robert, 2014. Three-dimensional, task-specific robot therapy of the arm after stroke: a multicentre, parallel-group randomised trial. Lancet Neurol. 13 (2), 159-166. https://doi.org/10.1016/S1474-4422(13)70305-3.
- Koessler, L., Maillard, L., Benhadid, A., Vignal, J.P., Felblinger, J., Vespignani, H., Braun, M., 2009. Automated cortical projection of EEG sensors: Anatomical correlation via the international 10-10 system. NeuroImage 46 (1), 64-72. https://doi.org/10.1016/j.neuroimage.2009.02.006.
- Lan, T., Erdogmus, D., Adami, A., Pavel, M., Mathan, S., 2005. Salient EEG Channel Selection in Brain Computer Interfaces by Mutual Information Maximization. In: 2005 IEEE Engineering in Medicine and Biology 27th Annual Conference, pp. 7064-7067. https://doi.org/10.1109/IEMBS.2005.1616133.
- Lawrence, E.S., Coshall, C., Dundas, R., Stewart, J., Rudd, A.G., Howard, R., Wolfe, C.D. A. (2001). Estimates of the prevalence of acute stroke impairments and disability in a multiethnic population. Stroke, 32(6), 1279-1284. https://doi.org/10.1161/01.STR.32.6.1279.
- Lee, J.H. Van Der, Groot, V. De, Beckerman, H., Wagenaar, R.C., Lankhorst, G.J., Bouter, L.M., Jh, A.V.D.L., V, D. G., & Beckerman, H., 2001. The Intra- and InterraterReliability of the Action Research Arm Test : A Practical Test of Upper Extremity Function in Patients With. Stroke 82 (January), 14-19. https://doi.org/10.1053/apmr.2001.18668.
- Liew, S.-L., Santarnecchi, E., Buch, E.R., Cohen, L.G., 2014. Non-invasive brain stimulation in neurorehabilitation: local and distant effects for motor recovery. Front. Hum. Neurosci. 8, 378. https://doi.org/10.3389/fnhum.2014.00378.
- Lo, Albert C., Guarino, Peter D., Richards, Lorie G., Haselkorn, Jodie K., Wittenberg, George F., Federman, Daniel G., Ringer, Robert J., Wagner, Todd H., Krebs, Hermano I., Volpe, Bruce T., Bever Jr., Christopher T., Bravata, Dawn M., Duncan, Pamela W., Corn, Barbara H., Maffucci, Alysia D., Nadeau, Stephen E., Conroy, Susan S., Powell, Janet M., Huang, Grant D., Peduzzi, Peter, 2010. Robot- Assisted Therapy for Long-Term Upper-Limb Impairment after Stroke. N. Engl. J. Med. 362 (19), 1772-1783. https://doi.org/10.1056/NEJMoa0911341.
- Lopez, Noelia Díaz, Monge Pereira, Esther, Centeno, Estefanía Jodra, Miangolarra Page, Juan Carlos, 2019. Motor imagery as a complementary technique for functional recovery after stroke: a systematic review. Topics in Stroke Rehabilitation 26 (8), 576-587. https://doi.org/10.1080/10749357.2019.1640000.
- Lotte, F., Congedo, M., L´ecuyer, A., Lamarche, F., Arnaldi, B., 2007. A review of classification algorithms for EEG-based brain-computer interfaces. J. Neural Eng. 4 (2), R1-R13. https://doi.org/10.1088/1741-2560/4/2/R01.
- Makowski, N.S., Knutson, J.S., Chae, J., Crago, P.E., 2014. Functional Electrical Stimulation to augment poststroke reach and hand opening in the presence of voluntary effort: a pilot study. Neurorehabilitation Neural Repair 28 (3), 241-249. https://doi.org/10.1016/j.biotechadv.2011.08.021.Secreted.
- Muller-Gethmann, Hiltraut, Rinkenauer, Gerhard, Stahl, Jutta, Ulrich, Rolf, 2000. Preparation of response force and movement direction: Onset effects on the lateralized readiness potential. Psychophysiology 37 (4), 507-514. https://doi.org/10.1111/1469-8986.3740507.
- Page, Stephen J., Levine, Peter, Leonard, Anthony, 2007. Mental Practice in Chronic Stroke: Results of a Randomized, Placebo-Controlled Trial. Stroke 38 (4), 1293-1297. https://doi.org/10.1161/01.STR.0000260205.67348.2b.
- Peng, H.C., Long, F.H., Ding, C., 2005. Feature selection based on mutual information: Criteria of Max-Dependency, Max-Relevance, and Min-Redundancy. IEEE Trans. on Pattern Analysis and Machine. Intelligence 27 (8), 1226-1238. https://doi.org/10.1109/TPAMI.2005.159.
- Pichiorri, Floriana, Morone, Giovanni, Petti, Manuela, Toppi, Jlenia, Pisotta, Iolanda, Molinari, Marco, Paolucci, Stefano, Inghilleri, Maurizio, Astolfi, Laura, Cincotti, Febo, Mattia, Donatella, 2015. Brain-computer interface boosts motor imagery practice during stroke recovery: BCI and Motor Imagery. Ann Neurol. 77 (5), 851-865. https://doi.org/10.1002/ana.24390.
- R Core Team. (2017). R: A Language and Environment for Statistical Computing.
- Ramos-murguialday, A., Broetz, D., Rea, M., Yilmaz, ¨O., Brasil, F.L., Liberati, G., Marco, R., Garcia-cossio, E., Vyziotis, A., Cho, W., Cohen, L.G., Birbaumer, N., 2013. Brain-Machine-Interface in Chronic Stroke Rehabilitation: A Controlled Study. Ann. Neurol. 74 (1), 100-108. https://doi.org/10.1002/ana.23879.Brain-Machine-Interface.
- Rathee, D., Chowdhury, A., Meena, Y.K., Dutta, A., McDonough, S., Prasad, G., 2019. Brain-Machine Interface-Driven Post-Stroke Upper-Limb Functional Recovery Correlates With Beta-Band Mediated Cortical Networks. IEEE Trans. Neural Syst. Rehabilitation Eng. 27 (5), 1020-1031. https://doi.org/10.1109/TNSRE.2019.2908125.
- Soekadar, S.R., Birbaumer, N., Slutzky, M.W., Cohen, L.G., 2015. Brain-machine interfaces in neurorehabilitation of stroke. Neurobiol. Disease 83, 172-179. https://doi.org/10.1016/j.nbd.2014.11.025.
- Song, J., Nair, V.A., Young, B.M., Walton, L.M., Nigogosyan, Z., Remsik, A., Tyler, M.E., Farrar-Edwards, D., Caldera, K.E., Sattin, J.A., Williams, J.C., Prabhakaran, V., 2015. DTI measures track and predict motor function outcomes in stroke rehabilitation utilizing BCI technology. Front. Hum. Neurosci. 9, p. 195).
- Stinear, C.M., 2017. Prediction of motor recovery after stroke: advances in biomarkers. Lancet Neurol. 16 (10), 826-836. https://doi.org/10.1016/S1474-4422(17)30283-1.
- Sullivan, J.L., Bhagat, N.A., Yozbatiran, N., Paranjape, R., Losey, C.G., Grossman, R.G., Contreras-Vidal, J.L., Francisco, G.E., O’Malley, M.K., 2017. Improving robotic stroke rehabilitation by incorporating neural intent detection: Preliminary results from a clinical trial. IEEE International Conference on Rehabilitation Robotics. https://doi.org/10.1109/ICORR.2017.8009233.
- Sullivan, K.J., Tilson, J.K., Cen, S.Y., Rose, D.K., Hershberg, J., Correa, A., Gallichio, J., McLeod, M., Moore, C., Wu, S.S., Duncan, P.W., 2011. Fugl-meyer assessment of sensorimotor function after stroke: Standardized training procedure for clinical practice and clinical trials. Stroke 42 (2), 427-432. https://doi.org/10.1161/STROKEAHA.110.592766.
- Tenan, M.S., Tweedell, A.J., Haynes, C.A., 2017. Analysis of statistical and standard algorithms for detecting muscle onset with surface electromyography. PLoS ONE 12 (5), 1-14. https://doi.org/10.1371/journal.pone.0177312.
- Venkatakrishnan, A., Francisco, G.E., Contreras-Vidal, J.L., 2014. Applications of Brain- Machine Interface Systems in Stroke Recovery and Rehabilitation. Curr. Phys. Med. Rehabilitation Rep. 2 (2), 93-105. https://doi.org/10.1007/s40141-014-0051-4.
- Wainwright, 2007. Advantages of Mixed Effects Models over Traditional ANOVA Models in Developmental Studies: A Worked Example in a Mouse Model of Fetal Alcohol Syndrome. Dev. Psychobiol. 49 (2), 165-171. https://doi.org/10.1002/dev.
- Whitall, J., McCombe Waller, S., Silver, K.H., Macko, R.F., 2000. Repetitive bilateral arm training with rhythmic auditory cueing improves motor function in chronic hemiparetic stroke. Stroke 31 (10), 2390-2395. https://doi.org/10.1161/01. str.31.10.2390.
- Wolf, S.L., Winstein, C.J., Miller, J.P., Thompson, P.A., Taub, E., Uswatte, G., Morris, D., Blanton, S., Nichols-Larsen, D., Clark, P.C., 2008. Retention of upper limb function instroke survivors who have received constraint-induced movement therapy: the EXCITE randomised trial. Lancet Neurol. 7 (1), 33-40. https://doi.org/10.1016/S1474-4422(07)70294-6.
- Woytowicz, E.J., Rietschel, J.C., Goodman, R.N., Conroy, S.S., Sorkin, J.D., Whitall, J., McCombe Waller, S., 2017. Determining Levels of Upper Extremity Movement Impairment by Applying a Cluster Analysis to the Fugl-Meyer Assessment of the Upper Extremity in Chronic Stroke. Arch. Phys. Med. Rehabil. 98 (3), 456-462. https://doi.org/10.1016/j.apmr.2016.06.023.
- Yilmaz, O., Birbaumer, N., Ramos-Murguialday, A., 2015. Movement related slow cortical potentials in severely paralyzed chronic stroke patients. Front. Hum. Neurosci. 8 (January), 1-8. https://doi.org/10.3389/fnhum.2014.01033.
- Yozbatiran, N., Der-Yeghiaian, L., Cramer, S.C., 2008. A standardized approach to performing the action research arm test. Neurorehabilitation Neural Repair 22 (1), 78-90. https://doi.org/10.1177/1545968307305353