1. Wstęp
Choroby układu mięśniowo-szkieletowego (MSD) definiuje się jako stany obejmujące szeroki zakres stanów zapalnych i zwyrodnieniowych, które niekorzystnie wpływają na ścięgna, mięśnie, więzadła i nerwy obwodowe w organizmie, powodując w konsekwencji ból i dyskomfort1. MSD są bardzo powszechnym i kosztownym globalnym problemem zdrowia publicznego i mają istotny wpływ na jakość życia jednostki. Wśród tych zaburzeń uporczywy ból w okolicy szyi, ramion i pleców, w tym mialgia, jest jednym z powszechnych objawów, szczególnie u kobiet2-4. W celu zmniejszenia tego globalnego problemu zdrowia publicznego niewątpliwie niezbędne jest stosowanie interwencji, które wykazują skuteczność w odniesieniu do określonych wyników. W ostatnim czasie terapeuci zwrócili większą uwagę na ocenę skuteczności różnych zachowawczych interwencji terapeutycznych w celu opanowania bólu. W tym kierunku zmierza elektroterapia (ET), która jest powszechnie stosowaną interwencją w łagodzeniu bólu mięśniowego poprzez stymulację mięśni i analgezję5. W ciągu ostatnich kilku dekad przeprowadzono liczne badania nad ET jako silną niefarmakologiczną alternatywą w leczeniu stanów bólowych, takich jak fibromialgia, w których występuje obwodowa nocycepcja i centralne przetwarzanie bólu6-8. W ET stymulacja o niskiej częstotliwości jest stosowana przede wszystkim do łagodzenia ostrych i przewlekłych poziomów bólu. Te nieinwazyjne urządzenia do neurostymulacji zostały wynalezione wkrótce po zaproponowaniu przez Melzacka i Walla teorii kontroli bramkowej bólu9. Stymulacja przezskórna o niskiej częstotliwości aktywuje włókna nerwowe o dużej średnicy i uwalnia pobudzające neuroprzekaźniki, które szybko docierają do mózgu. Natomiast inna gałąź odchodząca od włókna nerwowego o dużej średnicy aktywuje włókna międzyneuronalne, uwalniając neuroprzekaźniki hamujące. To z kolei zmniejsza aktywność komórek wtórnych przekaźników w ośrodkowym układzie nerwowym przenoszących sygnały bólowe, co powoduje zmniejszenie sygnałów bólowych, które były stale wprowadzane do mózgu9-11.
Postępująca wiedza i badania nad mechanizmem bólu spowodowały podjęcie prób opracowania bardziej efektywnych strategii leczenia bólu w warunkach domowych poprzez wprowadzenie innowacyjnych urządzeń do osobistej opieki medycznej. Osobiste urządzenie do stymulacji o niskiej częstotliwości (PLS) (CGM MBD-1201; CERAGEM Inc., Cheonan-si, Korea) może potencjalnie łagodzić bóle mięśniowe poprzez stymulację o niskiej częstotliwości (LFS) w miejscu bólu i może być łatwo obsługiwane w warunkach domowych. W celu leczenia, żelowa podkładka jest umieszczana na powierzchni skóry, aby zastosować impulsową stymulację elektryczną, a częstotliwość, intensywność i czas trwania stymulacji mogą być regulowane. Z drugiej strony, urządzenia do przezskórnej elektrycznej stymulacji nerwów (TENS) są zazwyczaj wykorzystywane w szpitalach w celu kontroli bólu.
Jednak do tej pory zarejestrowano bardzo mało dowodów na temat efektów łagodzenia bólu przez PLS w warunkach domowych. Ponadto nie ma badań, które porównywałyby efekty łagodzenia bólu mięśniowego przez PLS z konwencjonalną fizykoterapią (PT), która jest najczęściej stosowana u pacjentów z bólem mięśniowym w szpitalach i klinikach. W związku z tym w niniejszej pracy staraliśmy się zbadać efekty łagodzenia bólu przez PLS u pacjentów z mialgią i porównać je z efektami konwencjonalnej PT.
2. Opis badania
2.1. Uczestnicy
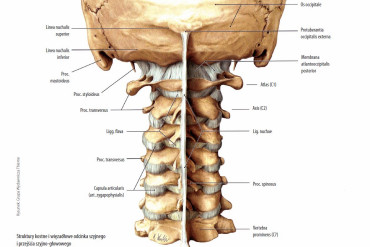
Trzydzieści dziewięć dorosłych kobiet w wieku od 18 do 70 lat zrekrutowano na oddziale medycyny rehabilitacyjnej, Presbyterian Medical Center, znajdującym się w Jeonju w Korei. Uczestniczki zgłosiły się do ośrodka z powodu skarg na przedłużający się ból mięśni. Doświadczeni klinicyści z wydziału medycyny rehabilitacyjnej Presbyterian Medical Center na podstawie badania mięśni i ogólnego badania fizykalnego oraz przedłużającego się bólu mięśni przez co najmniej 3 miesiące rozpoznali u uczestniczek mialgię. Doświadczały one bólu mięśni w co najmniej jednym lub więcej miejsc w obszarze szyi, ramion, pleców i talii. W tym badaniu wybrano pacjentki, które spełniły kryteria na podstawie testu przesiewowego i złożyły podpisany formularz świadomej zgody (ICF) po otrzymaniu szczegółowego wyjaśnienia na temat badania klinicznego. Wykluczono te pacjentki, które miały jakiekolwiek choroby narządów, takie jak choroby wątroby, nowotwory, choroby reumatyczne, choroby tarczycy, zaburzenia skóry lub nadwrażliwość. Wszystkie uczestniczki badania (n = 39) zostały losowo przydzielone do grupy PLS (PLSG: n = 20) lub grupy PT (PTG: n = 19).
2.2. Projekt eksperymentalny
Wszystkie interwencje stosowano przez 3 tygodnie, a po ich zakończeniu dokonano ponownego pomiaru wartości wyjściowych. W grupie PLSG interwencję prowadzono za pomocą urządzenia Youridm (CGM MBD-1201; CERAGEM Inc., Cheonan-si, Korea) w trybie niskiej częstotliwości przez 20 min na sesję i 5 sesji w tygodniu. W PTG stosowano konwencjonalny PT składający się z ultradźwięków (US) (SONICATOR 740, Mettler Electronics, CA, USA) przez 5 min i TENS (IN-1000A, YOUNG-IN biotech Co. Ltd., Seul, Korea) przez 15 min, w sumie przez 20 min na sesję i 5 sesji w tygodniu. W obu grupach dozwolone było stosowanie farmakoterapii (niesteroidowe leki przeciwzapalne i acetaminofen).
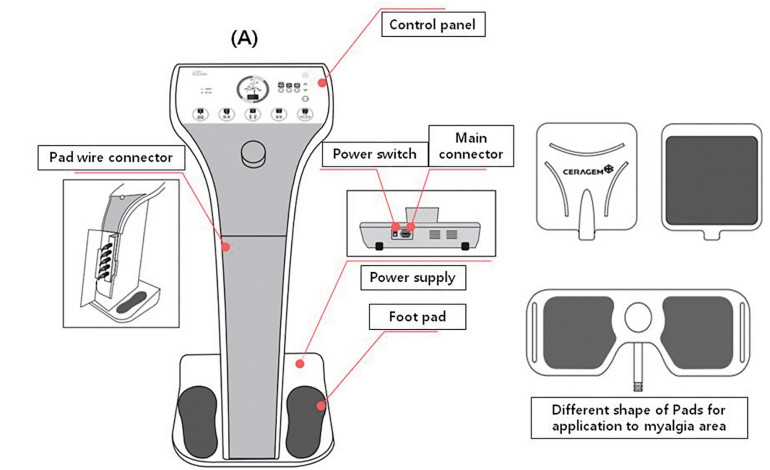
2.3. Urządzenie eksperymentalne (urządzenie PLS)
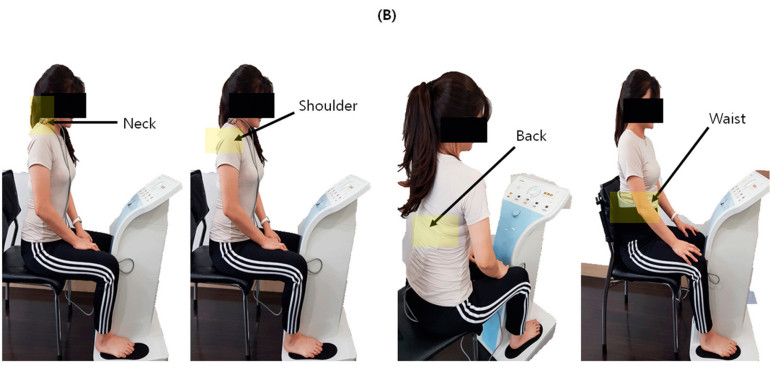
Urządzenie PLS jest osobistym stymulatorem kombinowanym (CGM MBD-1201, Youridm, CERAGEM Inc., Cheonan-si, Korea; Rycina 1) posiadającym funkcje stymulacji o niskiej częstotliwości (LFS), ultradźwięków i ogrzewania. W tym badaniu wykorzystaliśmy jednak tylko funkcję LFS urządzenia do oceny efektów łagodzenia bólu mięśniowego. W celu leczenia PLSG, uczestniczka siedziała na krześle ze stopami na każdej silikonowej podkładce pod stopy, na którą nałożono żel w celu zwiększenia przewodności elektrycznej, a także przymocowano drugą podkładkę na szyję, ramię, plecy i talię w miejscach, gdzie występował ból. Dla wszystkich uczestniczek wybierano tylko najbardziej bolesny obszar spośród szyi, ramion, pleców i talii, nawet jeśli miały ból w dwóch miejscach. Leczenie prowadzono w trybie LFS 3, który ustawiono z częstotliwością 20-70 Hz ± 10%, maksymalnym prądem wyjściowym 6,9 mA ± 20% i szerokością impulsu 630 μs ± 10%. Całkowity czas leczenia wynosił 20 min, a przerwa w przełączaniu częstotliwości 3 s. W leczeniu kontrolnym USG ustawiono na częstotliwość 1,5-1,8 MHz na 5 min, a TENS ustawiono na częstotliwość 2-80 Hz, szerokość impulsu 700 μs ±10% i czas przełączania częstotliwości 1 s na 15 min i zastosowano na szyję, ramię, plecy lub talię w miejscach, gdzie występował ból. Całkowity czas leczenia w grupie kontrolnej wynosił 20 min.
3. Wyniki
W sumie 39 uczestniczek zapisało się i wzięło udział w badaniu. Spośród nich 19 uczestniczek zostało randomizowanych do grupy interwencji PTG, a 20 uczestniczek zostało randomizowanych do grupy interwencji PLSG. Ogólną charakterystykę dwóch grup interwencyjnych przedstawiono w tabeli 1.
PLSG miało minimalny wpływ na szyję w porównaniu z PTG, przy czym wykazano, że zastosowanie PLSG zmniejsza aktywność mięśniową znacznie bardziej niż PTG, która również ma marginalny wpływ na dyskomfort mięśniowy szyi. PLSG był podobnie skuteczny jak PTG w łagodzeniu dyskomfortu barku. Najbardziej korzystne efekty PLSG zaobserwowano w mięśniach pleców. Zarówno PLSG, jak i PTG znacząco zmniejszyły sEMG mięśni pleców, co skutkowało poprawą kontroli bólu. Co więcej, PLSG wykazało większą redukcję sEMG, wskazując, że PLSG jest skuteczne w zmniejszaniu dyskomfortu mięśni pleców. Terapia kontroli bólu wydaje się być mniej skuteczna w okolicy pasa. sEMG (przewodnictwo nerwowo-mięśniowe) mięśnia pasa wzrosło po terapii PTG, wskazując na pogorszenie stanu. Przeciwnie, wynik ten nie był obserwowany w PLSG.
W celu zbadania wpływu PTG i PLSG na odczuwane natężenie bólu, do oceny bólu zgłaszanego przez badanych wykorzystano skalę VAS. Wartości VAS dla obu reżimów leczenia bólu zmniejszyły się, wskazując na złagodzenie bólu. Obie interwencje zmniejszyły poziom postrzeganego bólu, przy czym łagodzenie bólu było bardziej skuteczne w PLSG niż w PTG.
Aby sprawdzić bezpieczeństwo, wszystkim uczestnikom zadawano pytania o działania niepożądane za każdym razem po aplikacji urządzenia. Żaden z członków PLSG ani PTG nie skarżył się na ból lub dyskomfort w okresie interwencji.
4. Dyskusja
W ostatnich latach wiele badań sugerowało udział pola ET w licznych procesach biologicznych, które mają duże znaczenie dla interwencji terapeutycznych. Szczególnie pola niskiej częstotliwości są znane jako bezpieczna i skuteczna terapia i są sugerowane jako obiecujący adiuwant w leczeniu różnych zaburzeń mięśniowo-szkieletowych, w tym w leczeniu bólu19-21. W obecnym badaniu zastosowaliśmy terapię PLS do leczenia bólu mięśniowo-szkieletowego u starszych dorosłych. Dodatkowo porównaliśmy naszą interwencję z kombinacją US i TENS, które są powszechnie stosowanymi interwencjami do typowego łagodzenia bólu mięśniowego w PT, w oparciu o walidację jego efektu redukcji bólu przez wielu badaczy22,23.
Dodatkowo, nie odnotowano żadnych efektów ubocznych ani wycofania się z terapii podczas 3 tygodniowego okresu interwencji.
W związku z tym, nasze wyniki wykazały istotne różnice pomiędzy PLSG i PTG w odniesieniu do zmian w wartościach sEMG. sEMG, które zostało wykorzystane jako narzędzie do aktywacji mięśni w niniejszym badaniu, zostało wysoce skorelowane z bólem odczuwanym przez pacjentów w okolicy pleców i szyi24,25, podczas gdy wzorce zmian w sygnałach sEMG w mięśniach lędźwiowych w związku ze skurczami mięśni zostały również zgłoszone jako obiektywne dane oceny w przypadku występowania przewlekłej mialgii w okolicy pasa26. W tym badaniu stwierdzono, że wartości sEMG dla obszarów szyi, ramion i pleców były znacząco zmniejszone w PLSG w porównaniu z PTG. Natomiast w obszarze talii PLSG i PTG wykazywały podobne wartości sEMG. Wcześniej przeprowadzone badania donosiły, że wartości sEMG okazały się podwyższone w przewlekłym bólu pleców27, natomiast nasze wyniki wykazały, że PLSG znacząco obniża aktywność mięśniową i to w większym stopniu niż PTG, co wskazuje, że 3 tygodnie terapii PLS jest skuteczne w rozluźnianiu aktywności mięśniowej u pacjentów z problemami bólu pleców w większym stopniu niż PTG. Ponadto, w badaniu przeprowadzonym przez Naderhanda i współpracowników odnotowano, że pacjenci z niepełnosprawnością szyi mieli wyższe wyniki sEMG w zakresie aktywności mięśniowej28. Podobnie w naszych badaniach wykazano, że wartości sEMG były wyższe w obszarze szyi u pacjentów, natomiast przy leczeniu PLS punktacja zmniejszyła się u pacjentów bardziej niż w przypadku PTG. Ponadto subiektywna ocena bólu wykazała znaczący spadek między leczeniem przed i po obu terapiach. Nasze wyniki wykazały znaczące złagodzenie efektów bólowych pomiędzy pre- i post-testami na podstawie punktacji VAS w każdej grupie, ale nie było różnicy pomiędzy dwoma grupami. Jednakże PLSG wykazał wyższe efekty łagodzące niż PTG w oparciu o punktację SF-MPQ. Wyniki te sugerują, że PLS może być pomocny w łagodzeniu mialgii.
Chociaż nie ma bezpośredniego porównania efektów łagodzenia mialgii przez PLS ze względu na brak opublikowanych wyników badań, TENS stosowany w szpitalach wykazał pozytywny wpływ na ból przewlekły w różnych randomizowanych badaniach klinicznych i dlatego dyskusja opiera się na takich wynikach.
W jednym z badań sprawdzono zasadność stosowania TENS u 29 pacjentów z neuropatią obwodową29 i stwierdzono, że punktacja bólu zmniejszyła się po 6 tygodniach interwencji, informując, że taka interwencja może być przydatna dla pacjentów, którzy nie chcą dodatkowej terapii lekowej po chemioterapii. Aby sprawdzić wpływ TENS na pacjentów z rakiem trzustki15, dokonano porównania pomiędzy grupą kontrolną, która otrzymała środki przeciwbólowe jako interwencję, a grupą eksperymentalną, która otrzymała TENS bez środków przeciwbólowych. Wyniki wykazały natychmiastowe zmniejszenie bólu po interwencji w grupie kontrolnej, a następnie stopniową tendencję wzrostową po 1, 2 i 3 godzinach. Grupa eksperymentalna, pomimo niestosowania żadnych środków przeciwbólowych, wykazała wzór doskonałej kontroli bólu, a ponieważ taki efekt utrzymywał się przez 3 tygodnie po interwencji bez zwiększenia ilości stosowanych środków przeciwbólowych, interwencja została zaproponowana jako alternatywna metoda leczenia bólu u pacjentów z rakiem trzustki. Dodatkowo w jednym z badań porównano zmiany poziomu bólu u pacjentów z chorobą zwyrodnieniową stawu kolanowego w oparciu o pojedynczą interwencję, stosując grupy TENS o wysokiej częstotliwości, niskiej częstotliwości i sham. Wyniki wykazały, że próg bólu uciskowego w mięśniu piszczelowym przednim wzrósł w grupach TENS o niskiej i wysokiej częstotliwości14. W jednym z badań oceniono skuteczność urządzeń TENS u 28 pacjentów z fibromialgią30 i stwierdzono, że grupy, które otrzymały TENS, wykazały większy wpływ na wskaźniki związane z bólem, wydajnością pracy, zmęczeniem, sztywnością, lękiem i depresją niż grupa, która tego nie zrobiła. Ponadto, ostatnie badanie dotyczące wpływu TENS na ból pleców i ból neuropatyczny wykazało, że 15 sesji terapii TENS znacząco poprawiło wynik w skali VAS przed i po leczeniu i zostało uznane za skuteczną i bezpieczną metodę terapii w celu kontroli bólu31. Wyniki te są zgodne z naszym badaniem, co sugeruje, że osobiste urządzenie do elektrostymulacji o niskiej częstotliwości może być zalecane jako produkt domowej opieki zdrowotnej do łagodzenia stanów takich jak mialgia.
Niniejsze badanie ma pewne istotne ograniczenia. Po pierwsze, okres badania był ograniczony do 3 tygodni leczenia. Dlatego też potrzebne są przyszłe badania z wydłużonym okresem próby klinicznej, aby określić dokładny mechanizm i zbadać zmieniające się efekty w różnych punktach czasowych. Po drugie, badanie przeprowadzono w jednym ośrodku, a wielkość próby była niewielka. Po trzecie, dawki przyjmowanych leków nie mogły być rejestrowane w okresie badania. Dlatego konieczne są dalsze badania z większą liczbą prób z porównaniem leczenia w zależności od płci, aby zweryfikować korzyści z tego leczenia w dłuższym okresie.
5. Wnioski
W naszym badaniu stwierdziliśmy istotny wpływ leczenia PLS na wyniki sEMG i SF-MPQ w porównaniu z konwencjonalnym PT. W szczególności, nasze wyniki wykazały, że aktywność mięśniowa sEMG dla obszarów szyi, ramion i pleców była znacząco zmniejszona w PLSG. Ponadto, zarówno PTG jak i PLSG przyniosły znaczące zmniejszenie punktacji VAS po leczeniu. Dlatego niefarmakologiczne środki terapeutyczne, takie jak PLS, mogą być skuteczne w leczeniu mialgii. Jednak do pełnego stwierdzenia tych efektów potrzebne są bardziej szczegółowe badania z wykorzystaniem większych prób.
Żródło: International Journal of Environmental Research and Public Health, 2022, 19, 735
Copyright: © 2022 by the authors. Licensee MDPI, Basel, Switzerland.
Adaptacja: Wiesław Marciniak
Na podstawie licencji CC BY (http://creativecommons.org/licenses/by/4.0/)
- Punnett, L.; Wegman, D.H. Work-related musculoskeletal disorders: The epidemiologic evidence and the debate. J. Electromyogr. Kinesiol. 2004, 14, 13-23. [CrossRef] [PubMed]
- Forde, M.S.; Punnett, L.; Wegman, D.H. Pathomechanisms of work-related musculoskeletal disorders: Conceptual issues. Ergonomics 2002, 45, 619-630. [CrossRef] [PubMed]
- Sundelin, G. Effects on physical performance and pain from three dynamic training programs for women with work-related trapezius myalgia. J. Rehabil. Med. 2001, 33, 162-169.
- De Meulemeester, K.E.; Castelein, B.; Coppieters, I.; Barbe, T.; Cools, A.; Cagnie, B. Comparing trigger point dry needling and manual pressure technique for the management of myofascial neck/shoulder pain: A randomized clinical trial. J. Manip. Physiol. Ther. 2017, 40, 11-20. [CrossRef]
- Benlidayi, I.C. The effectiveness and safety of electrotherapy in the management of fibromyalgia. Rheumatol. Int. 2020, 40, 1571-1580. [CrossRef] [PubMed]
- Mutlu, B.; Paker, N.; Bugdayci, D.; Tekdos, D.; Kesiktas, N. Efficacy of supervised exercise combined with transcutaneous electrical nerve stimulation in women with fibromyalgia: A prospective controlled study. Rheumatol. Int. 2013, 33, 649-655. [CrossRef] [PubMed]
- Castillo-Saavedra, L.; Gebodh, N.; Bikson, M.; Diaz-Cruz, C.; Brandao, R.; Coutinho, L.; Fregni, F. Clinically effective treatment of fibromyalgia pain with high-definition transcranial direct current stimulation: Phase II open-label dose optimization. J. Pain 2016, 17, 14-26. [CrossRef]
- Dailey, D.L.; Rakel, B.A.; Vance, C.G.; Liebano, R.E.; Amrit, A.S.; Bush, H.M.; Sluka, K.A. Transcutaneous electrical nerve stimulation reduces pain, fatigue and hyperalgesia while restoring central inhibition in primary fibromyalgia. Pain 2013, 154, 2554-2562. [CrossRef]
- Melzack, R.;Wall, P.D. Pain mechanisms: A new theory. Science 1965, 150, 971-979. [CrossRef]
- Lisi, T.L.; Sluka, K.A. A new electrochemical HPLC method for analysis of enkephalins and endomorphins. J. Neurosci. Methods 2006, 150, 74-79. [CrossRef]
- Leonard, G.; Goffaux, P.; Marchand, S. Deciphering the role of endogenous opioids in high-frequency TENS using low and high doses of naloxone. Pain 2010, 151, 215-219. [CrossRef]
- Leemans, L.; Elma, Ö.; Nijs, J.; Wideman, T.H.; Siffain, C.; den Bandt, H.; Beckwée, D. Transcutaneous electrical nerve stimulation and heat to reduce pain in a chronic low back pain population: A randomized controlled clinical trial. Braz. J. Phys. Ther. 2021, 25, 86-96. [CrossRef]
- Király, M.; Gömöri, E.; Kiss, R.; Nógrádi, N.; Nusser, N.; Hodosi, K.; Bender, T. Effects of various types of ultrasound therapy in hip osteoarthritis-a double-blind, randomized, controlled, follow-up study. Physiother. Theory Pract. 2021, 1-11. [CrossRef] [PubMed]
- Vance, C.G.T.; Rakel, B.A.; Blodgett, N.P.; DeSantana, J.M.; Amendola, A.; Zimmerman, M.B.; Sluka, K.A. Effects of transcutaneous electrical nerve stimulation on pain, pain sensitivity, and function in people with knee osteoarthritis: A randomized controlled trial. Phys. Ther. 2012, 92, 898-910. [CrossRef] [PubMed]
- He, L.; Tan, K.; Lin, X.; Yi, H.;Wang, X.; Zhang, J.; Lin, L. Multicenter, randomized, double-blind, controlled trial of transcutaneous electrical nerve stimulation for pancreatic cancer related pain. Medicine 2021, 100, e23748. [CrossRef] [PubMed]
- Kim, T.H. The changes of range of motion of lumbar region and muscle activities of lumbar extensor during trunk motions between subjects with low back pain and healthy subjects. Phys. Ther. Korea 2006, 13, 61-69.
- Scott, J.; Huskisson, E.C. Vertical or horizontal visual analogue scales. Ann. Rheum. Dis. 1979, 38, 560. [CrossRef] [PubMed]
- Melzack, R. The short-form McGill pain questionnaire. Pain 1987, 30, 191-197. [CrossRef]
- Hu, H.; Yang, W.; Zeng, Q.; Chen, W.; Zhu, Y.; Liu, W.; Zhang, Y. Promising application of Pulsed Electromagnetic Fields (PEMFs) in musculoskeletal disorders. Biomed. Pharmacother. 2020, 131, 110767. [CrossRef]
- Wang, T.; Xie, W.; Ye, W.; He, C. Effects of electromagnetic fields on osteoarthritis. Biomed. Pharmacother. 2019, 118, 109282. [CrossRef]
- Assiotis, A.; Sachinis, N.P.; Chalidis, B.E. Pulsed electromagnetic fields for the treatment of tibial delayed unions and nonunions. A prospective clinical study and review of the literature. J. Orthop. Surg. Res. 2012, 7, 24.
- Sayilir, S. The short-term effects of TENS plus therapeutic ultrasound combinations in chronic neck pain. Complement. Ther. Clin. Pract. 2018, 31, 278-281. [CrossRef]
- Yilmaz, M.; Tarakci, D.; Tarakci, E. Comparison of high-intensity laser therapy and combination of ultrasound treatment and transcutaneous nerve stimulation on cervical pain associated with cervical disc herniation: A randomized trial. Complement. Ther. Med. 2020, 49, 102295. [CrossRef]
- Neblett, R. Surface electromyographic (SEMG) biofeedback for chronic low back pain. Healthcare 2016, 4, 27. [CrossRef]
- Fejer, R.; Hartvigsen, J. Neck pain and disability due to neck pain: What is the relation? Eur. Spine J. 2008, 17, 80-88. [CrossRef] [PubMed]
- Hoyt,W.H.; Hunt, H.H., Jr.; De Pauw, M.A.; Bard, D.; Shaffer, F.; Passias, J.N.;Watt, K.C. Electromyographic assessment of chronić low-back pain syndrome. J. Am. Osteopath. Assoc. 1981, 80, 728-730.
- Ambroz, C.; Scott, A.; Ambroz, A.; Talbott, E.O. Chronic low back pain assessment using surface electromyography. J. Occup. Environ. Med. 2000, 42, 660-669. [CrossRef] [PubMed]
- Nederhand, M.J.; IJzerman, M.J.; Hermens, H.J.; Baten, C.T.; Zilvold, G. Cervical muscle dysfunction in the chronic whiplash associated disorder grade II (WAD-II). Spine (Phila Pa 1976) 2000, 25, 1938-1943. [CrossRef]
- Gewandter, J.S.; Chaudari, J.; Ibegbu, C.; Kitt, R.; Serventi, J.; Burke, J.; Mohile, N.A. Wireless transcutaneous electrical nerve stimulation device for chemotherapy-induced peripheral neuropathy: An open-label feasibility study. Supportive Care Cancer 2019, 27, 1765-1774. [CrossRef]
- Carbonario, F.; Matsutani, L.A.; Yuan, S.L.; Marques, A.P. Effectiveness of high-frequency transcutaneous electrical nerve stimulation at tender points as adjuvant therapy for patients with fibromyalgia. Eur. J. Phys. Rehabil. Med. 2013, 49, 197-204. [PubMed]
- Yak¸si, E.; Ketenci, A.; Baslo, M.B.; Orhan, E.K. Does transcutaneous electrical nerve stimulation affect pain, neuropathic pain, and sympathetic skin responses in the treatment of chronic low back pain? A randomized, placebo-controlled study. Korean J. Pain. 2021, 34, 217-228. [PubMed]