Rak piersi - epidemiologia i metody leczenia
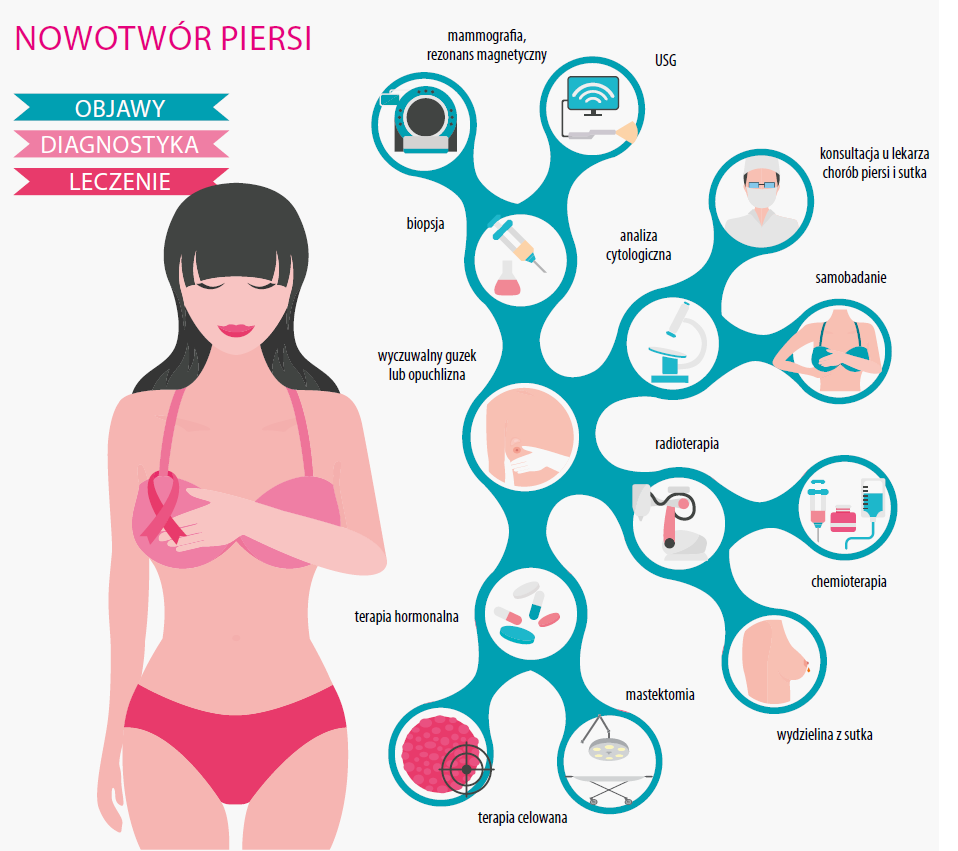
Nowotwór piersi jest najczęstszym nowotworem dotykającym kobiety – w Polsce odpowiada za 25% przypadków wśród pacjentek onkologicznych. W badaniu z 2013 r. podano, że w naszym kraju w 2010 r. odnotowano ponad 15 700 zachorowań i prognozowano wzrost w ciągu 15 lat do poziomu ponad 21 0001.
Do najważniejszych czynników ryzyka złośliwych nowotworów piersi należą wiek powyżej 65 lat (najwięcej zachorowań występuje w przedziale wiekowym 50–70 lat) oraz przebycie tej choroby przez krewną I stopnia. Profilaktyka pierwotna obejmuje modyfikację stylu życia, stosowanie tamoksifenu – u kobiet z podwyższonym ryzykiem dziedzicznym – oraz profilaktyczną adneksektomię (usunięcie przydatków – u nosicielek genu BRCA1) i mastektomię (u nosicielek mutacji BRCA1 lub BRCA2).
Profilaktyka wtórna to przede wszystkim badania przesiewowe, czyli głównie mammografia. Wykrycie nowotworu złośliwego w fazie przed przerzutami daje aż 90% szans na przeżycie, a w krajach, w których screening mammograficzny wprowadzono na skalę populacyjną, umieralność z powodu złośliwego nowotworu piersi spadła o 40%. Przeprowadzanie takich badań co 2–3 lata zaleca się u kobiet w wieku 50–69 lat2. Niestety w Polsce na wszelkie badania przesiewowe zgłasza się stosunkowo niewielki odsetek pacjentów, a sytuacja ta dodatkowo pogorszyła się podczas pandemii. W 2020 r. mammografii poddało się tylko 736 tys. kobiet, podczas gdy rok wcześniej było to niemal 1 042 tys.3
Metody leczenia nowotworów piersi dzielą się ogólnie na miejscowe i ogólnoustrojowe. Do pierwszych należy leczenie chirurgiczne oraz radioterapia przed- lub pooperacyjna.
Leczenie operacyjne jest najczęściej stosowaną metodą terapii. Może ono polegać na operacji oszczędzającej, podczas której usuwa się tylko guz z marginesem otaczającej tkanki, lub na pełnej mastektomii. Podczas operacji często usuwa się – w razie konieczności – również węzły chłonne z dołu pachowego po stronie chorej piersi.
Do metod ogólnoustrojowych leczenia raka piersi należą:
- terapia hormonalna (np. tamoksifen, toremifen) – blokująca receptory estrogenu; działa przy nowotworach zależnych od estrogenu i/lub progesteronu, a do takich należy większość, bo aż dwie trzecie wszystkich nowotworów sutka;
- chemioterapia (np. antracykliny, taksany) – stosowana po operacji w celu obniżenia ryzyka nawrotu, przed operacją w celu zmniejszenia rozmiaru guza lub jako leczenie główne u osób z przerzutami poza pierś i dół pachowy;
- leki celowane – ogólnie rzecz biorąc, hamują one rozrost komórek nowotworowych i działają mniej obciążająco na organizm niż chemioterapia, która niszczy również zdrowe komórki; leki celowane nie są jednak pozbawione poważnych efektów ubocznych; dobiera się je w zależności od genetycznych uwarunkowań danego typu nowotworu; przy mutacji HER2 (1 na 5 przypadków) zastosowanie znajdują przeciwciała monoklonalne, takie jak trastuzumab, pertuzumab, margetuksymab lub inhibitory kinazy, takie jak lapatynib czy neratynib; przy nowotworach hormonozależnych pomocne są inhibitory kinaz cyklinozależnych 4 i 6 (np. palbocyklib, rybocyklib), inhibitory kinazy mTOR (ewerolimus) lub inhibitory kinazy Pl3 (alpelisib); przy mutacjach BCRA stosuje się inhibitory PARP, takie jak olaparib czy talazoparib; natomiast u pacjentek z potrójnie ujemnym nowotworem piersi (czyli niezależnym od hormonów, bez mutacji HER2 ani BRCA) pomocny może być konjugat przeciwciała o nazwie sacituzumab govitecan, dopuszczony do stosowania przez amerykańską Agencję ds. Żywności i Leków w kwietniu br.;
- immunoterapia – ma na celu taką stymulację układu odpornościowego pacjentki, by zaczął on skuteczniej zwalczać nowotwór; lekiem o takim działaniu jest pembrolizumab, który hamuje aktywność białka PD-1; białko to znajduje się w limfocytach T i pomaga zapobiegać ich atakom na komórki własnego organizmu; poprzez zahamowanie jego działania nasila się reakcja immunologiczna, co często prowadzi do zmniejszenia wielkości guza4.
Rak piersi - rola fizjoterapii
Po leczeniu nowotworu piersi u pacjentek mogą występować następujące problemy:
- zmniejszona siła kończyny górnej,
- zmniejszona ruchomość barku,
- osłabienie mięśni barku,
- zmieniona kinematyka łopatki podczas ruchów kończyny górnej,
- sztywność z powodu blizn (na piersi i/lub w dole pachowym),
- ból kończyny górnej,
- obrzęk limfatyczny kończyny górnej,
- bóle neuropatyczne,
- bóle mięśniowo-szkieletowe (pierś, dół pachowy, kark/ bark),
- bóle przewlekłe.
Przy czym najpowszechniej występują ograniczenie zakresu ruchu kończyny górnej i obrzęk limfatyczny. Fizjoterapia może pomóc w zmniejszeniu nasilenia tych problemów. By to osiągnąć, plan terapeutyczny powinien obejmować:
a) ćwiczenia ruchowe poprawiające rozciągliwość tkanek i ułatwiające prawidłowe wzorce ruchowe,
b) techniki uwalniania mięśniowo-powięziowego w celu zwiększenia mobilności i rozciągliwości tkanek,
c) terapię manualną, w zależności od potrzeb pacjentki: mobilizację stawów, techniki uwalniania tkanek miękkich, techniki neurodynamiczne.
Najważniejsze grupy mięśni, jakie należy wziąć pod uwagę, to: pierścień rotatorów, mięsień zębaty przedni, mięsień czworoboczny grzbietu, mięśnie równoległoboczne, mięsień dwugłowy ramienia i mięśnie piersiowe5.
Kiedy rozpocząć rehabilitację pacjentki z rakiem piersi?
Kiedy rozpocząć ćwiczenia? Istotna jest tutaj kwestia, czy operacja polegała na samej mastektomii lub limfadenoktomii, czy też od razu przeprowadzono rekonstrukcję piersi. W pierwszym przypadku, nawet przy pełnej mastektomii, zaleca się wczesną mobilizację barku – większość lekarzy zezwala na rozpoczęcie takich ćwiczeń w pierwszym tygodniu po operacji. Inaczej wygląda sytuacja w przypadku operacji obejmującej rekonstrukcję piersi – tutaj konwencjonalna praktyka polega na unieruchomieniu tego stawu i kończyny górnej na miesiąc po operacji.
Takie ostrożne podejście bywa jednak kwestionowane. W roku 2019 południowokoreańscy naukowcy opublikowali badanie retrospektywne, w którym u pacjentek po pełnej mastektomii z jednoczasową rekonstrukcją piersi zastosowano tylko dwutygodniowe unieruchomienie, a następnie wdrożono program samodzielnie wykonywanych ćwiczeń. Wyniki porównano z grupą pacjentek objętą konwencjonalnym postępowaniem, z czterotygodniowym okresem immobilizacji. Okazało się, że grupa wczesnej rehabilitacji miesiąc oraz dwa miesiące po operacji miała większy zakres zginania i odwodzenia stawu barkowego niż grupa kontrolna. Co ważne, w żadnej z grup nie pojawiły się znaczące problemy związane z raną pooperacyjną6.
Ból barku po mastektomii - rehabilitacja
W 2019 r. przeprowadzono przegląd systematyczny badań na temat rehabilitacji przy bólu barku po mastektomii. Dokonuje on rozróżnienia między rodzajami bólu występującymi u takich pacjentek. Jednym z nich jest nocyceptywny ból mięśniowo-szkieletowy, powstający w wyniku aktywności nerwów obwodowych spowodowanej potencjalnie szkodliwymi bodźcami z tkanek. Według danych naukowych można go łagodzić za pomocą aktywnych ćwiczeń o stopniowo zwiększanej intensywności, technik mobilizacji stawów i tkanek oraz technik terapii manualnej dotyczących pomocniczej mobilizacji stawów oraz neurodynamiki. Po fazie podostrej zalecane są wybrane ćwiczenia wzmacniające i torowanie nerwowo-mięśniowe w celu przywrócenia właściwego rytmu łopatkowo-ramiennego.
Ból neuropatyczny wynika zaś z uszkodzenia obwodowej lub centralnej tkanki nerwowej, co prowadzi do przewlekłej stymulacji nerwów, a co za tym idzie – zmienionej odpowiedzi neuronów somatosensorycznych. Jest to ból piekący, napadowy. Często bywa wynikiem radioterapii, ale może wystąpić również po leczeniu hormonalnym inhibitorami aromatazy, przy czym utrzymuje się nawet po odstawieniu leku. W celu jego zmniejszenia zaleca się wykonywanie ćwiczeń aerobowych i wzmacniających dwa razy w tygodniu, w sumie przez 150 minut, pod nadzorem doświadczonego fizjoterapeuty. Jest to najskuteczniejsza znana strategia przy tym rodzaju bólu wywołanym przez radioterapię – oprócz łagodzenia bólu przynosi ona znaczącą poprawę jakości życia, zmniejszenie męczliwości i zwiększenie zakresu ruchu stawu barkowego.
Natomiast przy bólu neuropatycznym wywołanym lekami aktywne ćwiczenia przeprowadzane przez okres 12 miesięcy prowadziły do poprawy artralgii u pacjentek wcześniej nieaktywnych. Zaobserwowano również skuteczność neurotapingu stosowanego przez pięć tygodni, przejawiającą się w redukcji subiektywnego odczuwania bólu.
Ból przewlekły określa się jako występujący co najmniej od sześciu miesięcy i pociągający za sobą duże zmiany w osobowości i stylu życia pacjenta. Bywa wynikiem nieodpowiedniego postępowania z bólem w fazie pooperacyjnej. Autorzy przeglądu sugerują zastosowanie tutaj podejścia multidyscyplinarnego, obejmującego edukację na temat bólu, środki farmakologiczne, interwencje psychologiczne i fizjoterapeutyczne. Przy takim postępowaniu obserwuje się zmniejszenie niepełnosprawności i poprawę jakości życia pacjentek7.
Zakres ruchu stawu barkowego po mastektomii a rehabilitacja
Oprócz bólu ważnym aspektem, jaki poprawia fizjoterapia u pacjentek po mastektomii, jest zakres ruchu stawu barkowego. W roku 2019 opublikowano metaanalizę badań nad skutecznością wczesnej rehabilitacji po onkochirurgii piersi. Generalnie interwencje ćwiczeniowe wdrażano w tych badaniach już w pierwszym tygodniu po operacji. Protokoły interwencji składały się z aktywnych ćwiczeń kończyny górnej, rozciągania biernego i aktywnego, ćwiczeń na zakres ruchu stawu barkowego i ćwiczeń wzmacniających oraz masażu blizn. W trzech badaniach interwencje trwały od 10 do 19 dni, w czterech – od jednego do dwóch miesięcy, a w pięciu – od trzech do pięciu miesięcy.
Również umiarkowane dowody przemawiają za stosowaniem ćwiczeń na zakres ruchu połączonych ze wzmacnianiem mięśni w celu poprawy zginania stawu barkowego. Natomiast odnośnie do odwodzenia i zewnętrznej rotacji stawu barkowego stwierdzano ogólnie mniejszą poprawę bez względu na rodzaj stosowanej interwencji8.
W 2017 r. ukazało się hiszpańskie pilotażowe badanie kliniczne nad zastosowaniem technik pomocniczej mobilizacji stawu i neuromobilizacji u pacjentek po mastektomii. Technika pomocniczej mobilizacji stawu (accessory joint mobilization – AJM) polegała na stosowaniu trzech rodzajów ślizgu stawu ramienno-łopatkowego, opisanych przez Kalterborna: przedniego, tylnego i ogonowego. Technikę przeprowadzano w sposób rytmiczny – dwusekundowe ślizgi/dystrakcje przeplatane były dwusekundowymi przerwami. Każdą z technik przeprowadzano jednorazowo przez 2 minuty.
Druga grupa poddawana była technice neuromobilizacji (NM) składającej się ze ślizgu longitudinalnego tkanki nerwowej przy wykorzystaniu neurodynamicznej sekwencji testowej nerwu pośrodkowego ULNT1, opisanej przez Butlera. Staw barkowy leżących na plecach pacjentek poddawano odwodzeniu i rotacji zewnętrznej, łopatkę – obniżeniu, przedramię – supinacji, a nadgarstek i palce – wyprostowi. Mobilizację stosowano poprzez obniżenie łopatki, zgięcie stawu łokciowego i podniesienie łopatki, wyprost stawu łokciowego w ramach bezbolesnego zakresu ruchu. Jednorazowe zastosowanie trwało 2 minuty.
Niezależnie od podziału na grupy każda uczestniczka odbyła 9 półgodzinnych sesji fizjoterapii, począwszy od dnia wypisu ze szpitala (był to trzeci do szóstego dzień po operacji) przez okres trzech tygodni.
Wyniki tego badania były obiecujące: po sześciu miesiącach od zakończenia rehabilitacji zaobserwowano poprawę zakresu ruchu zginania średnio o 38,4º w grupie z pomocniczą mobilizacją stawu i o 36,8º w grupie z neuromobilizacją, natomiast zakres ruchu odwodzenia poprawił się aż o 52,4º (mediana) w grupie AJM i o 44º w grupie NM9.
Ryc. Po mastektomii należy zwrócić uwagę na ruchomość stawu barkowego.
Obrzęk limfatyczny - jak się go pozbyć?
Obrzęk ten to zaburzenie polegające na gromadzeniu się chłonki w przestrzeniach śródmiąższowych w wyniku osłabienia jej przepływu z powodu aplazji naczyń limfatycznych lub zmian morfologiczno-funkcjonalnych. Jest to problem powodujący niepełnosprawność, związany początkowo ze stanem zapalnym, który następnie przechodzi w twardnienie i włóknienie tkanek oraz powstawanie owrzodzeń na skórze.
W wyżej opisanym badaniu hiszpańskim wdrożono również wśród wszystkich uczestniczek protokół profilaktyki obrzęku limfatycznego. Polegał on na manualnym drenażu limfatycznym w obszarze tułowia, piersi, pachy i proksymalnej części kończyny górnej po stronie operowanej, z wykorzystaniem następujących technik: masaż blizn oraz torowanie nerwowo-mięśniowe wzdłuż skośnych osi ruchu przechodzące od ruchu pasywnego do wspomaganego ruchu aktywnego, a następnie do ruchu aktywnego oraz edukacji terapeutycznej. Postępowanie to okazało się skuteczne – u żadnej z uczestniczek nie wystąpił obrzęk limfatyczny. Co prawda trudno powiedzieć, czy skuteczność ta była trwała, gdyż ostatnią obserwację przeprowadzono sześć miesięcy po zakończeniu rehabilitacji, podczas gdy zdecydowana większość (ok. 88%) przypadków obrzęku limfatycznego po mastektomii diagnozowana jest w ciągu 2–3 lat po operacji.
Ważnym czynnikiem ryzyka jest tutaj usunięcie pachowych węzłów chłonnych – ogólne występowanie obrzęku limfatycznego po leczeniu nowotworu piersi szacuje się na 16,6%, podczas gdy wśród pacjentek po usunięciu pachowych węzłów chłonnych odsetek ten wynosi już 19,9%. Innym istotnym czynnikiem jest przeprowadzenie biopsji węzła wartowniczego, po której zapadalność na obrzęk limfatyczny może sięgać nawet poziomu 63,4% w ciągu 6–12 miesięcy od zabiegu10.
Badanie obserwacyjne z 2017 r. podaje, że obrzęk limfatyczny po usunięciu pachowych węzłów chłonnych występuje po dwóch latach od operacji u 13,5% pacjentek, po pięciu latach – u 30,2%, a po dziesięciu latach – u 41,1%.
Czynnikami zwiększającymi ryzyko obrzęku limfatycznego są:
- radioterapia obszaru pachowego,
- otyłość,
- seroma (wysięk płynu surowiczego),
- chemioterapia podawana do danej kończyny
- bardziej zaawansowane stadium choroby11.
Akademia Fizjoterapii Onkologicznej przy American Physical Therapy Association wydała w 2020 r. oparte na dowodach naukowych wytyczne kliniczne odnośnie do postępowania przy obrzęku limfatycznym po leczeniu nowotworów piersi. Poniżej przedstawiamy najważniejsze ustalenia tego dokumentu.
Przede wszystkim przed podjęciem interwencji terapeuta powinien zidentyfikować występujące u pacjentki deficyty, określić jej aktywność i ograniczenia mogące wpłynąć na uczestnictwo w leczeniu. Niezbędna jest współpraca fizjoterapeuty z pozostałymi specjalistami opiekującymi się pacjentką. Należy przeprowadzić przegląd układów, by sprawdzić występowanie efektów ubocznych leczenia onkologicznego i chirurgicznego oraz chorób współistniejących – mogą one wpływać na tolerancję ćwiczeń. Rola fizjoterapeuty jest bardzo ważna – to on monitoruje rozpoczęcie i postępy programu ćwiczeniowego.
Ważne, by interwencję rehabilitacyjną zaczynać wcześnie, choć decyzję o jej rozpoczęciu i o powrocie do aktywności należy podejmować razem z całym zespołem multidyscyplinarnym. Program ćwiczeń powinien być zindywidualizowany, ze stopniową progresją, przy monitorowaniu ewentualnych zdarzeń niepożądanych. Obserwuje się, że u osób po resekcji pachowych węzłów chłonnych sam dodatek manualnego drenażu limfatycznego do pooperacyjnego planu opieki może nie zmniejszać ryzyka wystąpienia obrzęku limfatycznego. U osób z wysokim ryzykiem takiego obrzęku zaleca się natomiast zastosowanie odzieży uciskowej – wraz z ćwiczeniami kończyn górnych i oddychaniem przeponą może ona zmniejszyć występowanie obrzęku.
Ważnym elementem postępowania jest nadzór prospektywny. Dzięki takiemu nadzorowi grup podwyższonego ryzyka możliwa jest wczesna identyfikacja obrzęku subklinicznego, co może poprawiać wyniki leczenia. Nadzór taki, przeprowadzany przy pomocy bioimpendacji spektroskopowej (BIS – bioelectrical impendance spectroscopy) lub wolumetrii, można rozpocząć od oceny przedoperacyjnej, a po operacji powtarzać co trzy miesiące przez pierwszy rok, następnie co dwa lata, łącznie przez okres 5 lat. W przypadku wykrycia obrzęku subklinicznego stosuje się edukację pacjentki, automasaż i odzież uciskową. Jeśli mimo to obrzęk nie ustąpi lub będzie postępował, można wdrożyć bardziej intensywne metody, takie jak kompleksowa terapia udrażniająca (CDT – complete decongestive therapy).
Ponadto u osób z podwyższonym ryzykiem obrzęku lub z obrzękiem subklinicznym można wdrożyć progresywny trening oporowy, ale pod nadzorem, w formie zindywidualizowanego programu i najwcześniej miesiąc po operacji. Należy takim pacjentkom zapewnić indywidualny program ćwiczeń aerobowych. Tolerancję ćwiczeniową i zdarzenia niepożądane należy monitorować początkowo co najmniej raz w tygodniu, a później z częstotliwością dostosowaną do objawów.
Jeśli już dojdzie do obrzęku, postępowanie zależy od stopnia jego zaawansowania. Przy obrzęku wczesnym (stadium I wg International Society of Lymphology – obrzęk o miękkiej konsystencji, częściowo zanikający przy wyższym ułożeniu kończyny) zaleca się jak najszybsze zastosowanie odzieży uciskowej, zalecenie pacjentce programu ćwiczeniowego i zapewnienie edukacji. Jeśli to postępowanie pierwszoliniowe nie będzie wystarczające, można zalecić kompleksową terapię udrażniającą. Środki kompresoterapeutyczne (odzież, bandażowanie) należy dostosować do stadium obrzęku i występujących zaburzeń, w porozumieniu z pacjentką.
Przy obrzęku umiarkowanym (stadium II wg ISL – obrzęk z wtórnymi zmianami tkankowymi, który nie zmniejsza się przy wyższym ułożeniu kończyny) lub zaawansowanym (stadium III wg ISL – twardy obrzęk słoniowaty ze zmianami skórnymi i zwłóknieniami) zalecana jest kompleksowa terapia udrażniająca w celu zmniejszenia objętości kończyny. Kluczowymi elementami tej terapii są kompresoterapia i ćwiczenia. Pominięcie manualnego drenażu limfatycznego czy skrócenie stosowania tej metody nie powinno wpłynąć na długoterminowe wyniki postępowania (brak jest dowodów na skuteczność manualnego drenażu limfatycznego w zmniejszaniu obrzęku). Na wszystkich etapach leczenia kompresoterapia powinna być dostosowana do stadium obrzęku, występujących zaburzeń i preferencji pacjentki. Możliwe jest zastosowanie kinezjotapingu, który zmniejsza obrzęk, natomiast nie zastępuje bandażowania uciskowego w stadium II ani III. Ponadto przy tej metodzie należy bacznie monitorować pacjentkę pod kątem zdarzeń niepożądanych.
Po uzyskaniu stabilnego zmniejszenia objętości kończyny należy pacjentce zalecić program postępowania w domu, obejmujący: ćwiczenia, samodzielny manualny drenaż limfatyczny, indywidualnie dopasowaną odzież uciskową oraz, jeśli są ku temu wskazania, odpowiednią kompresoterapię na noc. W tej fazie można rozważyć również zastosowanie urządzenia do przerywanej kompresji pneumatycznej. Zmiany objętości obrzęku należy monitorować na wizytach kontrolnych. W przypadku utrwalonego obrzęku kończyny górnej można rozważyć zastosowanie laseroterapii niskoenergetycznej (LLLT – low level laser therapy) w połączeniu z kompresoterapią lub CDT.
Zaleca się zapewnianie pacjentkom z obrzękiem limfatycznym każdego stadium programu ćwiczeń aerobowych i oporowych, przy czym te ostatnie należy zaczynać przy niskiej intensywności i przeprowadzać stopniową progresję. Oba te typy ćwiczeń poprawiają kondycję fizyczną i jakość życia, zwiększają masę mięśniową i mineralną gęstość kości. Programy ćwiczeń powinny być początkowo przeprowadzane pod nadzorem, zawsze zindywidualizowane i o stopniowej progresji. W przypadku pacjentek z chorobami współistniejącymi lub powikłaniami program ćwiczeń powinien zlecić specjalista po badaniu.
W celu zmniejszenia obrzęku należy stosować ćwiczenia sekwencyjne od proksymalnych do dystalnych, obejmujące oddychanie przeponą. Korzystne może być stosowanie kompresoterapii podczas ćwiczeń. Choć joga jest bezpieczną formą ćwiczeń, brakuje dowodów na jej skuteczność w zmniejszaniu obrzęku.
Dodatkowo u osób z ryzykiem obrzęku limfatycznego można stosować, oprócz rozciągania, ćwiczeń i masażu blizn, terapię mięśniowo-powięziową, z tym że nie wcześniej niż trzy miesiące po radioterapii12.
Ryc. Bandażowanie kończyny górnej przy obrzęku limfatycznym.
Przerywana kompresja pneumatyczna a obrzęk limfatyczny
Według przeglądu badań z 2012 r. zastosowanie urządzeń do przerywanej kompresji pneumatycznej (IPC – intermittent pneumatic compression) ma bardzo dobre umocowanie w literaturze przedmiotu. Istnieją dowody naukowe na zachodzenie zmian fizjologicznych przy zastosowaniu tych urządzeń u pacjentów z obrzękiem limfatycznym. Powodują one zmiany w ciśnieniu międzynaczyniowym oraz wchłanianie płynu przez układ limfatyczny. Dzięki temu obrzęk się zmniejsza. Temu transportowi płynu do tkanek nie towarzyszy transport makrocząsteczek (np. białek), co sugeruje, że sama terapia IPC może być za mało skuteczna. Do pełnego i trwałego udrożnienia niezbędne jest więc podejście multimodalne. Dane naukowe sugerują stosowanie ciśnienia ucisku w zakresie od 30 do 60 mmHg.
Większą ostrożność należy zachować przy leczeniu pacjentów ze stadium III obrzęku, czyli ze zwłóknieniami – należy pamiętać, by nie doprowadzić do uszkodzeń z powodu niedokrwienia. W badaniach nie zaobserwowano poważnych efektów ubocznych tej metody (najczęściej zgłaszano dyskomfort – przy ciśnieniu 60 mmHg, czasem podrażnienie skóry)21.
Laseroterapia niskoenergetyczna (fotobiomodulacja) a obrzęk limfatyczny
W 2017 r. opublikowano przegląd badań nad zastosowaniem niskoenergetycznej laseroterapii (LLLT – low lever laser therapy) przy obrzęku limfatycznym po leczeniu nowotworu piersi. Stwierdzono w nim, że istnieją silne dowody na krótkoterminową skuteczność LLLT w zmniejszaniu obwodu/objętości kończyny oraz umiarkowane dowody na krótkoterminową skuteczność tej metody w łagodzeniu bólu.
Autorzy stwierdzili, że można uważać ten rodzaj terapii za skuteczny u pacjentek z obrzękiem po mastektomii oraz że konieczne są dalsze badania w celu określenia optymalnych parametrów, jakie mają być stosowane22.
Elektrostymulacja a obrzęk limfatyczny
Nowym, a więc niedostatecznie przebadanym, natomiast już z powodzeniem stosowanym sposobem leczenia obrzęku limfatycznego jest elektrostymulacja. W przeglądzie badań z 2020 r. czytamy, że istnieją dowody na skuteczność tej metody odnośnie do stanu zapalnego, angiogenezy i gojenia się ran, choć częściowo pochodzą one ze wstępnych badań eksperymentalnych.
Elektrostymulacja stymuluje wydzielanie trofin korzystnych przy angiogenezie i powstawanie naczyń limfatycznych. Metoda ta sprzyja napływowi jonów wapnia i indukuje ścieżkę tlenku azotu, a mechanizmy te sprzyjają utrzymywaniu drożności dróg limfatycznych. Elektrostymulacja sprzyja lepszemu gojeniu się ran i zmniejszaniu zwłóknień, między innymi poprzez promowanie transdyferencjacji fibroblastów w miofibroblasty, które wiążą się z bardziej odwracalną postacią włóknienia. Mogłoby to poprawiać gojenie się ran, zmniejszać objętość obrzęku oraz jego twardość nawet w zaawansowanych stadiach23.
Profilaktyka i leczenie blizn po mastektomii
Po mastektomii czy limfadenoktomii zostają blizny. Aby zmniejszyć ich widoczność i poprawić gojenie się ran, stosowane są różne metody. Jedną z nich jest masaż blizn. Przegląd badań z 2011 r. stwierdza, że protokoły masażu blizn opisywane w literaturze są bardzo różne, a więc trudno porównywalne – np. czas masażu waha się od 10 minut dwa razy dziennie do 30 minut dwa razy w tygodniu, a czas trwania terapii od jednorazowego masażu do 6 miesięcy. Ogólnie rzecz biorąc, dowody na skuteczność tej metody są słabej jakości, choć wydaje się ona pomagać pacjentom po operacjach bardziej niż po urazach czy poparzeniach13.
Działanie przeciwbliznowe ma również wymieniona już wyżej kompresoterapia. Francuscy i belgijscy specjaliści w swoich zaleceniach z 2014 r. piszą, że odzież uciskowa powinna być rozważona jako środek profilaktyczny przy ranach, które goją się dłużej niż 14 dni. Zastosowanie kompresoterapii możliwe jest dopiero po zamknięciu się rany i pod warunkiem, że pacjent jest w stanie tolerować nacisk. Badania kliniczne cytowane przez autorów potwierdzają korzyści płynące z zastosowania odzieży uciskowej. Natomiast jest to dosyć kosztowna forma terapii, ponieważ odzież taka jest zwykle szyta na miarę. Poza tym może ona powodować dyskomfort, przez co wielu pacjentów nie nosi jej tak długo, jak należy14.
W zapobieganiu i leczeniu blizn przerostowych i keloidowych stosowany jest cały szereg preparatów miejscowych. Przegląd literatury z 2015 r. sprawdził dostępne badania nad zastosowaniem 14 takich specyfików. Okazało się, że dowody wysokiej jakości przemawiają za używaniem jedynie 6 z nich, przy czym najlepsze działanie w profilaktyce patologicznych blizn wykazuje żel zawierający 10-proc. wyciąg z cebuli, heparynę i alantoinę15.
We wcześniejszym badaniu na szczurach porównano działanie tego żelu z preparatami zawierającymi samą heparynę oraz samą alantoinę. Stwierdzono, że trójskładnikowy żel najskuteczniej zapobiega bliznom przerostowym i znacząco poprawia gojenie się ran – wyraźnie lepiej niż monoterapia. W badaniu histologicznym komórki tkanki z blizn po użyciu żelu wyglądały fizjologicznie16. Istnieją również badania kliniczne potwierdzające skuteczność tego preparatu. Jednym z pierwszych było niemieckie badanie z udziałem dzieci po operacji w obrębie klatki piersiowej. W grupie leczonej żelem po 6 miesiącach terapii wygląd blizn oceniono jako "dobry" lub "bardzo dobry" u 84% uczestników (przy 59% w grupie kontrolnej). Preparat powodował mniejszy rozrost blizn oraz szybsze ich blednięcie, dzięki czemu w grupie leczonej zaobserwowano rzadsze występowanie blizn przerostowych lub keloidowych. Ponadto żel ten był bardzo dobrze tolerowany przez pacjentów, a efekty utrzymywały się po zakończeniu leczenia (w badaniu kontrolnym po pół roku bez stosowania leku)17.
Pozytywną rolę w profilaktyce blizn może odgrywać ograniczanie rozciągania się rany podczas procesu gojenia. Tę właściwość zapewnia papierowa taśma. Ten prosty i niedrogi sposób profilaktyki blizn znany jest chirurgom co najmniej od lat sześćdziesiątych XX wieku. W roku 2005 Atkinson i wsp. udowodnili, że taśma papierowa znacząco zmniejsza objętość blizn i może być stosowana w zapobieganiu bliznom hipertroficznym18.
Skuteczną metodą zapobiegania tworzeniu się blizn po mastektomii jest zastosowanie frakcyjnego lasera ablacyjnego CO2. Niewielkie badanie kliniczne z br. objęło 15 kobiet po mastektomii i jednoczasowej rekonstrukcji piersi. Od razu po zdjęciu szwów u każdej pacjentki połowę blizny poddano działaniu takiego właśnie lasera, drugą połowę pozostawiając jako kontrolną. Nie zastosowano żadnych innych środków przeciwbliznowych, takich jak środki zmniejszające napięcie czy preparaty z silikonem, a jedynie opatrunek hydrokoloidowy przez tydzień po laseroterapii. Pół roku po leczeniu sprawdzono wygląd blizn w skali Vancouver i poproszono pacjentki o ich ocenę w wizualnej skali analogowej. W wyniku okazało się, że części blizn poddane działaniu lasera są znacząco mniejsze i wyglądają lepiej od drugiej połowy. Ponadto w analizie histologicznej stwierdzono, że kolagen w bliznach po laseroterapii jest znacząco lepiej zorganizowany i prezentuje mniej patologii niż w miejscach niepoddanych leczeniu20.
Podsumowując, fizjoterapia odgrywa niebagatelną rolę w opiece nad pacjentkami po mastektomii czy limfadenoktomii. Rehabilitanci pomagają w powrocie kobiet po operacji do aktywności, mogą łagodzić ich ból, zmniejszać obrzęk limfatyczny i poprawiać jakość życia. To jest ich wkład w walkę z nowotworem piersi.
Ryc. Profilaktyka blizn poprawia ich stan i wygląd.
- Didkowska J., Wojciechowska U., Nowotwory, Journal of Oncology 2013; 63(2): 111-118.
- Szkiela M. i in., Probl Hig Epidemiol. 2014; 95(2): 292-302.
- https://www.politykazdrowotna.com/73327,spadla-liczba-osob-zglaszajacych-sie-na-badania-profilaktyczne
- https://www.cancer.org/cancer/breast-cancer/treatment.html
- Shamley D. et al., Clinical Anatomy. 2014 Apr; 27(3): 467-77.
- Kim K.H. et al., J Breast Cancer. 2019 Sep; 22(3): 472-483.
- Giacalone A. et al., Cureus. 2019 Dec; 11(12): e6415.
- Ribeiro I.L. et al., Clin Rehabil. 2019 Dec; 33(12): 1876-1886.
- de la Rosa Diaz I. et al., J Chiropr Med. 2017 Mar; 16(1): 31-40.
- Gebruers N.V.H. et al., Arch Phys Med Rehabil. 2015; 96:1131-1139.
- Ribeiro Pereira A.C.P. et al., Breast. 2017 Dec; 36:67-73.
- Davies C. et al., Physical Therapy. 2020 Jul; 100(7): 1163-1179.
- Shin T.M., Dermatologic Surgery. 2011; 38(3): 414-23.
- Meaume S. et al., Eur J Dermatol. 2014; 24(4): 435-43.
- Fisher S. et al., Handchir Mikrochir Plast Chir. 2015; 47(04): 253-267.
- Sahin M.T. et al., J Drugs Dermatol. 2012 Jan 1; 11(1): 74-81.
- Maragakis M. et al., Drugs Exp Clin Res. 1995; 21(5): 199-206.
- Atkinson J.A. et al., Plast Reconstr Surg. 2005 Nov; 116(6): 1648-56.
- Lin Y.S. et al, Adv Skin Wound Care. 2020 Jun; 33(6): 1-6.
- Shin H.W. et al., Arch Plast Surg. 2021 Jul; 48(4): 347-352.
- Feldman J.L. et al., Lymphology. 2012; 45: 13-25.
- Baxter G.D. et al., BMC Cancer. 2017; 17: 833.
- Baglivo M. et al., Lymphat Res Biol. 2020; 18(3): doi: 10.1089/lrb.2019.0052.