Poważne urazy czaszkowo-mózgowe wymagają leczenia na oddziale intensywnej opieki medycznej. Czasem banalne zdawałoby się urazy głowy są bagatelizowane i niedostatecznie zdiagnozowane, jeżeli pacjent nie zostanie poddany 48-godzinnej obserwacji. Dopiero po pojawieniu się objawów kompresyjnych (wzrost ciśnienia śródczaszkowego) oceniony zostaje właściwy stopień ciężkości patologii. Skutki uboczne pod postacią ucisku tkanki nerwowej, wylewów i obumierania neuronów pozostawiają poważny ślad.
Traumatyczne urazy mózgu (ang. traumatic brain injuries, TBI) każdego roku dotykają miliony ludzi na całym świecie. Z przeprowadzonych badań wynika, że śmiertelność po urazach głowy mieści się w przedziale od 39 do 51%1,2. Są one najczęstszą przyczyną śmierci i niepełnosprawności wśród wszystkich chorób neurologicznych we wczesnych dekadach życia4,33. Dane statystyczne wskazują, że główną przyczyną urazów czaszkowo-mózgowych są wypadki drogowe (60%), a następnie upadki (20–25%), przemoc, wypadki przy pracy, urazy sportowe itd.
W 2005 r. wypadki drogowe spowodowały śmierć około 110 tysięcy osób, 2,5 miliona hospitalizacji, 8–9 milionów drobnych obrażeń i generowały znaczny koszt ekonomiczny związany z bezpośrednią opieką zdrowotną nad pacjentami, rehabilitacją i rentą wypłacaną z powodu niezdolności do pracy.
Zadziwiający przypadek Phineasa Gage’a
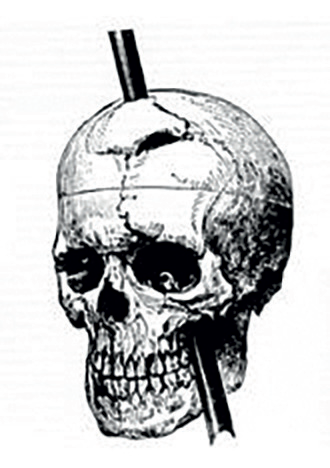
Najsłynniejszym pacjentem z urazem mózgu w historii medycyny był Phineas Gage, amerykański kierownik budowy kolei. W 1848 r. doznał poważnego uszkodzenia mózgu – metrowy, ważący sześć i pół kilograma stalowy pręt przebił na wylot jego czaszkę, niszcząc znaczną część płatów czołowych (ryc.). Gage żył po wypadku jeszcze 12 lat. Był to ewenement, większość poważnych przypadków kończyła się wówczas śmiercią z powodu wykrwawienia pacjenta lub infekcji.
Lekarzy zastanawiało wtedy jeszcze jedno: według relacji wielu świadków dramatyczny wypadek znacząco zmienił cechy osobowości i temperament Phineasa. W XIX wieku niewiele wiedziano o mózgu, a jeszcze mniej o leczeniu urazów. Mimo wielkiego postępu medycyny naukowcy nadal badają zagadnienie odwracalności skutków uszkodzeń mózgu, z pewnością kryje ono jeszcze wiele tajemnic.
Definicja urazów czaszkowo-mózgowych
Urazy czaszkowo-mózgowe, zwane również nabytymi uszkodzeniami mózgu lub po prostu urazami głowy, są stanem występującym w wyniku zadziałania zewnętrznej siły na mózg i wiążą się ze zmianami świadomości, które mogą powodować zaburzenia poznawcze, fizyczne i psychospołeczne.
- Uszkodzenia spowodowane przez urazy czaszkowo-mózgowe mogą mieć charakter ogniskowy (ograniczone do jednego obszaru mózgu) lub rozproszony (obejmujące więcej niż jeden obszar mózgu).
- Uraz czaszkowo-mózgowy może być zamknięty lub otwarty – penetrujący.
- Uraz zamknięty ma miejsce, gdy głowa nagle i gwałtownie uderza w przedmiot, ale przedmiot ten nie przebija czaszki.
- Uraz penetrujący występuje, gdy przedmiot przebija czaszkę i dostaje się do tkanki mózgowej.
- Do urazów czaszkowo-mózgowych dochodzi najczęściej w wieku poniżej 45 lat i dwukrotnie częściej dotyczą one mężczyzn. Częstotliwość osiąga szczytowy poziom między 15. a 30. rokiem życia.
- Niski status społeczno-ekonomiczny, incydent urazu czaszkowo- mózgowego w historii życia pacjenta, nadużywanie alkoholu i substancji odurzających stanowią inne czynniki ryzyka4.
Zakres uszkodzeń w urazach czaszkowo-mózgowych
W zależności od stopnia i rodzaju uszkodzenia mózgu po urazie czaszkowo- mózgowym może wystąpić kilka sytuacji klinicznych. Faza krytyczna została nieco arbitralnie określona jako "pierwsze 10 minut". Różne doniesienia w piśmiennictwie fachowym podkreślają rolę niedokrwienia w pierwszych 24 godzinach po urazie głowy, które jest powszechnie znane jako uraz wtórny3.
Uraz wtórny jest procesem kaskadowym, który doprowadza do wystąpienia bezdechu i wyzwala związane ze stresem masowe wyładowania ze strony układu współczulnego44. Uszkodzenie wtórne, głównie o charakterze niedokrwiennym, występujące w fazie pourazowej, może być spowodowane nadciśnieniem wewnątrzczaszkowym, układową hipotensją, niedotlenieniem, wysoką gorączką, hipokapnią i hipoglikemią, z których wszystkie niezależnie zmniejszają szanse przeżycia po urazie czaszkowo-mózgowym.
Ciężkość urazu określa się w momencie urazu. Chociaż wspomniany poziom ciężkości ma pewną wartość prognostyczną, niekoniecznie odzwierciedla zdolności funkcjonalne pacjenta. W związku z tym wymagane jest przeprowadzanie seryjnych testów oceniających stopień funkcjonowania poznawczego, emocjonalnego, behawioralnego i społecznego pacjenta. Na ich podstawie stan pacjenta jest klasyfikowany jako łagodny, umiarkowany lub ciężki.
Stopień ciężkości urazów głowy
- Poziom: Lekki
- Obrazowanie medyczne: bez zmian
- Utrata świadomości: 0–30 min
- Zmiany w poziomie świadomości: od chwili do 24 godz.
- Amnezja pourazowa: 0–1 dzień
- Poziom: Średni
- Obrazowanie medyczne: bez zmian lub z niewielkimi zmianami
- Utrata świadomości: >30 min – 24 godz.
- Zmiany w poziomie świadomości: 24 godz. oparte na stopniu ciężkości lub innych kryteriach
- Amnezja pourazowa: 1–7 dni
- Poziom: Ciężki
- Obrazowanie medyczne: bez zmian lub ze zmianami
- Utrata świadomości: >24 godz.
- Zmiany w poziomie świadomości: 24 godz. oparte na stopniu ciężkości lub innych kryteriach
- Amnezja pourazowa: >7 dni
Inna użyteczna klasyfikacja urazów czaszkowo-mózgowych opiera się na uznawanej za najlepszą skali Glasgow Coma Scale (GCS)49 przeprowadzanej po resuscytacji, która ma istotne znaczenie prognostyczne34. Wiadomo także, że znaczący obrzęk mózgu jest częstą konsekwencją urazów czaszkowo-mózgowych, a niektóre typy zmian ogniskowych, takie jak krwiak podtwardówkowy, wiążą się z głębszymi uszkodzeniami miąższu mózgu niż inne, takimi jak krwiaki zewnątrzoponowe. Wynik w skali GCS uzyskuje się poprzez ocenę trzech parametrów: otwierania oczu, mowy i reakcji motorycznej.
Jest to szeroko akceptowana i dobrze zrozumiana skala, która pozwala na wczesną klasyfikację i bieżącą ponowną ocenę ciężkości obrażeń pacjenta. Ogólnie zakłada się, że wynik na skali GCS wynoszący 14–15 punktów wskazuje na łagodny uraz, 9–13 punktów wskazuje na umiarkowany uraz, a wynik o wartości 3–8 punktów jest klasyfikowany jako ciężki uraz czaszkowo-mózgowy51. Najwyższy wynik na skali GCS w ciągu pierwszych 24 godzin po urazie jest w wielu badaniach naukowych i klinicznych wybierany jako miara ciężkości urazu.
Wtórne urazy mózgu wynikają zarówno z przyczyn ogólnoustrojowych, jak i wewnątrzczaszkowych i mogą wystąpić w dowolnym momencie podczas wstępnej resuscytacji i stabilizacji oraz podczas intensywnej terapii. Za wszelką cenę należy unikać niedociśnienia, ponieważ powoduje ono zmniejszenie przepływu krwi w mózgu (CBF)8, a przepływ poniżej wartości progowej skutkuje niedokrwieniem mózgu. Z kolei nadciśnienie może zaostrzyć obrzęk naczynioruchowy, negatywnie wpływając na wartości ciśnienia wewnątrzczaszkowego (ICP)19. Chociaż zwiększenie ciśnienia perfuzji mózgowej (CPP) może być postrzegane jako przydatny sposób na zwiększenie dostarczania tlenu do mózgu, to wiąże się z ryzykiem, ponieważ zwiększone ciśnienie perfuzji może prowadzić do biernego wzrostu średnicy naczyń krwionośnych, zwiększając objętość krwi w mózgu, a co za tym idzie – także ciśnienie wewnątrzczaszkowe.
Z przekształcenia wzoru wynika, że ciśnienie śródczaszkowe równa się różnicy pomiędzy średnim ciśnieniem tętniczym a ciśnieniem perfuzji mózgu. Zwiększone ciśnienie hydrostatyczne w naczyniach włosowatych mózgu może również prowadzić do obrzęku naczyniopochodnego, który także zwiększa ciśnienie wewnątrzczaszkowe.
W pierwszych wytycznych Komisji do spraw Urazów Mózgu opublikowanych w 1996 r. (Brain Trauma Foundation, 1996) CPP o wartości 70 mm Hg przyjęto jako cel, do którego należy dążyć we wczesnych stadiach urazów czaszkowo-mózgowych. Docelowy CPP 70 mm Hg w porównaniu z 50 mm Hg prowadzi do większego spożycia płynów, konieczności stosowania większych dawek leków inotropowych, częstszego stosowania monitorowania inwazyjnego i pięciokrotnego wzrostu częstości występowania zespołu ostrej niewydolności oddechowej. Protokół Lund ma na celu zminimalizowanie docelowego CPP do poziomu 50 mm Hg, który pozwala uniknąć jawnego niedokrwienia, nie prowadząc jednocześnie do dalszych uszkodzeń tkanki mózgowej17,19.
Reakcja na stres u pacjentów po urazach, w tym tych z ciężkimi urazami czaszkowo-mózgowymi, generuje stan hiperkataboliczny prowadzący do szybkiego rozpadu białek mięśniowych i hiperglikemii32. Na poziomie komórkowym pojawiają się szkodliwe skutki funkcji makrofagów i neutrofili, a także istnieją dowody sugerujące dysfunkcję działania samych aksonów52. Zaburzenia funkcjonowania układu na poziomie komórkowym mogą prowadzić do powikłań, takich jak zapalenie płuc (46,7%), niedodma (43,3%), niedokrwistość (40,0%), zapalenie opon mózgowych (30,0%) i spastyczność (23,3%).
Kalisky i in. donieśli, że zapalenie płuc, obrzęk płuc, zakrzepowe zapalenie żył, padaczka, odleżyny, krwawienia z przewodu pokarmowego i kostnienie heterotroficzne są częste w rehabilitacji po fazie ostrej urazu czaszkowo-mózgowego28. W innym badaniu spastyczność, przykurcze, odleżyny, depresje, padaczka i kostnienie heterotroficzne zostały również sklasyfikowane na liście częstych powikłań urazów czaszkowo- mózgowych41.
Kostnienie heterotroficzne występuje dość często u pacjentów z ciężkim urazem czaszkowo-mózgowym, zwłaszcza u osób z przedłużającą się śpiączką28. Odleżyny obserwuje się zwłaszcza u pacjentów ze złym rokowaniem i długim czasem trwania śpiączki, przy czym częstość ich występowania wzrasta wprost proporcjonalnie do czasu trwania hospitalizacji4. Według piśmiennictwa powikłania takie jak zapalenie płuc, niedokrwistość, zakrzepica żył głębokich (DVD, przedłużenie czasu pobytu na oddziale intensywnej opieki medycznej)54,31 oraz anemia, drugie najczęstsze powikłanie, mogą być wynikiem uszkodzeń wielonarządowych, powtarzających się transfuzji krwi lub krwawień z przewodu pokarmowego spowodowanych wrzodami4, 53.
W różnych badaniach podkreślano wczesną resuscytację i opiekę przedszpitalną jako kluczowe dla uzyskania lepszych wyników terapii pacjentów po przebytych urazach czaszkowo-mózgowych. Transport ciężko rannych pacjentów z miejsca zdarzenia bezpośrednio do ośrodków urazowych I stopnia wiąże się ze zmniejszeniem śmiertelności i zachorowalności. Poprawa jest szybsza u dzieci i młodych dorosłych w porównaniu z dorosłymi powyżej 45. roku życia4.
Urazy czaszkowo-mózgowe - ewaluacja
Pacjenci poddawani rehabilitacji medycznej na oddziale intensywnej terapii są narażeni na ryzyko wystąpienia powikłań o różnym nasileniu. Właściwa diagnostyka i profilaktyka powikłań mogą być decydujące dla postępów rehabilitacji i pozytywnie wpływać na wyniki czynnościowe pacjentów po przebytych urazach czaszkowo-mózgowych.
W celu oceny ciężkości urazu, przewidywania wyników i wyboru najodpowiedniejszego leczenia zdefiniowano czynniki prognostyczne, takie jak wiek, wynik na skali GCS, czas trwania amnezji pourazowej, czas trwania śpiączki, obecność odruchu źrenicznego na światło i wyniki tomografii komputerowej (TK)4. Wzrost napięcia mięśniowego można oceniać za pomocą skali Ashwortha5, a zakres ruchu (ROM) za pomocą goniometru i badania obecności przykurczów. Procedury te wykonywane są regularnie.
Pacjenci przy przyjęciu na OIOM i przy wypisie z tego oddziału są oceniani za pomocą następujących narzędzi:
- Miary niezależności funkcjonalnej (Functional Independence Measures, FIM): FIM jest szeroko stosowanym wskaźnikiem wyników osiąganych w rehabilitacji. Mierzy poziom pomocy, jakiej jednostka potrzebuje, aby wykonywać podstawowe czynności życiowe. Jest to 18-punktowa, 7-poziomowa skala, która ocenia zdolność osoby do samodzielnego wykonywania czynności w zakresie samoopieki, kontroli zwieraczy, transferu, lokomocji, komunikacji i aktywności społecznej23.
- Skala oceny niepełnosprawności (Disability Rating Scale, DRS): została opracowana do użytku głównie z osobami po przebytych urazach czaszkowo-mózgowych43. Ma 8 pozycji, które oceniają 4 kategorie: stopień pobudzenia i świadomość, stopień zachowania zdolności poznawczych do samoobsługi, fizyczne uzależnienie od innych oraz psychospołeczne przystosowanie do pracy, zadań w otoczeniu domowym i w szkole. Wyniki DRS mieszczą się w zakresie od 0 do 30; niższy wynik oznacza niższy stopień niepełnosprawności.
- Poziomy poznawcze Rancho Los Amigos (RLA) (skala funkcjonalna): Skala RLA została opracowana do wykorzystania w planowaniu leczenia, śledzeniu powrotu do zdrowia i klasyfikowaniu poziomu rezultatów usprawniania pacjentów po przebytych urazach czaszkowo-mózgowych22. Wyróżnia się 8 poziomów klasyfikacji: od braku odpowiedzi (poziom I) przez zdezorientowanie i nadmierne pobudzenie (poziom IV) do zachowań celowych i adekwatnych (poziom VIII).
- Ocena fizjoterapeutyczna ostrego uszkodzenia mózgu (Acute Brain Injury Physiotherapy Assessment, ABIPA): ABIPA jest przeznaczona dla pacjentów w fazie ostrej po ciężkim urazie mózgu lub wylewie podpajęczynówkowym. Jest to globalna ocena oparta na obserwacji, która uwzględnia ogólne wzorce. Skalę można stosować u pacjentów, którzy nie są w stanie wykonywać poleceń lub mają deficyty poznawcze.
Kaplan ocenił stan funkcjonalny i poznawczy za pomocą FIM i wykazał istnienie związku między poziomem poznawczym i motorycznym29. W literaturze opisano również, że przedłużony pobyt na oddziale intensywnej opieki medycznej negatywnie wpływa na wyniki FIM16.
Planowanie i wdrażanie terapii u pacjentów z urazem czaszkowo-mózgowym
Śmiertelność i powikłania związane z urazami czaszkowo-mózgowymi zmniejszyły się dzięki nowoczesnej opiece neurochirurgicznej. jednak śmiertelność jest nadal wysoka wśród pacjentów z ciężkimi postaciami urazów głowy. Współczesne leczenie ciężkich urazów czaszkowo-mózgowych stało się domeną multidyscyplinarnego zespołu kierowanego przez neurochirurgów, neuroanestezjologów, neurologów i fizjoterapeutów. Opiera się na unikaniu wtórnych uszkodzeń, utrzymaniu CPP i optymalizacji dotlenienia mózgu.
Chociaż leczenie jest oczywiście ważne w celu zmniejszenia ciężkości urazów, intensywne interwencje rehabilitacyjne mogą mieć znaczący wpływ7 na poprawę stanu poznawczego i funkcjonalnego pacjenta. Opieka medyczna i rehabilitacyjna wdrażana natychmiast w stanie ostrym może istotnie wpływać na przeżycie i dalszy przebieg choroby oraz stan pacjenta.
W omawianej grupie pacjentów celem rehabilitacji jest poprawa funkcji neurologicznej, zapobieganie powikłaniom, zapewnienie pacjentowi optymalnego środowiska sprzyjającego powrotowi do zdrowia i stymulującego odtwarzanie funkcji w celu uzyskania możliwie największej niezależności. W badaniu retrospektywnym wykazano, że korzyści osiągnięte podczas wczesnej rehabilitacji przez pacjentów z ciężkimi postaciami urazów czaszkowo-mózgowych utrzymują się na ogół w trakcie długoterminowej obserwacji45. Rehabilitacja rozpoczyna się w okresie intensywnej terapii i w niektórych przypadkach może trwać całe życie4.
Czas trwania śpiączki i hospitalizacji, wiek, wynik na skali GCS, poziom wykształcenia, powikłania medyczne i towarzyszące uszkodzenia i choroby współistniejące to tylko niektóre z czynników mogących wpływać na wyniki rehabilitacji7,20,55. W okresie ostrym celem jest zapobieganie powikłaniom, które mogą spowodować lub pogłębić późniejszą niepełnosprawność. Aby uzyskiwać jak najlepsze wyniki u pacjentów po przebytych urazach, fizjoterapeuci przestrzegają surowego protokołu.
Leczenie urazów czaszkowo-mózgowych opiera się na zapewnieniu dobrej podstawowej intensywnej opieki medycznej i interwencji optymalizujących ciśnienie perfuzji mózgowej (CPP), ciśnienie wewnątrzczaszkowe (ICP) oraz unikaniu wtórnych uszkodzeń. Prawidłowe CVP wynosi od 5 do 10 mm Hg18, a wysokie ciśnienie układowe może utrzymywać przepływ krwi w mózgu (CBF). Dlatego rola pozycji i odpowiedniego odchylenia głowy jest bardzo ważna.
W przypadku podłączenia pacjenta do aparatury oraz wielu dostępów żylnych ważne jest, aby wszystkie dostępy i podłączenia były najpierw zabezpieczone przed zmianą pozycji i późniejszą fizjoterapią. W przypadku ciężkiego lub opornego na leczenie nadciśnienia wewnątrzczaszkowego można zastosować lidokainę, tiopenton, fentanyl lub midazolam w postaci bolusów, aby zmniejszyć potencjalnie niekorzystną reakcję ciśnienia wewnątrzczaszkowego (ICP) na fizjoterapię i odsysanie przeztchawicze.
Pacjenci z ciężkim urazem głowy wymagają wentylacji mechanicznej38. Nie ma absolutnego przeciwwskazania do stosowania dodatniego ciśnienia końcowowydechowego u pacjentów z hipoksemią, chyba że wzrost ciśnienia żylnego w klatce piersiowej powoduje niedopuszczalny wzrost ciśnienia wewnątrzczaszkowego. Należy unikać hiperkapnii permisywnej ze względu na jej działanie rozszerzające naczynia mózgowe, które zwiększa ciśnienie wewnątrzczaszkowe. Odpowiednia sedacja minimalizuje ból, niepokój i pobudzenie, zmniejsza zapotrzebowanie metaboliczne na tlen w mózgu i ułatwia wentylację mechaniczną.
Istnieją dalsze dowody na to, że dzięki proaktywnemu leczeniu skutków ubocznych hipotermii, takich jak zapalenie płuc, można osiągnąć poprawę wyników u pacjentów39, co stanowi istotny argument na rzecz wdrażania fizjoterapii na wczesnych etapach opieki nad pacjentem. Rehabilitacja oddechowa jest ważnym elementem leczenia pacjentów OIOM9.
Fizjoterapia klatki piersiowej może być stosowana u pacjentów z urazami czaszkowo-mózgowymi na oddziale intensywnej terapii jako profilaktyka lub w przypadku zatrzymania wydzieliny i objawów radiologicznych niedodmy lub naciekania płuc. Postępowanie w chorobach płuc powszechnie występujących u intubowanych pacjentów OIOM poddawanych wentylacji mechanicznej (np. zapalenie płuc, infekcje oskrzelowo- płucne, niedodma, ostre zaostrzenie przewlekłej choroby płuc, ARDS) często obejmuje fizjoterapię oraz wspomaganie wczesnego odsysania.
Manualną hiperinflację stosuje się w celu zapobiegania zapadaniu się płuc, ponownego rozszerzenia zapadniętych pęcherzyków płucnych, poprawy natlenienia i podatności płuc oraz zwiększenia ruchu wydzieliny płucnej w kierunku górnych dróg oddechowych48,9,25.
Odsysanie za pomocą ssaka dotchawiczego lub poprzez tracheostomię jest stosowane w celu usunięcia wydzieliny z centralnych dróg oddechowych i stymulacji kaszlu12,27.
Mobilizacja powinna być stosowana jako podstawowy środek zwiększający transport tlenu u pacjentów w fazie ostrej choroby płuc, w tym pacjentów przebywających na oddziałach intensywnej opieki medycznej14,15. Ćwiczenia czynne kończyn wykonywane są u pacjentów aktywnie poruszających się w obrębie łóżka. Wstawanie z łóżka przy pomocy urządzeń mechanicznych, sadzanie pacjentów na krawędzi łóżka, stanie, transfer z łóżka na krzesło i chodzenie optymalizują transport tlenu poprzez poprawę wentylacji pęcherzykowej.
Układanie pacjentów oddziałów intensywnej opieki medycznej może być wykorzystywane w celu optymalizacji transportu tlenu poprzez poprawę dopasowania wentylacji i perfuzji, zwiększenie objętości płuc, zmniejszenie obciążenia oddechowego, zminimalizowanie obciążenia serca i poprawę stanu klirensu śluzowo-rzęskowego14,15,36. Poszczególne przykłady układania, które mogą być stosowane na oddziale intensywnej opieki medycznej, obejmują sadzanie w pozycji wyprostowanej w celu poprawy objętości płuc i zmniejszenia ciężkości oddychania u pacjentów odstawianych od respiratora. Celem jest również utrzymanie odpowiedniego ciśnienia wewnątrzczaszkowego, optymalizacja ciśnienia perfuzji i mózgowego przepływu krwi.
Podczas układania pacjenta należy wziąć pod uwagę ryzyko obszarów ucisku (tworzenia się odleżyn), przykurczów i powikłań oddechowych. W celu zapobiegania odleżynom pozycja pacjenta powinna być często zmieniana. Może to być tak proste, jak przełożenie pacjenta z pozycji leżącej na plecach do leżenia na boku, jednak w idealnym przypadku zmiana pozycji powinna również obejmować sadzanie pacjenta na brzegu łóżka ze spuszczonymi kończynami i stawianie go na pewien czas za pomocą stołu do pionizacji.
Ciągła terapia rotacyjna, znana również jako terapia kinetyczna, polega na stosowaniu specjalistycznych łóżek, które w sposób ciągły i powolny obracają pacjenta wzdłuż osi podłużnej, do kąta 60 stopni w każdą stronę, z zaprogramowanymi stopniem i prędkością obrotu. Uzasadnieniem dla stosowania ciągłej terapii rotacyjnej jest to, że zapobiega ona zapadaniu się dróg oddechowych, zmniejszonej sprężystości tkanek układu oddechowego, niedodmie, gromadzeniu się i stagnacji wydzielin płucnych, a w rezultacie zmniejsza ryzyko infekcji, które, jak się uważa, są powikłaniem długotrwałego unieruchomienia42.
Spastyczność jest częstym problemem u pacjentów po przebytych urazach czaszkowo-mózgowych, a odpowiednie układanie we wczesnym okresie, zastosowanie szyn i łusek oraz ćwiczenia ROM mogą zapobiec narastaniu spastyczności. Ćwiczenia kończyn (bierne, wspomagane lub czynne przeciwko oporowi) mogą być wykonywane u pacjentów oddziałów intensywnej opieki medycznej w celu utrzymania lub poprawy zakresu ruchomości stawów, długości tkanek miękkich, siły i funkcji mięśni oraz zmniejszenia ryzyka zakrzepicy żył głębokich i odleżyn4,50.
Inne metody zapobiegania zakrzepicy żylnej obejmują:
- pończochy przeciwzakrzepowo-zatorowe,
- urządzenia masażu ciśnieniowego,
- niskie dawki niefrakcjonowanej heparyny (UH),
- heparynę drobnocząsteczkową (LMWH),
- filtry żyły głównej,
- kombinację wyżej wymienionych metod.
Przykurcze są częstym powikłaniem urazów czaszkowo-mózgowych. Zapobieganie przykurczom jest jednym z głównych zadań fizjoterapeutów na oddziale intensywnej opieki medycznej w odniesieniu do osób po urazie mózgu. Jeśli pacjent nie może aktywnie uczestniczyć w terapii rozciągającej mięśnie dostatecznie długo, najlepszym sposobem zapobiegania przykurczom jest rozciąganie bierne z zastosowaniem niewielkich obciążeń.
Gdy rozciąganie jest niewystarczające do utrzymania właściwej długości mięśni lub jeśli doszło już do powstania przykurczów, konieczne może być rozważenie wykonania serii gipsowań. Seryjne gipsowania są szeroko stosowane w fazie podostrej rehabilitacji neurologicznej w celu zmniejszenia spastyczności i poprawy zakresu ruchu. Zwykle stosuje się seryjne gipsowanie, w którym opatrunki gipsowe należy wymieniać w odstępach od 4 do 7 dni. Jego głównym celem jest poprawa ruchomości stawów. Brak dotychczasowych badań oceniających skuteczność tej interwencji na oddziałach intensywnej terapii prawdopodobnie wynika z krótkiego czasu pobytu pacjentów na tych oddziałach.
Dysautonomia dotyka niewielkiej, ale mimo to znaczącej podgrupy osób, które przeżyły ciężkie uszkodzenie mózgu w wyniku urazu. Jednostka ta jest słabo opisana w literaturze medycznej. Z punktu widzenia fizjoterapeuty głównym celem w dysautonomii jest maksymalne utrzymanie długości mięśni. Często wymagane jest seryjne gipsowanie stawu nadgarstkowego, stawów śródręczno-paliczkowych i międzypaliczkowych oraz wdrożenie programu redresji kończyn górnych i pionizacji pacjenta. Szyny z miękkiej pianki i regulowane ortezy wykorzystywane są do utrzymywania zakresu ruchomości stawów łokciowych. Może być wymagane usunięcie szyn podczas epizodu dysautonomicznego i ich ponowne założenie po jego ustąpieniu.
Zaleca się również wsparcie żywieniowe w celu zaspokojenia pełnego zapotrzebowania żywieniowego po osiągnięciu stabilności hemodynamicznej. Zwiększone zapotrzebowanie metaboliczne podczas fizjoterapii jest reakcją przypominającą wysiłek fizyczny, wynikającą ze zwiększonej aktywności mięśni, podczas gdy zwiększona reakcja hemodynamiczna jest najprawdopodobniej spowodowana reakcją podobną do stresu, związaną ze zwiększoną aktywnością układu współczulnego. Przegląd Cochrane sugeruje, że wczesne wprowadzenie karmienia może się wiązać z tendencją do lepszych wyników w zakresie przeżycia i mniejszego stopnia niepełnosprawności37.
Ranka i wsp. przebadali 36 pacjentów po ciężkich urazach czaszkowo-mózgowych, obserwując u nich głównie choroby układu oddechowego, odleżyny, zakrzepicę żył głębokich i przykurcze. Powikłania te rozwijały się w ciągu pierwszych czterech tygodni, a głównym celem wczesnej rehabilitacji jest zapobieganie tym powikłaniom41. Wczesna rehabilitacja zmniejsza częstość powikłań i ułatwia ich opanowanie. Długość przebywania na oddziale intensywnej terapii jest ważnym czynnikiem determinującym skuteczność programu rehabilitacji i jej wpływ na niepełnosprawność i stan funkcjonalny pacjenta oraz na ryzyko powikłań. Z drugiej strony rozwój powikłań może również wydłużyć czas pobytu na oddziale intensywnej opieki medycznej11.
U pacjentów, którzy rozpoczynają rehabilitację już podczas pobytu na oddziale intensywnej opieki medycznej, następuje znaczna poprawa w wyniku na skali FIM, DRS i Rancho Los Amigos. Znaczącą poprawę funkcjonalną wielu pacjentów można osiągnąć dzięki programom rehabilitacji w fazie ostrej, z tego względu jest ona częścią intensywnej terapii służącą zachowaniu potencjału aktywności funkcjonalnej mózgu. Wczesna rehabilitacja u osób po przebytych urazach czaszkowo-mózgowych jest standardem postępowania akceptowanym na całym świecie.
Skuteczność procedur fizjoterapeutycznych stosowanych na oddziałach intensywnej opieki medycznej
- Procedura: Odzwyczajanie od respiratora
- Sposób postępowania/technika: Protokół fizjoterapeutyczny
- Poziom wiarygodności: A
- Procedura: Fizjoterapia klatki piersiowej
- Sposób postępowania/technika: Oklepywanie/wibracja
- Poziom wiarygodności: C
- Sposób postępowania/technika: Manualne upowietrzanie
- Poziom wiarygodności: B-C
- Sposób postępowania/technika: Oklepywanie/wibracja
- Procedura: Mobilizacja
- Sposób postępowania/technika: Postura
- Poziom wiarygodności: C
- Sposób postępowania/technika: Ćwiczenia kończyn
- Poziom wiarygodności: D
- Sposób postępowania/technika: Ciągła terapia rotacyjna
- Poziom wiarygodności: B–C
- Sposób postępowania/technika: Postura
- Procedura: Trening mięśni
- Sposób postępowania/technika: Mięśnie oddechowe
- Poziom wiarygodności: C
- Sposób postępowania/technika: Mięśnie obwodowe
- Poziom wiarygodności: B–C
- Sposób postępowania/technika: Elektrostymulacja
- Poziom wiarygodności: B
- Sposób postępowania/technika: Mięśnie oddechowe
Rehabilitacja pacjentów z urazem czaszkowo-mózgowym - wnioski
Urazowe uszkodzenie mózgu ma niszczący wpływ na życie i finanse osób ocalałych z niepełnosprawnością, a także na ich relacje rodzinne. Koszt opieki nad pacjentami w przedłużającej się śpiączce pourazowej może wpłynąć na budżet całego systemu opieki zdrowotnej. W piśmiennictwie podkreśla się konieczność przewidywania powikłań, wczesnego podejmowania działań profilaktycznych, a rehabilitacja w tym okresie wpływa pozytywnie zarówno na zmniejszenie częstości powikłań, jak i na wynik funkcjonalny chorego.
Fizjoterapia jest postrzegana jako integralna część leczenia pacjentów na oddziale intensywnej terapii. Ponieważ koszty związane z leczeniem pacjentów na oddziale intensywnej terapii są bardzo wysokie, a zakres dopuszczalnych zaniedbań jest zerowy, obowiązkowym wymogiem dla wszystkich osób pracujących na OIT, w tym fizjoterapeutów, staje się stosowanie wytycznych postępowania opartych na dowodach.
- Aldrich E.F., Eisenberg H.M., Saydjari C., Fowlkes M.A.: Predictors of mortality in severely head-injured patients with civilian gunshot wounds: a report from the NIH Traumatic Coma Bank. Surg Neurol 1992; 38: 418–423.
- Aras M.D., Kaya A., Cakcı A., Gokkaya K.O.: Functional outcome following traumatic brain injury: the Turkish experience. Int J Rehabil Res. 2004; 27: 257–260.
- Andrews PJ, Sleeman DH, Statham PF, et al. Predicting recovery in patients suffering from traumatic brain injury by using admission variables and physiological data: A comparison between decision tree analysis and logistic regression. J Neurosurg 2002; 97: 326–30.
- Boake C., Francisco G., Ivanhoe C.: Brain Injury Rehabilitation. En: Braddom RL (ed) Physical Medicine and Rehabilitation. Indianapolis; W.B. Saunders Company., 2000; 1073–1116.
- Bohannon R.W., Smith M.B.: Interrater reliability on a Modified Ashworth scale of muscle spasticity. Phys Ther 1987; 67: 206–207.
- Brain_Trauma_Foundation. Guidelines for cerebral perfusion pressure. Brain Trauma Foundation. J Neurotrauma 1996; 13: 693–7.
- Bush BA., Novack TA., Malec JF., Stringer AY, Millis SR, Madan A.: Validation of a model for evaluating outcome after traumatic brain injury. Arch Phys Med Rehabil 2003; 84: 1803–1807.
- Chesnut RM, Marshall LF, Klauber MR et al. The role of secondary brain injury in determining outcome from severe head injury. J Trauma 1993; 34: 216–22.
- Ciesla, N.D.: Chest physical therapy for patients in the intensive care unit. Physical Therapy 1996; 76: 609-625.
- Cohen D, Horiuchi K, Kemper M, et al. Modulating effects of propofol on metabolic and cardiopulmonary responses to stressful intensive care unit procedures. Crit Care Med 1996; 24: 612–617.
- Cowen T., Meythaler J., DeVivo M., Ivie C., Lebow J., Novack T.: Influence of early variables in traumatic brain injury on Functional Independence Measure scores and rehabilitation length of stay and charges. Arch Phys Med Rehabil, 1995; 76: 797–805.
- Daber SE, Jackson SE. Role of the physiotherapist in the intensive care unit. Intensive Care Nurs 1987; 3: 165–171.
- Davis C.H., Fardanesh L., Rubner D., Wanlass R.L., McDonald C.M.: Profiles of functional recovery in fifty traumaticallybrain injured patients after acute rehabilitation. Am J Phys Med Rehabil 1997; 76: 213–218.
- Dean E, Ross J. Discordance between cardiopulmonary physiology and physical therapy: toward a rational basis for practice. Chest 1992; 101: 1694–1698.
- Dean E. Oxygen transport: a physiologically-based conceptual framework for the practice of cardiopulmonary physiotherapy. Physiotherapy 1994; 80: 347–355.
- Deshpande A., Millis S.R., Zafonte R.D., Hammond F.M.: Risk factors for acute care transfer among traumatic brain injury patients. Arch Phys Med Rehabil 1997; 78: 350–352.
- Eker C, Asgeirsson B, Grande PO, Schalen W, Nordstrom CH. Improved outcome after severe head injury with a new therapy based on principles for brain volume regulation and preserved microcirculation. Crit Care Med 1998; 26: 1881–6.
- Ghajar J. Traumatic brain injury. Lancet 2000; 356: 923–9.
- Grande PO, Asgeirsson B, Nordstrom C. Aspects on the cerebral perfusion pressure during therapy of a traumatic head injury. Acta Anaesthesiol Scand 1997; 110: 36–40.
- Gray D.S., Burnharm R.S.: Preliminary outcome analysis of a long term rehabilitation program for J. Irdesel; S.B. Aydiner and S. Akgoz, Rehabilitation outcome after traumatic brain injury. Neurocirugia, 2007; 18: 5–15.
- Gururaj G.: Road traffic deaths, injuries and disabilities in India: current scenario. Natl Med J India 2008; 21: 14–20.
- Hagen C., Malkmus D., Durham P.: Levels of cognitive functioning. Downey (CA); Rancho Los Amigos Hospital; 1972. Bushnik, T.: Introduction: The traumatic brain injury model systems of care. Arch Phys Med Rehabil 2003; 84: 151–152.
- Hamilton B.B., Granger C.V., Sherwin F.S., Zielezny M. Tashman J.S.: A uniform national data system for medical rehabilitation. En: Fuhrer, M.J. (ed). Rehabilitation outcomes analysis and measurement. Baltimore; Brookes. 1987; 137–150.
- Harding J, Kemper M, Weissman C. Midazolam attenuates the metabolic and cardiopulmonary responses to an acute increase in oxygen demand. Chest 1994; 106: 194–200.
- Hodgson C, Carroll S, Denehy L. A survey of manual hyperinflation in Australian hospitals. Aust J Physiother 1999; 45: 185–193.
- Jones AYM, Hutchinson RC, Oh TE. Chest physiotherapy practice in intensive care units in Australia, the UK and Hong Kong. Physiother Theory Pract 1992; 8: 39–47.
- Judson MA, Sahn SA. Mobilization of secretions in ICU patients. Respir Care 1994; 39: 213–226.
- Kalisky Z., Morrison D.P., Meyers C.A., Von Laufen A.: Medical problems encountered during rehabilitation of patients with head injury. Arch Phys Med Rehabil 1985; 66: 25–29.
- Kaplan, C.P., Corrigan, J.D.: The relationship between cognition and functional independence in adults with traumatic brain injury. Arch Phys Med Rehabil 1994; 75: 643–647.
- Klein P, Kemper M, Weissman C, et al. Attenuation of the hemodynamic responses to chest physical therapy. Chest 1988; 93: 38–42.
- Mayer N.H., Pelensky S., Whyte S., Fidler, R.: Characterization and correlates of medical and rehabilitation charges of traumatic brain injury during acute rehabilitation hospitalization. Arch Phys Med Rehabil 2003; 84: 242–248.
- McCowen KC, Malhotra A, Bistrian BR. Stress-induced hyperglycemia. Crit Care Clin 2001; 17: 107–24.
- Meray J.: Kafa Travması ve Rehabilitasyonu. En: Beyazova M, Gökçe-Kutsal Y (eds). Fiziksel Tıp ve Rehabilitasyon. Ankara; Güneş Kitabevi., 2000; 1951–1962.
- Narayan RK, Greenberg RP, Miller JD, et al. Improved confidence of outcome prediction in severe head injury. A comparative analysis of the clinical examination, multimodality evoked potentials, CT scanning and intracranial pressure. J Neurosurg 1981; 54: 751–62.
- Nava S.: Rehabilitation of patients admitted to a respiratory intensive care unit. Arch Phys Med Rehabil 1998; 79: 849–854.
- Paratz J. Haemodynamic stability of the ventilated intensive care patient: a review. Aust J Physiother 1992; 38: 167–172.
- Perel P, Yanagawa T, Bunn F, Roberts I, Wentz R, Pierro A. Nutritional support for head-injured patients. Cochrane Database Syst Rev (Online) 2006: CD001530
- Piek J. Guidelines for the pre-hospital care of patients with severe head injuries. Working Group for Neurosurgical Intensive Care of the European Society of Intensive Care Medicine. Intensive Care Med 1998; 24: 1221–5.
- Polderman KH, Tjong Tjin Joe R, Peerdeman SM, Vandertop WP, Girbes AR. Effects of therapeutic hypothermia on intracranial pressure and outcome in patients with severe head injury. Intensive Care Med 2002; 28: 1563–73.
- Raichle ME, Plum F. Hyperventilation and cerebral blood flow. Stroke 1972; 3: 566–75.
- Ranka V., Teofilovski,M., Djurovic B., Potic V.: Complications of traumatic brain injury patients during the period of early rehabilitation. Arch Phys Med Rehabil 1999; 80: 1131.
- Raoof S, Chowdhrey N, Raoof S, et al. Effect of combined kinetic therapy and percussion therapy on the resolution of atelectasis in critically ill patients. Chest 1999; 115: 1658–1666.
- Rappaport M., Hall K.M., Hopkins H.K., Belleza T., Cope D.N. Disability rating scale for severe head trauma: coma to community. Arch Phys Med Rehabil 1982; 63: 118–123.
- Robertson CS. Management of cerebral perfusion pressure after traumatic brain injury. Anesthesiology 2001; 95: 1513–7.
- Schatz P., Hillary F.G., Moelter S.T., Chute D.L.: Retrospective assessment of rehabilitation outcome after traumatic brain injury: development and utility of the functional independence level. J Head Trauma Rehabil. 2002; 17: 510–525.
- Schmoker JD, Shackford SR, Wald SL, Pietropaoli JA. An analysis of the relationship between fluid and sodium administration and intracranial pressure after head injury. J Trauma 1992; 33: 476–81.
- Shackford SR, Zhuang J, Schmoker J. Intravenous fluid tonicity: effect on intracranial pressure, cerebral blood flow, and cerebral oxygen delivery in focal brain injury. J Neurosurg 1992; 76: 91–8.
- Singer M, Vermaat J, Hall G, et al. Hemodynamic effects of manual hyperinflation in critically ill mechanically ventilated patients. Chest 1994; 106:1182–1187.
- Stiefel MF, Spiotta A, Gracias VH, et al. Reduced mortality rate in patients with severe traumatic brain injury treated with brain tissue oxygen monitoring. J Neurosurg 2005; 103: 805–11.
- Tan J. Kafa travması ve rehabilitasyonu. Özcan, O., Arpacıoğlu, O., Turan, B.: (eds). Nörorehabilitasyon. Bursa; Güneş & Nobel Tıp Kitabevi., 2000; 83-99. Hoffmann, B., von Wild, KR.: Incidence and management of complications during posttraumatic early rehabilitation. Acta Neurochir 2002; 79: 25–29. Suppl.
- Teasdale G., Bennett B. Assessment of coma and impaired consciousness: A practical scale. Lancet 1974; 2: 81–84.
- Weekers F, Giulietti AP, Michalaki M, et al. Metabolic, endocrine, and immune effects of stress hyperglycemia in a rabbit model of prolonged critical illness. Endocrinology 2003; 144: 5329–38.
- Whyte J., Hart T., Laborde A., Rosenthal M.: Rehabilitation of the patient with traumatic brain injury, En: DeLisa J.A., Gans B.M., Bockenek W.L., Currie D.M. (eds). Rehabilitation Medicine: Principles and practice. Philadelphia; Lippincott – Raven Publishers. 1998; 997–1013.
- Zafonte R.D., Hammond F.M., Mann N.R., Wood D.L.: Relationship between Glasgow coma scale and functional outcome. Am J Phys Med Rehabil 1996; 75: 364–369.
- Zafonte R.D., Wood D.L., Harrison C.L., Millis S.R.: Severe Penetrating Head Injury: A study of outcomes. Arch Phys Med Rehabil 2001; 82: 306–310.
- Zornow MH. Hypertonic saline as a safe and efficacious treatment of intracranial hypertension. J Neurosurgical Anesthesiology 1996; 8: 175–7.