Czym jest zespół po zatorowości płucnej?
Po ostrym zatorze tętnicy płucnej (pulmonary embolism, PE) nawet połowa pacjentów zgłasza uporczywe duszności i/lub ograniczenia w funkcjonowaniu, pomimo dostatecznego leczenia przeciwkrzepliwego1-6. Tzw. zespół po zatorowości płucnej (Post-PE syndrome, PPES) cechuje kombinacja nieprawidłowości w parametrach echokardiograficznych funkcji prawej komory, hemodynamice tętnicy płucnej oraz upośledzenie wymiany gazowej ze zwiększoną wentylacją przestrzeni martwej w spoczynku lub podczas ćwiczeń. Wszystko to powoduje być może przewlekła niedrożność zakrzepowa tętnic płucnych7-11. Najcięższą formą PPES jest przewlekłe zakrzepowo-zatorowe nadciśnienie płucne (chronic thromboembolic pulmonary hypertension, CTEPH). Częstość jego występowania wśród osób, które przeszły zator tętnicy płucnej, wynosi 2–4%12. Nawet jeśli ciśnienia w obrębie tętnicy płucnej w spoczynku są normalne w obecności przewlekłych wad perfuzji, stosunkowo wysoki płucny opór naczyniowy, obniżona rezerwa skurczowa prawej komory i zwiększona wentylacja przestrzeni martwej dróg oddechowych mogą stanowić przyczynę osłabiających duszności wysiłkowych. Określa się je również jako przewlekłą chorobę zakrzepowo-zatorową płuc (chronic thromboembolic pulmonary disease, CTEPD)13-16. Etiologia wyjaśniająca chroniczne dolegliwości u pacjentów bez przewlekłych wad perfuzji obejmuje chroniczne upośledzenie prawej komory, obniżenie kondycji fizycznej i/lub wcześniejsze choroby współistniejące5,17-20.
Ogólnie rzecz biorąc, PPES jest związany ze spadkiem jakości życia, bezrobociem i zwiększeniem wykorzystania zasobów opieki zdrowotnej, pomimo że ukryte fizjologiczne czynniki warunkujące są w dużej mierze nieznane19,23,24.
Dostępne jest leczenie CTEPH – najlepiej metodą endarterektomii płucnej (pulmonary endarterectomy, PEA), biorąc pod uwagę fakt, że optymalna kontrola innych form PPES nie jest dobrze ugruntowana25. Niewielkie badania wykazały obiecujące wyniki PEA lub balonowej angioplastyki tętnic płucnych (balloon pulmonary angioplasty, BPA) u pacjentów z CTEPD, ale obecnie nie jest to standard26-29. Dostępnych jest niewiele doświadczeń na temat rehabilitacji płuc u chorych z PPES. Jednak niewielkie badania sugerują jej pozytywny wpływ na zdolność do ćwiczeń i jakość życia, zarówno u pacjentów z PE30-35, jak i CTEPH36-40. W otoczeniu innych ostrych i przewlekłych zaburzeń sercowo-płucnych, np. choroby wieńcowej, przewlekłej obturacyjnej choroby płuc (POChP) czy śródmiąższowej choroby płuc, programy rehabilitacji serca i/ lub płuc są rutynowo oferowane ze względu na dowiedzioną redukcję śmiertelności sercowo-naczyniowej oraz ryzyka powikłań, jak również poprawę jakości życia, zdolności do ćwiczeń i złagodzenie objawów41,42. Postawiliśmy hipotezę, że spersonalizowany program rehabilitacji może również polepszyć stan funkcjonalny pacjentów z PPES.
W tym badaniu analizowaliśmy ukryte czynniki warunkujące przewlekłe dolegliwości u pacjentów z PPES. Naszym celem było uzyskanie wglądu w skuteczność i bezpieczeństwo ambulatoryjnego programu rehabilitacji oddechowej u chorych z PPES, w przypadku których wykluczono CTEPH i CTEPD, odpowiednie do zastosowania PEA lub BPA.
Ukryte czynniki warunkujące przewlekłe dolegliwości u pacjentów z PPES - metodologia
Projekt badania i pacjenci
To obserwacyjne badanie kohortowe stanowi opis rutynowej opieki. Prospektywnie śledziliśmy wszystkich kolejnych pacjentów z potwierdzonym w badaniach obrazowych ostrym zatorem tętnicy płucnej43,44, których skierowano do "kliniki leczenia zespołu po zatorowości tętnicy płucnej" Centrum Medycznego Uniwersytetu w Lejdzie w Holandii w okresie od maja 2017 r. do maja 2019 r.45. Najpierw w tym dedykowanym ośrodku dorosłych chorych z PE – z uporczywymi umiarkowanymi do ciężkich dusznościami (wynik według zmodyfikowanej skali Borga ≥ 3 w spoczynku) i/lub ze zgłaszanymi przez nich istotnymi ograniczeniami funkcjonowania, mimo dostatecznego leczenia przeciwkrzepliwego – przez co najmniej trzy miesiące poddano standaryzowanemu badaniu diagnostycznemu. W drugiej kolejności podgrupę, której nie leczono konkretnie z powodu CTEPH/ CTEPD i bez ukrytych chorób współistniejących, wyjaśniających ich uporczywe objawy, zapraszano do udziału w programie rehabilitacji płucnej zespołu po zatorowości tętnicy płucnej w centrum eksperckim specjalistycznej rehabilitacji medycznej (Basalt, Lejda, Holandia).
Cele badania
Głównymi celami tego badania były:
- ocena ukrytych fizjologicznych czynników warunkujących duszności wysiłkowe u wszystkich pacjentów skierowanych do naszej "kliniki leczenia zespołu po zatorowości tętnicy płucnej";
- uzyskanie wglądu w skuteczność i bezpieczeństwo programu rehabilitacji oraz jego wpływ na intensywność treningu i zgłaszane przez pacjentów oceny wyników w podgrupie, w której po standaryzowanym badaniu diagnostycznym wykluczono CTEPH i CTEPD odpowiednie do zastosowania PEA lub BPA.
Badanie ukrytych czynników warunkujących przewlekłe dolegliwości u pacjentów z PPES - procedury
Badanie diagnostyczne
Obejmowało ono:
- rutynowe badanie krwi,
- spoczynkową echokardiografię,
- angiografię płucną metodą tomografii komputerowej (computed tomography pulmonary angiography, CTPA) z odejmowanym mapowaniem perfuzji,
- krążeniowo-oddechową próbę wysiłkową przy użyciu stacjonarnego ergometru rowerowego,
- badanie czynności płuc,
- inwazyjne cewnikowanie prawego serca (right heart catheterization, RHC),
- wentylację/obrazowanie perfuzji i/lub angiografię płuc46.
Podstawowe wyniki badań omówiono w multidyscyplinarnym zespole specjalistów zajmujących się leczeniem nadciśnienia płucnego, w tym kardiologów, pulmonologów, reumatologów i ekspertów w dziedzinie medycyny naczyniowej. Pacjentów z podejrzeniem CTEPH lub CTEPD, potencjalnie odpowiednich do zastosowania PEA lub BPA, kierowano do Centrum Medycznego Wolnego Uniwersytetu w Amsterdamie (centrum eksperckiego CTEPH) na właściwe leczenie. CTEPH stwierdzano, jeśli spełniono następujące ścisłe kryteria diagnostyczne:
- ≥ 1 niedopasowany segmentalny ubytek perfuzji, wykazany przez obrazowanie wentylacji/perfuzji (V/Q) po ≥ 3 miesiącach odpowiedniej terapii przeciwzakrzepowej;
- średnie ciśnienie w tętnicy płucnej (mPAP) ≥ 25 mm Hg w spoczynku, mierzone przez RHC;
- ciśnienie zaklinowania w tętnicy płucnej (PAWP) ≤ 15 mm Hg46.
W przypadku stwierdzenia podlegającej leczeniu choroby współistniejącej, np. astmy, choroby śródmiąższowej płuc lub niewydolności lewego serca, optymalizację terapii zapewniono dzięki odpowiedniemu specjaliście z multidyscyplinarnego zespołu.
Program rehabilitacji w przypadku zespołu po zatorowości płucnej
12-tygodniowy program rehabilitacji ambulatoryjnej we wspomnianej wcześniej podgrupie oparto na oficjalnym stanowisku ATS/ERS: Kluczowe koncepcje i postępy w rehabilitacji oddechowej42. Pacjenci dwa razy w tygodniu uczestniczyli w 90-minutowych sesjach nadzorowanych ćwiczeń, a po dwóch tygodniach uzupełniono je o jeden trening bez nadzoru w domu. Podczas nadzorowanych sesji od 30 do 40 minut ćwiczyli wytrzymałościowo i 30 minut siłowo. Trening wytrzymałościowy odbywał się na stacjonarnym ergometrze rowerowym i/lub bieżni oraz obejmował ćwiczenia wytrzymałościowe i/lub interwałowe. Zgodnie z aktualnymi wytycznymi każdy trening był ukierunkowany na 70-80% indywidualnego maksymalnego tętna, które rutynowo sprawdzał nadzorujący fizjoterapeuta42,47.
Kiedy pacjenci ćwiczyli powyżej lub poniżej swoich możliwości, jeśli było to tolerowane, korygowano to przez dostosowanie obciążenia treningowego w celu osiągnięcia tętna docelowego. Trening siłowy miał na celu poprawę bezwzględnej siły mięśniowej lub wytrzymałości mięśniowej przy użyciu medycznego sprzętu fitness. Dla poprawy siły pacjenci ćwiczyli na poziomie 75% swojego maksimum jednego powtórzenia (1RM), wykonując trzy serie po osiem powtórzeń. Podczas treningu wytrzymałości mięśniowej wykonywano dwie serie po 15 powtórzeń przy 65% 1RM. Jeśli chodzi o trzeci cotygodniowy trening, odbywający się w domu, pacjentów poinstruowano, jak osiągnąć taką samą intensywność jak w przypadku nadzorowanych sesji treningowych. Dodatkowe doradztwo dostosowano do indywidualnych potrzeb, przy czym uwzględniono wsparcie psychologa, dietetyka, terapeuty zajęciowego lub pracownika socjalnego. Dotyczyło ono m.in. porad dotyczących zaprzestania palenia.
Badanie ukrytych czynników warunkujących przewlekłe dolegliwości u pacjentów z PPES - pomiary
Badanie diagnostyczne
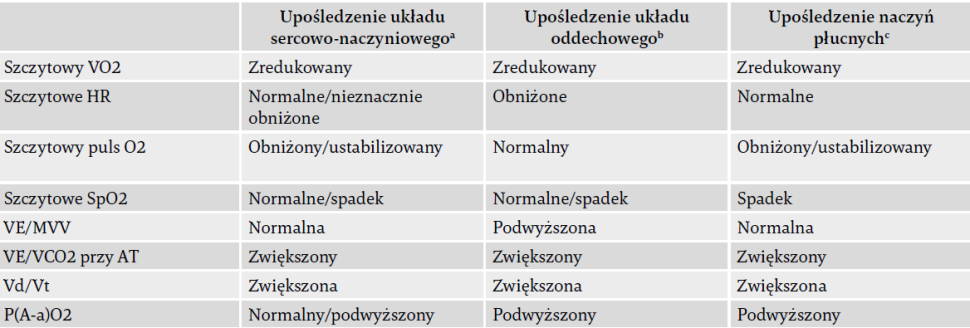
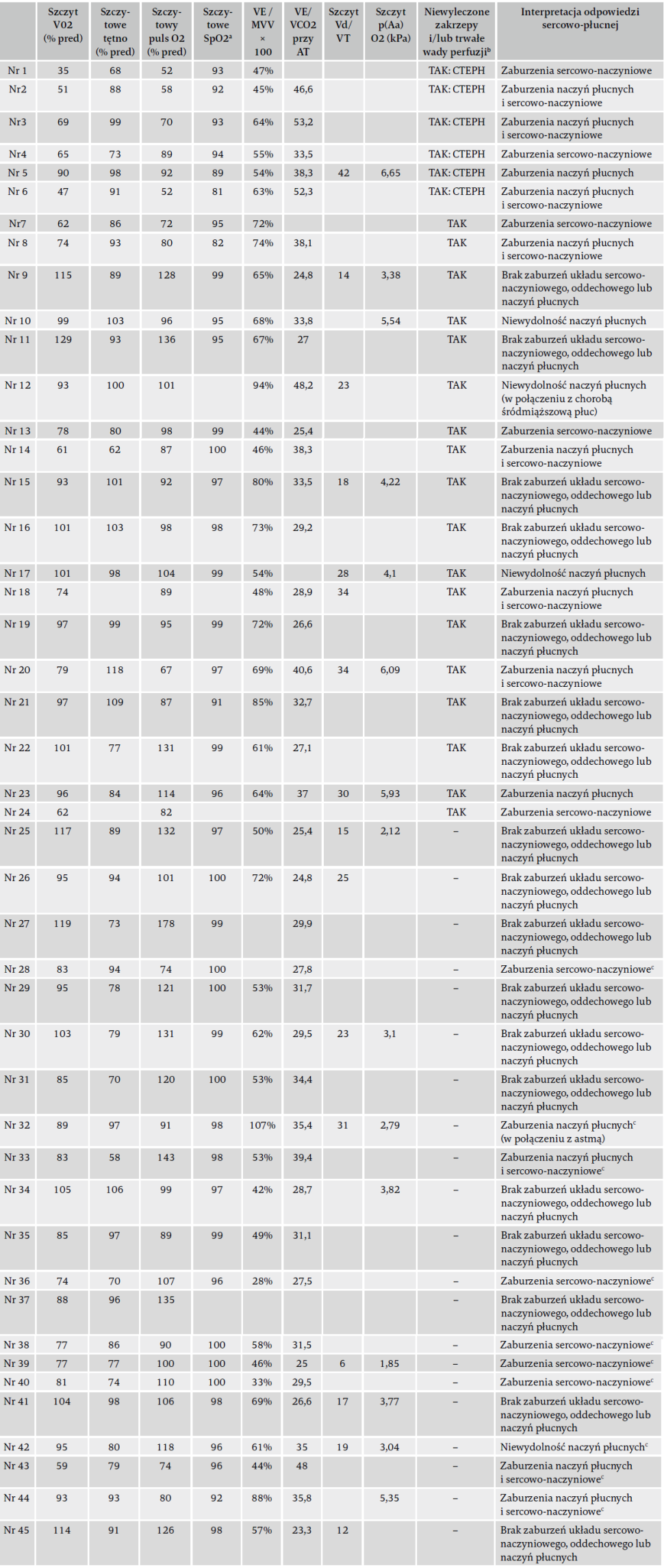
W miarę możliwości przeprowadzano ograniczony objawami narastający spiroergometryczny test wysiłkowy CPET, wraz z pobieraniem próbek krwi tętniczej. Jego poszczególne wyniki wykorzystano do oceny reakcji krążeniowo- oddechowych na wysiłek w przypadku PPES, zgodnie z oświadczeniem ATS/ACCP oraz algorytmami Wassermana, w szczególności dotyczącymi obecności wymiany gazów oddechowych, efektywności oddychania i zaburzeń wentylacji przestrzeni martwej. Typowe wzorce upośledzenia (tzn. niewystarczające wyniki) reakcji krążeniowo- oddechowych na ćwiczenia przedstawiono w tabeli 148,49. Oceny wyników dokonało dwóch niezależnych badaczy. Parametry zebrane podczas testu obejmują: pobór tlenu (VO2), tętno (heart rate, HR), wentylację minutową (minute ventilation, VE), puls O2 (VO2/HR), próg beztlenowy (anaerobic threshold, AT, określony za pomocą metody V-slope), wytwarzanie dwutlenku węgla (VCO2), poziom nasycenia tętnic tlenem, ekwiwalenty wentylacyjne dla dwutlenku węgla (VE/VCO2, punkt pomiaru przy AT), frakcję przestrzeni martwej (Vd/Vt) oraz gradient pęcherzykowo-tętniczy (p(A-a)O2). Ponieważ maksymalna wentylacja spontaniczna (maximum voluntary ventilation, MVV) nie była bezpośrednio mierzona, obliczono ją przez następujące równanie prognostyczne: FEV1 × 4050. Wszystkie parametry z wyjątkiem AT i VE/ VCO2 przy AT uzyskano podczas szczytu aktywności. Wartości odniesienia pochodzą ze stanowiska ATS/ACCP w odniesieniu do CPET49.
Badanie czynnościowe płuc obejmowało spirometrię, bodypletyzmografię oraz jednooddechową dyfuzję tlenku węgla53. Echokardiograficzne wyjaśnienia utrzymujących się duszności sklasyfikowano jako objawy nadciśnienia płucnego, dysfunkcji rozkurczowej lub skurczowej, wady zastawkowej serca i/lub kardiomiopatii. CTPA z mapowaniem perfuzji jodem przeprowadzono w celu oceny obecności pozostałości zmian zakrzepowych i/lub utrzymujących się zaburzeń perfuzji na skanerach CT, z co najmniej 64 plastrami i zrekonstruowaną grubością plastra od 1 do 3 mm.
Tabela 1. Typowe wzorce niewystarczających reakcji krążeniowo-oddechowych na ćwiczenia, przydatne w ustalaniu przyczyn ograniczenia aktywności.
Uwaga: zaczerpnięto z piśmiennictwa48,49,51,52. Maksymalne lub szczytowe reakcje sercowo-płucne z wyjątkiem VE/VCO2 przy AT.
Skróty: CPET – krążeniowo-oddechowa próba wysiłkowa; VO2 – pobór tlenu; HR – tętno; puls O2 – tlen zużywany na tętno; SpO2 – nasycenie krwi tętniczej tlenem; VE/MVV – rezerwa wentylacyjna; VE/VCO2 – ekwiwalent wentylacyjny dla dwutlenku węgla; AT – próg beztlenowy; Vd/VT – frakcja przestrzeni martwej; p(A-a)O2 – gradient pęcherzykowo-tętniczy; V/Q – wentylacja/perfuzja; CTEPH – przewlekłe zakrzepowo-zatorowe nadciśnienie płucne.
a Zaburzenie sercowo-naczyniowe odnosi się do niewydolności lewej komory, zastoinowej niewydolności serca i niedokrwienia mięśnia sercowego.
b Zaburzenie oddechowe odnosi się do choroby miąższu, w tym obturacyjnych i restrykcyjnych chorób płuc, oraz choroby płuc z upośledzeniem natlenienia obwodowego.
c Zaburzenie naczyń płucnych odnosi się do chorób ze zwiększoną wentylacją przestrzeni martwej dróg oddechowych.
Program rehabilitacji
Intensywność treningu (zdefiniowaną jako szczytowa moc wyjściowa w W) zastosowano jako surogat do pomiaru efektu rehabilitacji, ponieważ maksymalne obciążenie pracą określone przez CPET nie było dostępne w momencie wypisu. Szczytową moc wyjściową oceniano podczas pierwszej i ostatniej sesji treningowej w ramach programu rehabilitacji. Kwestionariusze samooceny dotyczące jakości życia (PEmb-QoL, PE-specific Quality of Life), zmęczenia (CIS, Checklist Individual Strength-Fatigue) oraz lęku i depresji (HADS, Hospital Anxiety and Depression Scale) wypełniano przed rozpoczęciem i po zakończeniu programu rehabilitacji54-57. Stan funkcjonalny każdego uczestnika badania przed programem rehabilitacji i po jego zakończeniu oceniało dwóch niezależnych badaczy. Przyznawali oni pacjentom oceny na skali Post-VTE Functional Status (PVFS) Scale58-60. Następnie oceniano stopień poprawy lub pogorszenia zarówno na poziomie grupowym, jak i indywidualnym.
Kwestie bezpieczeństwa ściśle monitorowano i raportowano 1) podczas konkretnej sesji treningowej (tj. omdlenie lub arytmia) lub 2) w trakcie realizacji programu rehabilitacji (tj. objawowa nawracająca zakrzepica żylna, nowa diagnoza zaburzeń sercowo-płucnych, śmierć). Dane poszczególnych pacjentów dotyczące profilu demograficznego, rozpoznania zatorowości tętnicy płucnej, chorób współistniejących, a także szczegóły na temat kontroli ambulatoryjnej, wyniki standaryzowanych badań diagnostycznych i szczegóły programu rehabilitacji wyselekcjonował z dokumentacji medycznej lekarz prowadzący.
Analiza statystyczna
Charakterystyki wyjściowe opisano jako średnią z odchyleniem standardowym (standard deviation, SD), medianę z rozstępem ćwiartkowym (interquartile range, IQR) lub – w razie potrzeby – liczby z proporcjami. Porównanie zmiennych przed rozpoczęciem i po zakończeniu programu rehabilitacji przeprowadzono za pomocą sparowanego testu t lub – w stosownych przypadkach – testu Wilcoxona dla par obserwacji. Miary ilorazu szans (odds ratio, OR) zgłaszano jako szacunki punktowe z odpowiadającymi 95% przedziałami ufności (confidence intervals, CI) (95% CI). Wszystkie testy statystyczne przeprowadzono przy użyciu oprogramowania SPSS Statistics (wersja 25.0, IBM), a wizualizację – z wykorzystaniem SankeyMATIC (http://sankeymatic.com/build/). Potwierdzone minimalne klinicznie istotne różnice w poszczególnych testach i kwestionariuszach, jeśli były dostępne, zastosowano do określenia odpowiednich wyników podczas porównywania efektów przed rozpoczęciem i po zakończeniu programu rehabilitacji61,62.
Badanie ukrytych czynników warunkujących przewlekłe dolegliwości u pacjentów z PPES - wyniki
Stan wyjściowy
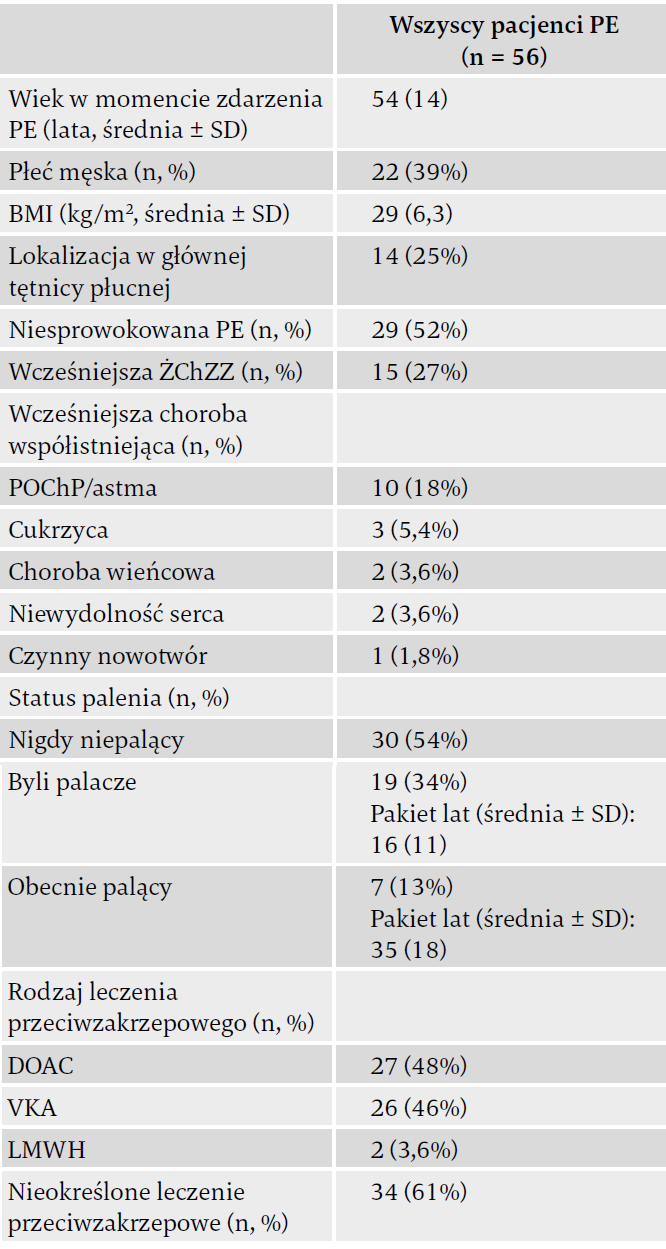
Charakterystykę wyjściową 56 pacjentów skierowanych do "kliniki leczenia zespołu po zatorowości tętnicy płucnej" po odpowiednim leczeniu przeciwzakrzepowym przedstawiono w tabeli 2. Wszystkich poddano standaryzowanemu badaniu diagnostycznemu. W całej badanej populacji reakcje krążeniowo-oddechowe oceniono u 45 pacjentów, po wykluczeniu osób z alternatywnymi diagnozami (N = 3) oraz tych, które odmówiły poddania się CPET (N = 8). Łącznie w programie rehabilitacji dostosowanym do zatorowości tętnicy płucnej uczestniczyło 27 chorych. Wykluczono 29 (CTEPH, N = 10; alternatywna diagnoza, N = 3; brak kwalifikacji, N = 3 lub brak motywacji, N = 6). W siedmiu przypadkach z powodu preferencji pacjentów rehabilitację prowadzono gdzie indziej.
Tabela 2. Charakterystyka wyjściowa pacjentów z zespołem po zatorowości płucnej poddanych standaryzowanemu badaniu diagnostycznemu.
Skróty: PE – zatorowość płucna; SD – odchylenie standardowe; BMI – wskaźnik masy ciała; ŻChZZ – żylna choroba zakrzepowo-zatorowa; POChP – przewlekła obturacyjna choroba płuc; LMWH – heparyna drobnocząsteczkowa; VKA – antagonista witaminy K; DOAC – bezpośredni doustny antykoagulant.
Badanie diagnostyczne
Mediana czasu od rozpoznania zatorowości tętnicy płucnej do skierowania wyniosła 6,4 miesiąca (IQR 4,3-31). Łącznie 16 z 56 pacjentów (29%) miało co najmniej jedną wcześniejszą chorobę współistniejącą, w tym 10 chorych (18%) – POChP/astmę, a trzech (5,4%) – cukrzycę. Po standardowej diagnostyce w całej populacji CTEPH potwierdzono przez cewnikowanie prawego serca (RHC) u 10 osób (18%). Mediana czasu między rozpoznaniem zatorowości tętnicy płucnej i CTEPH wyniosła 4,5 miesiąca (IQR 3-11). Echokardiografia ujawniła oznaki nadciśnienia płucnego u trzech innych pacjentów, u których nie stwierdzono go w inwazyjnych pomiarach przez RHC, a dysfunkcję rozkurczową zaobserwowano u dwóch. Oprócz chorych z CTEPH niewyleczone zakrzepy (według oceny CTPA) i/ lub uporczywe wady perfuzji (na podstawie obrazu V/Q) obecne były u 21 uczestników (38%), z których żaden nie był leczony za pomocą PEA lub BPA. Spośród pozostałych 25 pacjentów u trzech (5%) za podstawową etiologię przewlekłej duszności uznano niewykryte wcześniej stany chorobowe – u jednej osoby była to niedokrwistość z niedoboru żelaza, a u dwóch – śródmiąższowa choroba płuc.
Ocena odpowiedzi krążeniowo-oddechowej na wysiłek
Podczas szczytowego wysiłku spiroergometryczny test wysiłkowy CPET ujawnił medianę mocy wyjściowej na poziomie 120 W (IQR 80 do 180), ze średnim tętnem 146/ min (SD 24), a mediana częstości oddechów wynosiła 35/ min (IQR 31 do 43) (tabela 3). Średni szczytowy VO2 wyniósł 1683 ml/min (SD 785) i obniżył się (< 85% przewidywanego) u 19 z 45 pacjentów (42%). Średnia wentylacja minutowa w szczycie wysiłku osiągnęła 71 l/min (SD 27), co stanowi 61% MVV (SD 0,16). Niewyleczone zakrzepy i/lub utrzymujące się wady perfuzji były obecne u 24 z 45 pacjentów (53%), w tym u sześciu z CTEPH. Wśród 39 osób, u których nie stwierdzono CTEPH, zaburzenia naczyń płucnych albo sercowo-naczyniowe zaobserwowano podczas ćwiczeń przyrostowych u 21 osób (54%), z czego 11 pacjentów (52%) miało resztkową niedrożność naczyń (iloraz szans 1,7, 95% CI 0,48 do 6,2). Zaburzenia naczyń płucnych były wyłącznym ukrytym czynnikiem determinującym u sześciu badanych (15%), a sercowo-naczyniowe – u jednego (2,6%). Wszyscy pacjenci z CTEPH mieli objawy zaburzeń czynności naczyń płucnych lub sercowo-naczyniowych. Wykluczono miąższową chorobę płuc jako pierwotną etiologię u któregokolwiek z tych uczestników badania. Jednakże łagodne upośledzenie układu oddechowego, tj. astma i śródmiąższowa choroba płuc, częściowo przyczyniło się do nieprawidłowości w przypadku dwóch pacjentów (tabela 3).
Tabela 3. Reakcje sercowo-płucne na wysiłek fizyczny u pacjentów z zespołem po zatorowości płucnej.
Skróty: VO2 – pobór tlenu; pred – przewidywany; puls O2 – tlen zużywany na tętno; SpO2 – nasycenie krwi tętniczej tlenem; VE/MVV – rezerwa wentylacyjna; VE/VCO2 – ekwiwalent wentylacji dla dwutlenku węgla; AT – próg beztlenowy; Vd/VT – frakcja przestrzeni martwej; p(A-a)O2 – gradient pęcherzykowo-tętniczy; CTEPH – przewlekłe zakrzepowo-zatorowe nadciśnienie płucne.
a Obwodowe nasycenie tlenem wspomniano ze względu na brak gazometrii u większości pacjentów.
b Niewyleczone zakrzepy zgodnie z oceną CTPA i/lub wadami perfuzji na podstawie obrazu V/Q.
c Pacjenci z niewystarczającymi reakcjami krążeniowo-oddechowymi, określonymi za pomocą spiroergometrycznego testu wysiłkowego CPET, pomimo braku obiektywnych, utrzymujących się niedrożności naczyń w CTPA i/lub obrazie V/Q.
Program rehabilitacji
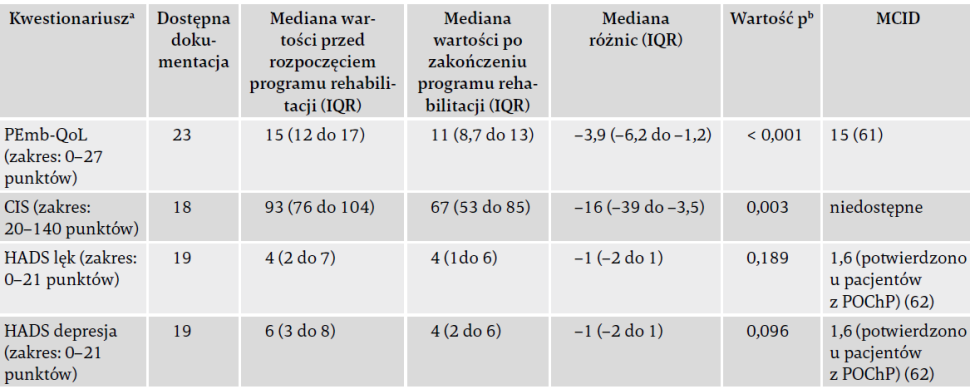
Nasz spersonalizowany 12-tygodniowy program rehabilitacji ukończyło 27 pacjentów, w tym 17 kobiet (63%), w średnim wieku 51 lat (SD 14). Na początku wynik według kwestionariusza PEmb-QoL wynosił średnio 15 punktów (IQR 12 do 17), podczas gdy mediana wyniku na skali CIS była powyżej wartości odcięcia dla problematycznego zmęczenia (≥ 76): 93 (IQR 76 do 104)63. Wyniki dotyczące niepokoju i depresji według skali HADS przekroczyły wartość odcięcia ≥ 8 punktów odpowiednio u trzech i czterech pacjentów, co wskazuje na możliwe zaburzenia lękowe lub depresyjne przed rozpoczęciem programu rehabilitacji. Mediana wyniku dla lęku wyniosła 4 punkty (IQR 2 do 7), a dla depresji – 6 (IQR 3 do 8). Nadzorowane sesje treningowe odbywały się dwa razy w tygodniu w przypadku 23 uczestników, a trzy razy w tygodniu w przypadku czterech, ponieważ u tych pacjentów wymagany był pełen nadzór podczas ćwiczeń. Dodatkowych porad udzielali: pracownik socjalny (w 24 przypadkach – 89%), dietetyk (w 19 przypadkach – 70%), terapeuta zajęciowy (w 17 przypadkach – 63%) oraz psycholog (w 15 przypadkach – 56%). Dwóch badanych (7,4%) skorzystało z doradztwa w zakresie zaprzestania palenia, z czego jeden porzucił nałóg.
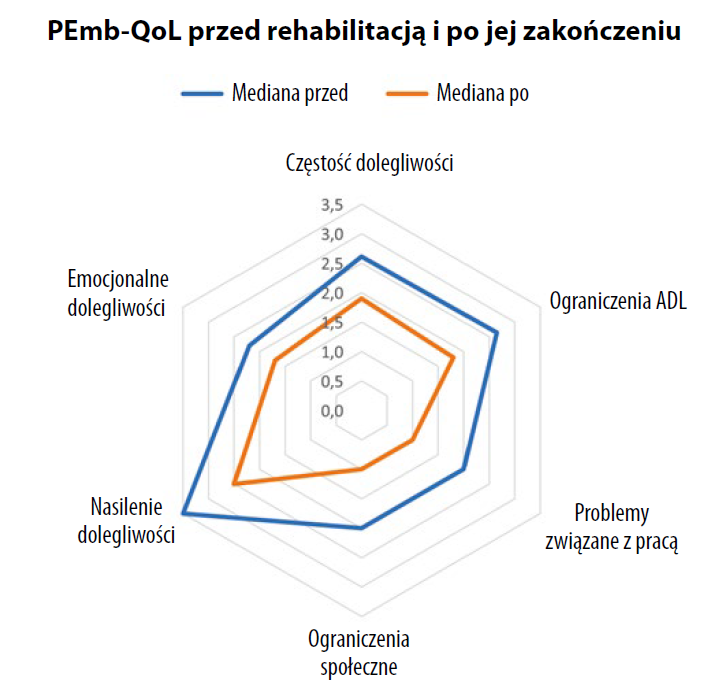
Program rehabilitacji trwał średnio 13 tygodni (IQR 11 do 16). Szczytowa moc wyjściowa podczas pierwszej sesji treningowej w porównaniu z ostatnią wynosiła średnio 65 W (IQR 40 do 90) w porównaniu z 75 W (IQR 40 do135) z medianą różnicy 20 W (IQR 5 do 40; p = 0,001). Jakość życia poprawiła się po rehabilitacji z medianą różnicy 3,9 punktu (IQR –6,2 do –1,2; p < 0,001) w łącznym wyniku kwestionariusza PEmb-QoL (tabela 4). Zmiany w jego poszczególnych wymiarach przedstawiono na ryc. 1. Zmniejszyło się obciążenie zmęczeniem z medianą różnicy 16 punktów w wyniku na skali CIS (–39 do –3,5; p = 0,003), co odzwierciedla statystycznie istotną poprawę. Zgłoszono mniejsze obciążenia w domenach lęku i depresji na skali HADS (mediana różnicy 1 punkt, IQR –2 do 1 dla każdej) bez poprawy (odpowiednio p = 0,19 i p = 0,096) (tabela 4).
Tabela 4. Wyniki zgłaszane przez pacjentów.
Skróty: IQR – rozstęp ćwiartkowy; MCID – minimalna klinicznie istotna różnica; PEmb-QoL – charakterystyczna dla zatorowości tętnicy płucnej jakość życia; CIS – Checklist Individual Strength-Fatigue; HADS – skala Hospital Anxiety and Depression Scale.
a Niższe wyniki wskazują na lepszą samoocenę jakości życia (PEmb-QoL), mniejsze zmęczenie (CIS) lub obciążenie lękiem/depresją (HADS).
b Test znakowanych rang Wilcoxona.
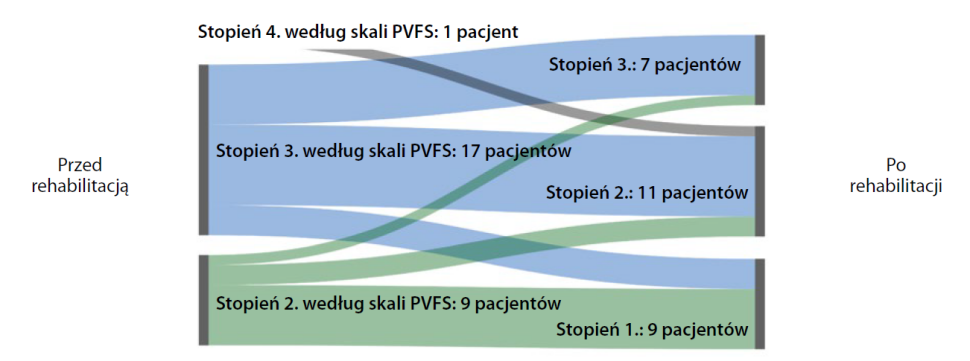
Umiarkowane lub poważne ograniczenia funkcjonowania (stopień ≥ 3 według skali PVFS) były obecne u 18 z 27 pacjentów (67%) przed rehabilitacją oraz u siedmiu na 27 (26%) w ocenie porehabilitacyjnej, co znajduje odzwierciedlenie w ogólnej poprawie według skali PVFS (p < 0,001; ryc. 2). 14 badanych (52%) poprawiło wynik o jeden stopień w skali PVFS, a czterech (15%) o dwa stopnie. Stan funkcjonalny pozostał bez zmian w przypadku ośmiu pacjentów (30%), podczas gdy u pozostałego uczestnika (3,7%) spadek wyniósł jeden stopień. Co ważne, w czasie ścisłego monitorowania bezpieczeństwa podczas programu rehabilitacji nie stwierdzono powikłań zakrzepowo-zatorowych ani kardiologicznych poza jednym badanym z nowo rozpoznanym migotaniem przedsionków.
Ryc. 1. Wykres radarowy przedstawiający zmianę we wszystkich wymiarach kwestionariusza PEmb-QoL przed rozpoczęciem i po zakończeniu programu rehabilitacji (n = 22); niższe wyniki wskazują na lepszą jakość życia.
Skróty: ADL – activities of daily living (czynności życia codziennego).
Ryc. 2. Stopnie w skali Post-VTE Functional Status (PVFS) przed rozpoczęciem i po zakończeniu 12-tygodniowego programu rehabilitacji oddechowej (n = 27).
Uwaga: szerokość linii na rysunku jest proporcjonalna do natężenia przepływu.
Ukryte czynniki warunkujące przewlekłe dolegliwości u pacjentów z PPES - dyskusja
Badanie to pokazuje, że niewystarczające reakcje krążeniowo- oddechowe na wysiłek fizyczny są powszechne wśród pacjentów cierpiących na PPES, i dotyczy to nie tylko chorych z utrzymującymi się niedrożnościami naczyń. Ograniczenia w zakresie ćwiczeń współwystępowały raczej z zaburzeniami naczyń płucnych i/lub sercowo- naczyniowymi niż z niewydolnością oddechową u wszystkich badanych z CTEPH, a także u ponad połowy osób bez CTEPH. Spersonalizowany 12-tygodniowy program rehabilitacji chorych z PPES, u których wykluczono CTEPH i CTEPD odpowiednie do zastosowania PEA lub BPA, wydawał się poprawiać intensywność treningu, charakterystyczną dla zatorowości tętnicy płucnej jakość życia, a także ograniczać zmęczenie. Nastąpiła poprawa funkcjonowania pacjentów w życiu codziennym, jak również podczas programu rehabilitacji. W trakcie programu u jednej osoby zdiagnozowano nowo rozpoznane migotanie przedsionków. Inne powikłania nie wystąpiły.
U około połowy badanych bez CTEPH stwierdzono uporczywą zakrzepicę tętnic płucnych. U żadnego z tych pacjentów nie zaobserwowano jednak wzrostu wentylacji martwej przestrzeni lub zaburzeń układu krążenia. To ilustruje niejednorodną naturę fizjologicznych czynników etiologicznych, wyjaśniających duszność wysiłkową w tej grupie.
Brak korelacji między obniżeniem wydolności wysiłkowej a obrazowaniem nieprawidłowości w naszym i poprzednich badaniach dodatkowo sugeruje wieloczynnikową etiologię, a nie chorobę tętnic płucnych jako jedyny fizjologiczny czynnik determinujący duszności po zatorze tętnicy płucnej64.
To badanie nie miało na celu identyfikacji spadku wydolności fizycznej, ponieważ brakuje jasnych kryteriów diagnostycznych w tym zakresie. Dlatego częstość jego występowania może być niedoszacowana – również dlatego, że dominujące mogą być alternatywne przyczyny ograniczenia aktywności fizycznej. Zaleca się narastający redukowany objawami spiroergometryczny test wysiłkowy CPET jako narzędzie do kompleksowej oceny reakcji układu krążenia, oddechowego i metabolizmu obwodowego w przypadku duszności wysiłkowej51,52. Tego typu nieinwazyjnego różnicowania między mechanizmami ograniczeń aktywności fizycznej można dokonać w przypadku PPES65. W kanadyjskim prospektywnym badaniu kohortowym większości pacjentów (87,5%) z nieprawidłowym wynikiem badania spiroergometrycznego (CPET) 12 miesięcy po pierwszym epizodzie zatorowości tętnicy płucnej dotyczył spadek wydolności fizycznej, 12,5% sklasyfikowano jako osoby z zaburzeniami oddychania, a u żadnego nie stwierdzono zaburzeń sercowo-naczyniowych19,20. Warto zauważyć, że była to niewyselekcjonowana populacja z zatorowością tętnicy płucnej, z osobami o stosunkowo niskim ryzyku zatoru tętnicy płucnej. Niedawne badanie obserwacyjne z udziałem 40 pacjentów z PPES wykazało wzrost wentylacji martwej przestrzeni i/lub spadek rezerwy pojemności wyrzutowej serca do 65% po 90 dniach leczenia przeciwzakrzepowego66. Co ważne, biorąc pod uwagę brak jednoznacznych klinicznych algorytmów interpretacji reakcji krążeniowo-oddechowych na wysiłek fizyczny, niektóre fenotypy nietolerancji treningowej nakładają się na siebie. W związku z tym spiroergometryczny test wysiłkowy CPET funkcjonuje głównie jako pierwszy sposób identyfikacji wzorców, a nie wyraźne rozróżnienie między różnymi przyczynami.
Biorąc pod uwagę nasze wyniki, twierdzimy, że rehabilitacja to bezpieczna i obiecująca metoda, cenna głównie w populacji odpowiednio dobranych pacjentów z zatorowością tętnicy płucnej, cierpiących na uporczywe duszności.
Podsyca to ostatnie randomizowane badanie, w którym ośmiotygodniowy domowy program ćwiczeń wdrożono wkrótce po ostrym zatorze tętnicy płucnej, niezależnie od objawów lub wcześniejszej sprawności fizycznej31. Chociaż udowodniono bezpieczeństwo tego prowadzonego przez fizjoterapeutę programu, określone wcześniej kryteria skuteczności nie zostały spełnione. Trwające obecnie randomizowane badanie ocenia, czy program rehabilitacji poprawia zdolność do wysiłku fizycznego u pacjentów z PPES (NCT03405480). Ćwiczenia teoretycznie mogą również przyczynić się do polepszenia funkcjonowania chorych z PPES leczonych chirurgicznie, z zastosowaniem angioplastyki lub terapii ukierunkowanej na nadciśnienie płucne. Aby określić kryteria odpowiedniej selekcji konkretnych pacjentów z zatorowością tętnicy płucnej, którzy prawdopodobnie najbardziej skorzystają na programie rehabilitacji, potrzebne są dalsze randomizowane badania.
Do mocnych stron naszego badania należą: standaryzowana diagnostyka w przypadku wszystkich pacjentów, w tym obrazowanie perfuzji płucnej, spiroergometryczny test wysiłkowy CPET i echokardiografia u wszystkich badanych, jak również zastosowanie najnowocześniejszego programu rehabilitacji pod nadzorem42. Jego ograniczenia obejmują: stosunkowo małą wielkość próby, jednoośrodkowość i prawdopodobną tendencyjność w doborze uczestników, prowadzącą do zwiększonej częstości występowania CTEPH w populacji badanych – ze względu na skierowanie z innego miejsca do naszej unikalnej "kliniki leczenia zespołu po zatorowości tętnicy płucnej". Dlatego stosunek CTEPH vs. CTEPD jest prawdopodobnie niereprezentatywny. Co więcej, ponieważ angiografię płucną wykonano tylko w przypadku podejrzenia CTEPH, czyli u pacjentów ze średnim lub wysokim prawdopodobieństwem występowania CTEPH na podstawie echokardiografii, nie możemy stwierdzić z całkowitą pewnością, że żaden z pozostałych badanych z utrzymującymi się wadami perfuzji faktycznie nie miał CTEPH. Również obserwacyjny charakter naszego badania – bez grupy kontrolnej – utrudnia rzetelne określenie ilościowe pełnego efektu programu rehabilitacji w porównaniu ze standardowym powrotem do zdrowia. Co ciekawe, większość badanych pacjentów korzystała również z innych rodzajów pokrewnej opieki zdrowotnej, które mogły przyczynić się do poprawy ich funkcjonowania, jakości życia i redukcji zmęczenia.
Jednak poprzednie badania prospektywne wykazały ograniczoną poprawę naturalnego przebiegu ostrej zatorowości tętnicy płucnej, zwłaszcza w przypadku braku wdrożenia programu rehabilitacji. Na przykład niedawne niemieckie badanie kohortowe z udziałem 620 pacjentów z zatorowością płucną wykazało, że jakość życia według wyniku kwestionariusza PEmb-QoL poprawiła się między 3. a 12. miesiącem obserwacji, ale minimalną istotną klinicznie różnicę w wysokości 15 punktów osiągnięto tylko u 118 osób (19%)67. Warto zauważyć, że wynik ten uzyskano w małej, wybranej kohorcie 82 badanych, co mogło ograniczyć możliwość uogólnienia61. Wreszcie znane są ograniczenia schematu postępowania przed badaniem i po jego zakończeniu. Obejmują one brak wyraźnego związku przyczynowego interwencji z zaobserwowanymi zmianami, również z powodu nieoczekiwanych modyfikacji czasowych, regresję do średniej, poczucie zagrożenia w związku z testowaniem i niespecyficzne skutki interwencji.
Podsumowując, niewystarczające reakcje krążeniowo- -oddechowe na ćwiczenia wydają się odgrywać ważną rolę w etiologii duszności wysiłkowej i ograniczeń funkcjonowania po ostrym zatorze tętnicy płucnej i były one niezależne od uporczywych wad perfuzji w badanej kohorcie. Nasze dane sugerują, że spersonalizowany program rehabilitacji oddechowej, oferowany chorym z PPES nieleczonym inaczej, jest bezpieczny i obiecujący, biorąc pod uwagę zaobserwowaną poprawę wyników istotnych dla pacjenta. Niezbędne są jednak randomizowane badania w celu potwierdzenia naszych ustaleń i dalszego ustalenia, które osoby z PPES odnoszą największe korzyści z rehabilitacji.
Źródło: Thrombosis Research 206 (2021) 66–75; doi. org/10.1016/j.thromres.2021.08.012. ©2021 The Autors. Na podstawie licencji Creative Commons 4.0 BY (http://creativecommons.org/licenses/by/4.0/)
- A.K. Sista, L.E. Miller, S.R. Kahn, J.A. Kline, Persistent right ventricular dysfunction, functional capacity limitation, exercise intolerance, and quality of life impairment following pulmonary embolism: systematic review with meta-analysis, Vasc. Med. 22 (1) (2017) 37–43.
- F.A. Klok, S. Barco, Follow-up after acute pulmonary embolism, Hamostaseologie 38 (1) (2018) 22–32.
- M. Delcroix, A. Torbicki, D. Gopalan, O. Sitbon, F.A. Klok, I. Lang et al., ERS statement on chronic thromboembolic pulmonary hypertension, Eur. Respir. J. 57 (6) (2021).
- G.J.A.M. Boon, H.J. Bogaard, F.A. Klok, Essential aspects of the follow-up after acute pulmonary embolism: an illustrated review, Res. Pract. Thromb. Haemost. 4 (6) (2020) 958–968.
- F.A. Klok, K.W. van Kralingen, A.P. van Dijk, F.H. Heyning, H.W. Vliegen, M. V. Huisman, Prevalence and potential determinants of exertional dyspnea after acute pulmonary embolism, Respir. Med. 104 (11) (2010) 1744–1749.
- M.V. Huisman, S. Barco, S.C. Cannegieter, G. Le Gal, S.V. Konstantinides, P. H. Reitsma, et al., Pulmonary embolism, Nat. Rev. Dis. Primers. 4 (2018) 18028.
- F.A. Klok, T. van der Hulle, P.L. den Exter, M. Lankeit, M.V. Huisman, S. Konstantinides, The post-PE syndrome: a new concept for chronic complications of pulmonary embolism, Blood Rev. 28 (6) (2014) 221–226.
- A.K. Sista, F.A. Klok, Late outcomes of pulmonary embolism: the post-PE syndrome, Thromb. Res. 164 (2018) 157–162.
- M. Tavoly, H.S. Wik, P.A. Sirnes, L.P. Jelsness-Jorgensen, J.P. Ghanima, F.A. Klok et al., The impact of post-pulmonary embolism syndrome and its possible determinants, Thromb. Res. 171 (2018) 84–91.
- T. Fernandes, B. Planquette, O. Sanchez, T. Morris, From acute to chronic thromboembolic disease, Ann. Am. Thorac. Soc. 13 (Suppl 3) (2016) S207–S214.
- G.J.A.M. Boon, M.V. Huisman, F.A. Klok, Determinants and management of the post-pulmonary embolism syndrome, Semin. Respir. Crit. Care Med. 42 (2) (2021) 299–307.
- Y.M. Ende-Verhaar, S.C. Cannegieter, A. Vonk Noordegraaf, M. Delcroix, P. Pruszczyk, A.T. Mairuhu, et al., Incidence of chronic thromboembolic pulmonary hypertension after acute pulmonary embolism: a contemporary view of the published literature, Eur. Respir. J. 49 (2) (2017) 1601792.
- S.C. Pugliese, S.M. Kawut, The post-pulmonary embolism syndrome: real or Ruse? Annals of the American Thoracic Society. 16 (7) (2019) 811–814.
- F.A. Klok, M. Delcroix, H.J. Bogaard, Chronic thromboembolic pulmonary hypertension from the perspective of patients with pulmonary embolism, J. Thromb. Haemost. 16 (6) (2018) 1040–1051.
- M. Held, P. Kolb, M. Grun, B. Jany, G. Hubner, A. Grgic, et al., Functional characterization of patients with chronic thromboembolic disease, Respiration 91 (6) (2016) 503–509.
- M. Claeys, G. Claessen, A. La Gerche, T. Petit, C. Belge, B. Meyns, et al., Impaired cardiac reserve and abnormal vascular load limit exercise capacity in chronic thromboembolic disease, J. Am. Coll. Cardiol. Img. 12 (8 Pt 1) (2019) 1444–1456.
- B.G. Stevinson, J. Hernandez-Nino, G. Rose, J.A. Kline, Echocardiographic and functional cardiopulmonary problems 6 months after first-time pulmonary embolism in previously healthy patients, Eur. Heart J. 28 (20) (2007) 2517–2524.
- J.A. Kline, M.T. Steuerwald, M.R. Marchick, J. Hernandez-Nino, G.A. Rose, Prospective evaluation of right ventricular function and functional status 6 months after acute submassive pulmonary embolism: frequency of persistent or subsequent elevation in estimated pulmonary artery pressure, Chest 136 (5) (2009) 1202–1210.
- S.R. Kahn, A. Akaberi, J.T. Granton, D.R. Anderson, P.S. Wells, M.A. Rodger, et al., Quality of life, dyspnea, and functional exercise capacity following a first episode of pulmonary embolism: results of the ELOPE cohort study, Am. J. Med. 130 (8) (2017) 990.
- S.R. Kahn, A.M. Hirsch, A. Akaberi, P. Hernandez, D.R. Anderson, P.S. Wells, et al., Functional and exercise limitations after a first episode of pulmonary embolism: results of the ELOPE prospective cohort study, Chest 151 (5) (2017) 1058–1068.
- R. Hunter, S. Noble, S. Lewis, P. Bennett, Long-term psychosocial impact of venous thromboembolism: a qualitative study in the community, BMJ Open 9 (2) (2019), e024805.
- I. Kirchberger, S. Ruile, J. Linseisen, S. Haberl, C. Meisinger, T.M. Berghaus, The lived experience with pulmonary embolism: a qualitative study using focus groups, Respir. Med. 167 (2020), 105978.
- F.A. Klok, F. Couturaud, M. Delcroix, M. Humbert, Diagnosis of chronic thromboembolic pulmonary hypertension after acute pulmonary embolism, Eur. Respir. J. 55 (2020) 2000189.
- F.A. Klok, K.W. van Kralingen, A.P. van Dijk, F.H. Heyning, H.W. Vliegen, A. A. Kaptein, et al., Quality of life in long-term survivors of acute pulmonary embolism, Chest 138 (6) (2010) 1432–1440.
- N. Galie, M. Humbert, J.L. Vachiery, S. Gibbs, I. Lang, A. Torbicki, et al., 2015 ESC/ ERS guidelines for the diagnosis and treatment of pulmonary hypertension: the joint task force for the diagnosis and treatment of pulmonary hypertension of the european Society of Cardiology (ESC) and the European Respiratory Society (ERS): endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT), Eur. Heart J. 37 (1) (2016) 67–119.
- T. Inami, M. Kataoka, H. Kikuchi, A. Goda, T. Satoh, Balloon pulmonary angioplasty for symptomatic chronic thromboembolic disease without pulmonary hypertension at rest, Int. J. Cardiol. 289 (2019) 116–118.
- C.B. Wiedenroth, K.M. Olsson, S. Guth, A. Breithecker, M. Haas, J.C. Kamp, et al., Balloon pulmonary angioplasty for inoperable patients with chronic thromboembolic disease, Pulm. Circ. 8 (1) (2018) 1–6.
- S. Olgun Yildizeli, A. Kepez, S. Tas, M. Yanartas, A.F. Durusoy, A. Erkilinc, et al., Pulmonary endarterectomy for patients with chronic thromboembolic disease, Anatol. J. Cardiol. 19 (4) (2018) 273–278.
- D. Taboada, J. Pepke-Zaba, D.P. Jenkins, M. Berman, C.M. Treacy, J.E. Cannon, et al., Outcome of pulmonary endarterectomy in symptomatic chronic thromboembolic disease, Eur. Respir. J. 44 (6) (2014) 1635–1645.
- R.S. Cires-Drouet, M. Mayorga-Carlin, S. Toursavadkohi, R. White, E. Redding, F. Durham, et al., Safety of exercise therapy after acute pulmonary embolism, Phlebology 35 (10) (2020) 832–842.
- N. Rolving, B.C. Brocki, J.R. Bloch-Nielsen, T.B. Larsen, F.L. Jensen, H. R. Mikkelsen, et al., Effect of a physiotherapist-guided home-based exercise intervention on physical capacity and patient-reported outcomes among patients with acute pulmonary embolism: a randomized clinical trial, JAMA Netw. Open 3 (2) (2020), e200064.
- S. Nopp, F.A. Klok, F. Moik, M. Petrovic, I. Derka, C. Ay, et al., Outpatient pulmonary rehabilitation in patients with persisting symptoms after pulmonary embolism, J. Clin. Med. 9 (6) (2020).
- M. Amoury, F. Noack, K. Kleeberg, D. Stoevesandt, B. Lehnigk, S. Bethge, et al., Prognosis of patients with pulmonary embolism after rehabilitation, Vasc. Health Risk Manag. 14 (2018) 183–187.
- F. Noack, B. Schmidt, M. Amoury, D. Stoevesandt, S. Gielen, B. Pflaumbaum, et al., Feasibility and safety of rehabilitation after venous thromboembolism, Vasc. Health Risk Manag. 11 (2015) 397–401.
- S.G. Lakoski, P.D. Savage, A.M. Berkman, L. Penalosa, A. Crocker, P.A. Ades, et al., The safety and efficacy of early-initiation exercise training after acute venous thromboembolism: a randomized clinical trial, .Thromb. Haemost. 13 (7) (2015) 1238–1244.
- C. Nagel, M. Nasereddin, N. Benjamin, B. Egenlauf, S. Harutyunova, C. A. Eichstaedt, et al., Supervised exercise training in patients with chronic thromboembolic pulmonary hypertension as early follow-up treatment after pulmonary endarterectomy: a prospective cohort study, Respiration 99 (7) (2020) 577–588.
- E. Grunig, C. Eichstaedt, J.A. Barbera, N. Benjamin, I. Blanco, E. Bossone, et al., ERS statement on exercise training and rehabilitation in patients with severe chronic pulmonary hypertension, Eur. Respir. J. 53 (2) (2019) 1800332.
- T. Koudstaal, M. Wapenaar, D. van Ranst, R. Beesems, L. van den Toorn, A. van den Bosch, et al., The effects of a 10-wk outpatient pulmonary rehabilitation program on exercise performance, muscle strength, soluble biomarkers, and quality of life in patients with pulmonary hypertension, J. Cardiopulm. Rehabil. Prev. 39 (6) (2019) 397–402.
- N.R. Morris, F.D. Kermeen, A.E. Holland, Exercise-based rehabilitation programmes for pulmonary hypertension, Cochrane Database Syst. Rev. (1) (2017), CD011285.
- N. Ehlken, M. Lichtblau, H. Klose, J. Weidenhammer, C. Fischer, R. Nechwatal, et al., Exercise training improves peak oxygen consumption and haemodynamics in patients with severe pulmonary arterial hypertension and inoperable chronic thrombo-embolic pulmonary hypertension: a prospective, randomized, controlled trial, Eur. Heart J. 37 (1) (2016) 35–44.
- Task Force Members, G. Montalescot, U. Sechtem, S. Achenbach, F. Andreotti, C. Arden, et al., 2013 ESC guidelines on the management of stable coronary artery disease: the task force on the management of stable coronary artery disease of the European Society of Cardiology, Eur. Heart J. 34 (38) (2013) 2949–3003.
- M.A. Spruit, S.J. Singh, C. Garvey, R. ZuWallack, L. Nici, C. Rochester, et al., An official American Thoracic Society/European Respiratory Society statement: key concepts and advances in pulmonary rehabilitation, Am. J. Respir. Crit. Care Med. 188 (8) (2013) e13–e64.
- M.V. Huisman, F.A. Klok, How I diagnose acute pulmonary embolism, Blood 121 (22) (2013) 4443–4448.
- M.V. Huisman, F.A. Klok, Diagnostic management of clinically suspected acute pulmonary embolism, J. Thromb. Haemost. 7 (Suppl 1) (2009) 312–317.
- M.V. Huisman, F.A. Klok, Diagnostic management of acute deep vein thrombosis and pulmonary embolism, J. Thromb. Haemost. 11 (3) (2013) 412–422.
- N. Galie, M. Humbert, J.L. Vachiery, S. Gibbs, I. Lang, A. Torbicki, et al., 2015 ESC/ ERS guidelines for the diagnosis and treatment of pulmonary hypertension, Eur. Heart J. 69 (2) (2016) 177.
- American College of Sports Medicine, D. Riebe, J.K. Ehrman, G. Liguori, M. Magal, ACSM’s Guidelines for Exercise Testing and Prescription, LWW, 2018.
- K. Wasserman, Principles of Exercise Testing and Interpretation: Including Pathophysiology and Clinical Applications, 5th ed., Wolters Kluwer Health/ Lippincott Williams & Wilkins, Philadelphia, 2012.
- American Thoracic Society, American College of Chest Physicians, ATS/ACCP Statement on cardiopulmonary exercise testing, Am. J. Respir. Crit. Care Med. 167 (2) (2003) 211–277.
- S.C. Campbell, A comparison of the maximum voluntary ventilation with the forced expiratory volume in one second: an assessment of subject cooperation, J. Occup. Med. 24 (7) (1982) 531–533.
- T. Radtke, S. Crook, G. Kaltsakas, Z. Louvaris, D. Berton, D.S. Urquhart, et al., ERS statement on standardisation of cardiopulmonary exercise testing in chronic lung diseases, Eur. Respir. Rev. 28 (154) (2019) 180101.
- A.H. Herdy, L.E. Ritt, R. Stein, C.G. Araujo, M. Milani, R.S. Meneghelo, et al., Cardiopulmonary exercise test: background, applicability and interpretation, Arq. Bras. Cardiol. 107 (5) (2016) 467–481.
- B.L. Graham, V. Brusasco, F. Burgos, B.G. Cooper, R. Jensen, A. Kendrick, et al., 2017 ERS/ATS standards for single-breath carbon monoxide uptake in the lung, Eur. Respir. J. 49 (1) (2017) 1600016.
- D.M. Cohn, E.A. Nelis, L.A. Busweiler, A.A. Kaptein, S. Middeldorp, Quality of life after pulmonary embolism: the development of the PEmb-QoL questionnaire, J. Thromb. Haemost. 7 (6) (2009) 1044–1046.
- F.A. Klok, D.M. Cohn, S. Middeldorp, M. Scharloo, H.R. Buller, K.W. van Kralingen, et al., Quality of life after pulmonary embolism: validation of the PEmb-QoL questionnaire, J. Thromb. Haemost. 8 (3) (2010) 523–532.
- J.H. Vercoulen, C.M. Swanink, J.F. Fennis, J.M. Galama, J.W. van der Meer, G. Bleijenberg, Dimensional assessment of chronic fatigue syndrome, J. Psychosom. Res. 38 (5) (1994) 383–392.
- R.P. Snaith, The hospital anxiety and depression scale, Health Qual. Life Outcomes 1 (2003) 29.
- F.A. Klok, S. Barco, B. Siegerink, Measuring functional limitations after venous thromboembolism: a call to action, Thromb. Res. 178 (2019) 59–62.
- G.J.A.M. Boon, S. Barco, L. Bertoletti, W. Ghanima, M.V. Huisman, S.R. Kahn, et al., Measuring functional limitations after venous thromboembolism: optimization of the post-VTE functional status (PVFS) scale, Thromb. Res. 190 (2020) 45–51.
- F.V.C. Machado, R. Meys, J.M. Delbressine, A.W. Vaes, Y.M.J. Go¨ertz, M. van Herck, et al., Construct validity of the post-COVID-19 functional status scale in adult subjects with COVID-19, Health Qual. Life Outcomes 19 (1) (2021) 40.
- A. Akaberi, F.A. Klok, D.M. Cohn, A. Hirsch, J. Granton, S.R. Kahn, Determining the minimal clinically important difference for the PEmbQoL questionnaire, a measure of pulmonary embolism-specific quality of life, J. Thromb. Haemost. 16 (12) (2018) 2454–2461.
- M.A. Puhan, M. Frey, S. Büchi, H.J. Schünemann, The minimal important difference of the hospital anxiety and depression scale in patients with chronic obstructive pulmonary disease, Health Qual. Life Outcomes 6 (1) (2008) 46.
- J. De Vries, H.J. Michielsen, G.L. van Heck, Assessment of fatigue among working people: a comparison of six questionnaires, Occup. Environ. Med. 60 (Suppl 1) (2003), i10-5.
- M.S. Albaghdadi, D.M. Dudzinski, N. Giordano, C. Kabrhel, B. Ghoshhajra, M. R. Jaff, et al., Cardiopulmonary exercise testing in patients following massive and submassive pulmonary embolism, J. Am. Heart Assoc. 7 (5) (2018) e006841.
- M. Guazzi, V. Adams, V. Conraads, M. Halle, A. Mezzani, L. Vanhees, et al., EACPR/AHA scientific statement. clinical recommendations for cardiopulmonary exercise testing data assessment in specific patient populations, Circulation 126 (18) (2012) 2261–2274.
- T.M. Fernandes, M. Alotaibi, D.M. Strozza, W.W. Stringer, J. Porszasz, G.G. Faulkner, et al., Dyspnea postpulmonary embolism from physiological dead space proportion and stroke volume defects during exercise, Chest 157 (4) (2020) 936–944.
- L. Valerio, S. Barco, M. Jankowski, S. Rosenkranz, M. Lankeit, M. Held et al., Quality of life three and twelve months after acute pulmonary embolism: analysis from a prospective multicenter cohort study, Chest 159 (6) (2021) 2428–2438.