Patofizjologia i objawy choroby Parkinsona
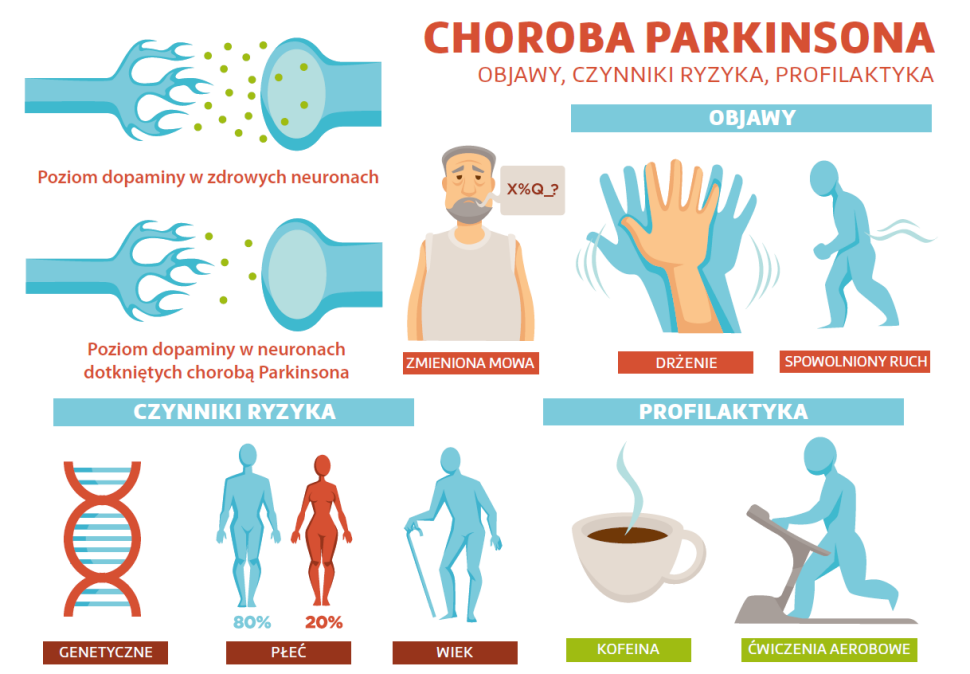
Podstawowym mechanizmem patologicznym występującym w tej chorobie jest utrata neuronów dopaminergicznych w części zbitej istoty czarnej, przez co zmniejsza się ilość dopaminy w organizmie, powodując zmniejszenie ułatwiania ruchów celowych. Jednocześnie obserwuje się obecność ciał Lewy’ego w komórkach nerwowych – początkowo w istocie czarnej, a następnie w obszarach korowych mózgu.
Pierwszego formalnego opisu choroby dokonał brytyjski lekarz James Parkinson w 1817 r., dlatego nazwa zaburzenia pochodzi od jego nazwiska. Zauważył on główne objawy motoryczne, czyli bradykinezję (spowolnienie ruchowe), sztywność mięśni i drżenie, wspomniał również o objawach umysłowych1.
Nie istnieje test w kierunku choroby Parkinsona, rozpoznanie oparte jest więc na ustaleniach klinicznych. Pierwszym kryterium jest występowanie parkinsonizmu, czyli ww. objawów motorycznych, przy czym dla postawienia diagnozy konieczne jest stwierdzenie bradykinezji połączonej z przynajmniej jednym z pozostałych dwóch objawów.
Pacjenci ze spowolnieniem ruchowym mogą mieć problemy z motoryką małą, czyli np. z zapinaniem guzików czy pisaniem. Ich mowa może brzmieć cicho i monotonnie. Ponadto rzadsze przełykanie może zwiększać ilość śliny w jamie ustnej. Bradykinezja może się także przejawiać w braku normalnej gestykulacji i ruchów ciała, zubożeniu wyrazu twarzy i mniejszej częstotliwości mrugania. Osoby chore mają charakterystyczny chód, zwany chodem parkinsonowskim – przybierają pochyloną postawę, mniej balansują kończynami górnymi (lub w ogóle tego nie robią) i poruszają się drobnymi, powolnymi, szurającymi krokami. Zdarzają im się zamrożenia chodu – nie potrafią wykonać z miejsca pierwszego kroku w przód i potrzebują wtedy pomocy opiekuna lub muszą zrobić najpierw krok w tył.
Pierwszym objawem choroby może być jednostronny ból lub sztywność, zwykle umiejscowiona w barku (która bywa pierwotnie diagnozowana jako zamrożony bark). Wyczuwa się ją podczas biernego ruchu stawu (zginanie, prostowanie i rotacja). Często najlepiej odczuwalna jest dystalnie przy nadgarstku, a w początkach choroby może uwidaczniać się jedynie przy manewrze wzmacniającym (pacjent np. podnosi i opuszcza przeciwną kończynę górną). Zwiększenie napięcia powinno być niezależne od prędkości, czasem towarzyszyć mu może wyczuwalne drżenie.
Drżenie charakterystyczne dla parkinsonizmu, czyli niekontrolowany ruch danej części ciała (np. ręki), typowo ma niską częstotliwość (4–6 Hz). Najbardziej zauważalne jest w dystalnej części kończyny. Zwykle lepiej uwidacznia się w spoczynku i zmniejsza się lub zanika podczas wykonywania czynności. Pierwotnie pojawia się po jednej stronie, ale może później objąć także drugą, choć nadal powinno pozostawać asymetryczne.
Choroba Parkinsona ogólnie jest asymetryczna, objawy parkinsonizmu powinny więc podczas badania być bardziej nasilone po jednej stronie lub zupełnie jednostronne – we wczesnym stadium choroby.
Znaczenie mają również objawy niemotoryczne. Takimi symptomami, poprzedzającymi pojawienie się parkinsonizmu nawet o kilka lat, są: depresja, zaparcia, zaburzenia powonienia i zaburzenia zachowania podczas snu REM. Do objawów niemotorycznych, które mogą dołączyć na dowolnym etapie choroby, zaliczamy także deficyty poznawcze (w funkcjach uwagi, wykonawczej, wzrokowo- przestrzennej i pamięci), objawy neuropsychiatryczne (depresję, lęki, apatię oraz psychozę) i przejawy dysfunkcji autonomicznej, takie jak częste opróżnianie pęcherza, zaparcia, niedociśnienie ortostatyczne, ślinotok, problemy z erekcją lub nadmierna potliwość.
Kryteriami wspomagającymi postawienie diagnozy w przypadku choroby Parkinsona są:
- spoczynkowe drżenie kończyny,
- utrata węchu albo odnerwienie współczulne serca, widoczne na scyntygrafii MIBG (to badanie obecnie jest rzadko przeprowadzane),
- wyraźna odpowiedź na leczenie dopaminergiczne,
- dyskinezje wywołane lewodopą.
Diagnozę choroby Parkinsona wyklucza się, jeśli stwierdzi się istnienie:
- nieprawidłowości w móżdżku,
- postępującego porażenia nadjądrowego,
- behawioralnego wariantu otępienia czołowo-skroniowego lub pierwotnej postępującej afazji w ciągu pięciu lat od początku choroby,
- ograniczenia cech parkinsonizmu do kończyn dolnych przez ponad trzy lata,
- stosowania leków hamujących przekaźnictwo dopaminergiczne (parkinsonizm polekowy – główne grupy leków mogących go wywołać to neuroleptyki, kwas walproinowy i sole litu, inhibitory zwrotnego wychwytu serotoniny, blokery receptorów dopaminergicznych i antagoniści kanału wapniowego),
- braku reakcji na duże dawki lewodopy, mimo przynajmniej umiarkowanego nasilenia objawów,
- korowych zaburzeń czucia, wyraźnej apraksji ideomotorycznej kończyn lub afazji postępującej,
- normalnego obrazu w obrazowaniu układu dopaminergicznego (przy użyciu czynnika DaTSCAN),
- diagnozy innego problemu zdrowotnego powodującego objawy parkinsonizmu2.
Choroba Parkinsona - przebieg choroby i leczenie
Istnieje wiele wariantów choroby Parkinsona o różnym przebiegu i rokowaniu. Ogólnie schorzenie to wiąże się z postępującą neurodegeneracją, powodującą nasilanie się objawów. U 9–16% pacjentów występuje zjadliwy podtyp rozsiany, z wyraźnymi wczesnymi objawami ruchowymi i niemotorycznymi, słabą odpowiedzią na leki i szybszą progresją choroby. Połowa (49–53%) pacjentów cierpi na łagodną postać choroby, z dominacją objawów ruchowych, o łagodnych symptomach, dobrej reakcji na leki dopaminergiczne oraz z wolniejszą progresją choroby. U pozostałej części pacjentów występuje wariant pośredni. Przypadki ujęte w metaanalizie badań pośmiertnych wykazały, że pacjenci przeżywali od diagnozy od 6,9 do 14,3 lat. Natomiast w australijskim badaniu wieloośrodkowym stwierdzono, że 26% pacjentów zdiagnozowanych w latach 80. żyło co najmniej 20 lat od rozpoznania parkinsona. Należy zauważyć, że bardzo często przyczyna śmierci pacjenta nie jest związana z tą chorobą – w populacji osób z parkinsonem przyczyny zgonu są podobne jak w ogólnej populacji osób w tym samym wieku. Jeśli pacjent umiera z powodów związanych z chorobą pierwotną, najczęściej jest to aspiracyjne zapalenie płuc.
Leki na objawy motoryczne mają przede wszystkim działanie dopaminergiczne. Jak czytamy w zaleceniach brytyjskiego NICE (National Institute for Health and Care Exellence) z 2017 r., we wczesnych etapach choroby lekiem pierwszoliniowym na objawy motoryczne, wpływające na jakość życia pacjenta, jest lewodopa. Jeśli objawy te nie wpływają na jakość życia, zalecane jest rozważenie zastosowania agonistów dopaminy, lewodopy lub inhibitorów oksydazy monoaminowej B.
Na późniejszym etapie choroby może dochodzić do fluktuacji, czyli wahań w stanie ruchowym pacjenta. W czasie przed podaniem kolejnej dawki leku obniża się poziom lewodopy (a tym samym także dopaminy) w organizmie i wtedy chory doświadcza pogorszenia ruchowego (stan OFF), natomiast po przyjęciu kolejnej dawki poziom lewodopy się normuje i objawy są łagodzone (stan ON). Ponadto w momentach, gdy stężenie lewodopy jest najwyższe, może dochodzić do dyskinez, czyli ruchów mimowolnych, nie do opanowania przez pacjenta. Ruchy te są płynne, przypominające ruchy taneczne (dyskineza pląsawicza). Mogą one obejmować twarz, kończyny i mięśnie tułowia. W takich przypadkach lekarz prowadzący w pierwszym rzędzie modyfikuje podawanie lewodopy. Jeśli to nie pomaga, może rozważyć dodatkowe włączenie takich leków jak agoniści dopaminy, inhibitory oksydazy monoaminowej B lub inhibitory metylotransferazy katecholowej. Jeśli takie postępowanie nie przyniesie skutku, można rozważyć zastosowanie amantadyny. Lek ten znajduje się na końcu listy, ponieważ brak było dowodów na jego skuteczność i brakowało badań nad jego bezpieczeństwem.
Warto tu nadmienić, że w tegorocznym artykule prof. Oliviera Rascola i wsp., opublikowanym w piśmie "The Lancet", czytamy o skuteczności amantadyny w leczeniu dyskinez wywołanych lewodopą i fluktuacji występujących w chorobie Parkinsona. Została ona potwierdzona randomizowanymi badaniami kontrolowanymi, przeprowadzonymi w ciągu ostatnich pięciu lat. Autorzy zaznaczają, że potrzebne są badania nad zastosowaniem tego leku również we wczesnych stadiach choroby4.
Odnośnie do objawów niemotorycznych w chorobie Parkinsona, wytyczne NICE dopuszczają stosowanie:
- modafinilu – u pacjentów cierpiących na nadmierną senność,
- klonazepamu lub melatoniny – w przypadku zaburzenia zachowania podczas snu REM,
- rotygotyny – na akinezję nocną, niereagującą na lewodopę lub agonistów dopaminy,
- midodryny – przy niedociśnieniu ortostatycznym (lub fludrokortyzonu, jeśli midodryna jest przeciwwskazana lub nieskuteczna),
- niskich dawek kwetiapiny – u pacjentów ze źle tolerowanymi objawami psychotycznymi (bez zaburzeń poznawczych) lub klozapiny, jeśli standardowe leczenie nie pomaga,
- inhibitorów cholinesterazy – przy otępieniu (lekiem drugiego wyboru jest memantyna),
- bromku glikopironiowego lub ostrzykiwań ślinianek toksyną botulinową – przy ślinotoku5.
Toksyna botulinowa w leczeniu choroby Parkinsona
Według amerykańskiego przeglądu badań z 2017 r. toksyna botulinowa znajduje w leczeniu choroby Parkinsona szersze zastosowanie niż tylko przy ślinotoku. Może ona skutecznie łagodzić również objawy dystonii szyjnej, kurczu powiek i nadaktywności pęcherza.
Coraz częściej stosowana jest też z innych wskazań związanych z parkinsonem, takich jak dystonia kończyn, dystonia ustno-żuchwowa, drżenie, zaparcia, dysfagia (zaburzenia przełykania), gastropareza (spowolnienie opróżniania żołądka) i nadmierna potliwość. Ważną cechą tej terapii jest fakt, że nie zakłóca ona leczenia preparatami dopaminergicznymi. Ponadto, dzięki wstrzykiwaniom domięśniowym lub dogruczołowym, jej efekty uboczne mają głównie charakter ograniczony miejscowo, inaczej niż przy lekach ogólnoustrojowych. Ogólnie rzecz biorąc, toksyna botulinowa może służyć jako bardzo dobre narzędzie zmniejszania objawów – zarówno ruchowych, jak i niemotorycznych – choroby Parkinsona6.
Leczenie chirurgiczne pacjentów z chorobą Parkinsona
U pacjentów, u których objawy ruchowe przestały reagować na leki lub u których występują bardzo uciążliwe efekty uboczne farmakoterapii, możliwe jest zastosowanie leczenia chirurgicznego. Najpopularniejszą obecnie metodą takiego postępowania jest głęboka stymulacja mózgu. Oprócz niej wykonuje się również procedury ablacyjne7.
Choroba Parkinsona - wytyczne odnośnie do fizjoterapii
Jako że choroba Parkinsona ma charakter postępujący, a dostępne leczenie jest wyłącznie objawowe, w poprawianiu jakości życia pacjentów dużą rolę odgrywa fizjoterapia.
Rolę tę podkreśla między innymi amerykańska The Parkinson’s Foundation. Na stronie fundacji czytamy, że dla osób z tą chorobą ważna jest zdolność do poruszania się i utrzymania aktywności, a fizjoterapia ma pomagać w zachowaniu tej zdolności jak najdłużej. Według najnowszych badań fizjoterapia – w tym trening chodu i równowagi, trening oporowy i regularne ćwiczenia – może pomóc w łagodzeniu objawów choroby.
W roku 2014 opracowane zostały "Europejskie wytyczne fizjoterapeutyczne dla choroby Parkinsona". Udział w ich przygotowaniu wzięli przedstawiciele stowarzyszeń rehabilitacyjnych i fizjoterapeutycznych z 20 krajów Europy. Podczas ich tworzenia opierano się na wnikliwej analizie dostępnej literatury przedmiotu. Poniżej podsumowujemy najważniejsze zalecenia tego dokumentu.
Celem fizjoterapii podczas pracy z osobami z chorobą Parkinsona jest "maksymalizacja jakości poruszania się, niezależności funkcjonalnej i ogólnej sprawności fizycznej oraz minimalizacja wtórnych powikłań przy jednoczesnym wspieraniu samozarządzania i uczestnictwa oraz optymizacji bezpieczeństwa" pacjentów.
Dla osiągnięcia tego celu działania mają być nakierowane na pięć głównych obszarów, którymi są: wydolność fizyczna, transfery, czynności manualne, równowaga i chód. Niegdyś wyróżniało się również obszar szósty – postawę – ale obecnie uważa się, że wchodzi ona w skład pozostałych domen. Dodatkowo istotne mogą być takie kwestie jak funkcja oddechowa i postępowanie z bólem. Niezwykle ważne jest, by cele leczenia dopasowane były do potrzeb konkretnej osoby i do stadium zaawansowania choroby.
I tak u pacjentów w stadium pierwszym według skali Hoehn-Yahra celami fizjoterapii są:
- wspieranie samozarządzania,
- zapobieganie brakowi aktywności,
- zapobieganie lękowi przed poruszaniem się lub upadkiem,
- poprawa wydolności fizycznej,
- łagodzenie bólu,
- opóźnianie pojawienia się ograniczeń aktywności.
W stadiach od 2. do 4. w skali Hoehn-Yahra dodatkowym celem fizjoterapii staje się: utrzymanie lub poprawa wykonywania czynności, zwłaszcza transferów, równowagi, czynności manualnych i chodu.
Natomiast w stadium 5. w skali Hoehn-Yahra dodatkowe cele to:
- podtrzymywanie funkcji życiowych,
- zapobieganie odleżynom i przykurczom,
- wspieranie opiekunów/pielęgniarek.
Wydolność fizyczna zmniejsza się u pacjentów z chorobą Parkinsona ze względu na ich obniżoną aktywność – szacuje się, że są oni o jedną trzecią mniej aktywni niż ich zdrowi rówieśnicy (uwaga: u pacjentów stosujących antagonistów dopaminy istnieje ryzyko kompulsywnego ćwiczenia). Z kolei niższa wydolność (np. obniżona siła mięśni) pogarsza funkcjonowanie pacjenta, i tak utrudnione przez objawy choroby.
U wielu pacjentów występuje uogólniona zmiana w postawie w kierunku fleksji, często połączonej z laterofleksją. Takie zmiany mogą prowadzić do wtórnego osłabienia mięśni, zwłaszcza prostowników pleców i karku, ale również przywodzicieli stawu barkowego, prostowników stawu biodrowego i prostowników pośladków i kończyn dolnych.
Wytyczne podkreślają, że interwencje fizjoterapeutyczne mają być dopasowane do potrzeb, motywacji, możliwości i preferencji pacjenta oraz jego opiekunów. Wpływ chorego na przebieg terapii zwiększa motywację, która jest niezwykle ważna przy tej formie leczenia. Pacjent powinien mieć możliwość dokonywania – po odpowiednim poinformowaniu – wyboru priorytetów i stosowanych interwencji. Takie postępowanie sprzyja samozarządzaniu.
Ogólnie: przy wszystkich formach fizjoterapii należy przed rozpoczęciem interwencji ustalić i omówić z pacjentem cele, które mają być konkretne, mierzalne, osiągalne, adekwatne i uzależnione od czasu (SMART – specific, measurable, attainable, relevant and time-based).
Aktywność fizyczna pacjentów z chorobą Parkinsona
Wytyczne zalecają fizjoterapeutom podejmowanie starań, by pacjenci zwiększyli poziom aktywności fizycznej i uczestniczyli w ćwiczeniach. Terapia ćwiczeniowa poprawia lub utrzymuje sprawność fizyczną, ma na celu zapobieganie powikłaniom wtórnym, a nawet może działać neuroprotekcyjnie. Ćwiczenia nakierowane są na wydolność fizyczną, równowagę, transfery i chód. Pomóc w tym może wyznaczenie, wraz z pacjentem, konkretnych celów, np. zmniejszenie czasu spędzanego codziennie na siedząco, zastąpienie jazdy samochodem na krótkich dystansach spacerem (np. do sklepu), wybieranie schodów zamiast windy, powrót do lubianego sportu, uczestniczenie w ćwiczeniach grupowych, zastosowanie domowego programu ćwiczeń, prowadzenie dzienniczka ćwiczeń, zalecenie pomocy ortopedycznych przydatnych przy ćwiczeniach. Fizjoterapeuta powinien kontrolować realizację celów przez pacjenta w odstępach czasu zależnych od potrzeb w danym przypadku.
Choroba parkinsona - fizjoterapia konwencjonalna
Fizjoterapeuta może także zapewnić pacjentowi ćwiczenia nadzorowane, które w wytycznych określane są terminem "fizjoterapia konwencjonalna". Według danych naukowych istnieją silne przesłanki, by stosować fizjoterapię konwencjonalną w celu poprawy prędkości chodu, siły mięśni (moment i ciężar; prostowniki stawu kolanowego) i funkcji ruchowych. Istnieją również dowody, choć słabsze, na poparcie stosowania fizjoterapii konwencjonalnej w celu poprawy mobilności funkcjonalnej (TUG – test "Wstań i idź") oraz równowagi (BBS – skala równowagi Berg, FR – test wychylenia w przód).
W przypadku fizjoterapii konwencjonalnej wytyczne zalecają przeprowadzanie treningu przez co najmniej osiem tygodni, trzy razy w tygodniu po 45 minut. Program ćwiczeń nadzorowanych ma być wspierany ćwiczeniami wykonywanymi samodzielnie (lub grupowo) w pozostałe dni tygodnia. Ćwiczenia mają być nakierowane na wydolność fizyczną i mobilność funkcjonalną (np. trenowanie siły prostowników stawu kolanowego i biodrowego podczas wstawania z krzesła, siły zginania stawu skokowego podczas wchodzenia po schodach, wytrzymałości podczas chodzenia w zmieniających się kierunkach). Intensywność ćwiczeń ma stopniowo wzrastać.
Trening na bieżni pacjentów z parkinsonem
Dane naukowe przemawiają silnie za stosowaniem treningu na bieżni w celu poprawy prędkości chodzenia i długości kroków oraz słabiej za jego stosowaniem w celu zwiększenia pokonywanej odległości i poprawy równowagi (BBS).
Wytyczne zalecają upewnienie się przed treningiem, czy zdolności poznawcze i fizyczne pacjenta pozwalają mu na korzystanie z bieżni w sposób bezpieczny. Wskazane jest korzystanie z uprzęży podtrzymującej pacjenta lub z systemu, który wyłącza zasilanie bieżni, jeśli pacjent znajdzie się za daleko od konsoli.
W przypadku pacjentów z zamrożeniem chodu należy zachować ostrożność zwłaszcza podczas przyspieszania i zwalniania.
Trening ma trwać co najmniej cztery tygodnie, trzy razy w tygodniu po 30 minut. Podczas treningu pacjent powinien skupiać się na stawianiu dużych kroków. Fizjoterapeuta może rozważyć dodanie poznawczego zadania podwójnego podczas utrzymywania przez pacjenta długości kroków. Pomocne może być ustawienie bieżni przed lustrem, by pacjent otrzymywał informację zwrotną o postawie. Intensywność ćwiczeń ma wzrastać stopniowo.
Taniec a choroba Parkinsona
Mocne dane naukowe przemawiają za stosowaniem tańca w celu poprawy mobilności funkcjonalnej (test TUG – tylko w przypadku tanga) i równowagi (BBS, Mini- -BESTest), a słabsze – za stosowaniem tej metody terapeutycznej w celu zwiększenia prędkości chodu, długości kroków, poprawy zamrożenia chodu, jakości życia oraz funkcji ruchowych.
Wytyczne zalecają stosowanie tańca przez co najmniej 10 tygodni, dwa razy w tygodniu po 60 minut. Taniec ma cechować się dużą amplitudą ruchu, ruszaniem z miejsca, zatrzymywaniem się i obrotami, ma obejmować stanie na jednej nodze, przenoszenie ciężaru ciała, kontrolowane przesuwanie środka ciężkości poza podstawę, chodzenie do tyłu, chodzenie w ograniczonej przestrzeni, kroczenie w wielu różnych kierunkach i skomplikowane sekwencje ruchowe. Należy pamiętać, że chodzenie do tyłu (np. w tangu) może powodować upadki, należy więc zachować ostrożność przy tego typu tańcach i dostosować je do ograniczeń typowych dla pacjentów z parkinsonem.
Tango poprawia mobilność funkcjonalną i równowagę i sprzyja zwiększaniu prędkości chodu, długości kroków, poprawie zamrożenia chodu, jakości życia oraz funkcji ruchowych.
Tai chi pomaga poprawić równowagę pacjentów z parkinsonem
Dane naukowe zdecydowanie popierają zastosowanie tai chi w celu poprawy funkcjonowania ruchowego oraz – w mniejszym stopniu – w celu zmniejszenia liczby upadków, poprawy równowagi (BBS), w tym równowagi związanej ze staniem (wysięg w przód), mobilności funkcjonalnej, siły mięśni (moment), zwiększenia prędkości chodzenia, długości kroków i pokonywanej odległości.
Trening tai chi powinien obejmować głębokie oddychanie i relaksację połączone z wolnymi, rytmicznymi ruchami. Powinien on zawierać takie elementy jak stanie na jednej nodze, przenoszenie ciężaru ciała, kontrolowane przemieszczanie środka ciężkości poza podstawę, kroczenie w wielu różnych kierunkach i złożone sekwencje ruchowe. Celować należy w dużą amplitudę ruchu.
Masaż punktów spustowych u pacjentów z chorobą Parkinsona
Dane naukowe przemawiają (słaba rekomendacja) za stosowaniem masażu punktów spustowych w celu poprawy efektu leczenia odczuwanego przez pacjenta.
Masaż punktów spustowych lub terapię neuromięśniową należy przeprowadzać przez co najmniej osiem tygodni, dwa razy w tygodniu po 45 minut. Masaż ma obejmować uciskanie punktów spustowych poprzez ślizgowe, wydłużone ruchy, wykonywane z umiarkowanym uciskiem – równolegle do włókien mięśniowych na karku, plecach i kończynach. Tę formę fizjoterapii należy zawsze łączyć z interwencjami innego rodzaju, jako że brak jest dowodów, by poprawiała ona wydolność fizyczną czy mobilność funkcjonalną.
Fizjoterapia w chorobie Parkinsona - praktyka
Ćwiczenia z czasem mają przechodzić w praktykę, która wiąże się z powtarzającym się wykonywaniem ruchów w celu poprawy płynności umiejętności motorycznych.
Praktyka przynosi korzyść osobom z chorobą Parkinsona, z tym że wymagają one większej dawki treningu niż ich zdrowi rówieśnicy. U takich pacjentów akwizycja umiejętności może być stosunkowo dobrze zachowana, natomiast mniej skuteczne są automatyzacja i retencja. Jako że potencjał uczenia się prawdopodobnie zmniejsza się wraz z postępowaniem choroby, największe korzyści z uczenia się można osiągnąć w jej wczesnych stadiach (2. i 3. według Hoehn-Yahra). Dlatego ważna jest optymalizacja nauki ruchu. Osiąga się ją poprzez: wpływ na maksymalizację motywacji pacjenta, stosowanie zadań funkcjonalnych i umiejscowionych w konkretnym kontekście (np. ćwiczenia w domu), stosowanie wielu powtórzeń, dostarczanie wizualnych lub dźwiękowych wskazówek, stopniowe zwiększanie złożoności zadań (poprzez stosowanie zadań podwójnych) i utrzymywanie równowagi między praktyką a odpoczynkiem. Pomocne może być również zastosowanie technik obserwacji działania i wyobrażania ruchowego.
Trening strategii ruchu dla pacjentów z parkinsonem
Aby skompensować deficyty wewnętrznej generalizacji zachowania, stosuje się trening strategii ruchu. Obejmuje on stosowanie wskazówek, strategie związane z uwagą oraz strategie dla złożonych sekwencji ruchowych.
Wskazówki mogą być:
- wizualne (pasy taśmy naklejone na podłodze, linia wyświetlona na podłodze),
- dźwiękowe (chodzenie do rytmu wyznaczanego przez metronom lub muzykę),
- dotykowe (chodzenie do rytmu wibracji wywoływanych przez wibrującą opaskę na nadgarstku).
Przykładami strategii związanych z uwagą mogą być: myślenie o robieniu dużych kroków, wyznaczanie sobie punktu w otoczeniu, do którego będziemy szli, robienie szerokich zakrętów (po łuku zamiast w miejscu wokół osi), podnoszenie wysoko kolan. Natomiast do strategii związanych z uwagą, które pomagają zainicjować ruch, należą: kołysanie się na boki przed pierwszym krokiem, połączenie kołysania się z myśleniem o tym, by zrobić duży krok, zrobienie kroku w tył przed pójściem do przodu, nagłe machanie ramionami przed sobą ("wskazywanie kierunku"), kołysanie tułowiem w przód i w tył przed podniesieniem się z krzesła oraz kołysanie zgiętymi kolanami przed przetoczeniem się (przy transferach w łóżku).
Jeśli chodzi o strategie dla złożonych sekwencji ruchowych, zalecane jest następujące postępowanie:
- fizjoterapeuta obserwuje pacjenta wykonującego daną czynność i analizuje komponenty czynności, które zostały ograniczone przez chorobę,
- ustala z pacjentem najbardziej optymalne komponenty ruchu i podsumowuje sekwencję komponentów,
- pokazuje pacjentowi, jak wykonywać wybrane komponenty
- prosi pacjenta, by ten na głos opisał kolejne komponenty, a następnie użył wyobrażania ruchowego dla kolejnych komponentów ruchu, by ostatecznie wykonać te komponenty ze świadomą kontrolą.
Fizjoterapia pacjentów z chorobą Parkinsona - uwagi dodatkowe
Ważne, by pracować nad wydolnością pacjenta o takiej porze dnia, kiedy jest on w najlepszej formie, natomiast nad ograniczonymi czynnościami – o takiej porze i w takim miejscu, gdzie stanowią one największą trudność dla pacjenta. Podczas planowania sesji terapeutycznych należy brać pod uwagę stan chorego wywoływany polekowymi fluktuacjami poziomu dopaminy – zwykle ograniczenia aktywności są najsilniejsze podczas stanu OFF (przed podaniem kolejnej dawki leku), natomiast największą sprawność pacjenci mają podczas stanu ON (niedługo po podaniu kolejnej dawki). Ważne jest także dostosowanie programu treningowego do deficytów psychicznych, bólu i zmęczenia pacjenta.
Fizjoterapeuta powinien także poinformować chorego, że choć odczucie zmęczenia i pocenie się podczas ćwiczeń są normalnymi zjawiskami, to należy te ćwiczenia przerwać (i zgłosić się do lekarza), jeśli pacjent doświadcza: mdłości, bólu w klatce piersiowej (dłużej niż przez kilka minut), nietypowej zadyszki (np. oddechy częstsze niż 40 na minutę), ciężkiego zmęczenia lub duszności, zawrotów głowy, odczucia nieregularnego bicia serca, bólu, zimnych potów lub obniżenia się ciśnienia skurczowego o więcej niż 10 mmHg podczas ćwiczeń8.
Skuteczność fizjoterapii w chorobie Parkinsona
Swego rodzaju uaktualnieniem wytycznych z 2014 r. była metaanaliza badań nad skutecznością fizjoterapeutycznych metod obecnie stosowanych u pacjentów z chorobą Parkinsona, przeprowadzona w 2020 r. Potwierdziła ona, że cały szereg typów interwencji poprawia stan takich chorych. Poniżej podsumowano główne obszary obserwowanych korzyści z poszczególnych rodzajów interwencji.
Korzyści z fizjoterapii u pacjentów z chorobą Parkinsona
- Terapia konwencjonalna (w tej kategorii umieszczono wszelkie tradycyjne interwencje oparte na ćwiczeniach oraz przezczaszkową stymulację prądem stałym)
- Obszary obserwowanych korzyści: Objawy motoryczne, chód i jakość życia
- Metodologiczna jakość dowodów: Umiarkowana do wysokiej
- Trening na bieżni
- Obszary obserwowanych korzyści: Chód
- Metodologiczna jakość dowodów: Umiarkowana
- Treningi oparte na strategii (w tym stosowanie wskazówek)
- Obszary obserwowanych korzyści: Chód
- Metodologiczna jakość dowodów: Niska do umiarkowanej
- Taniec
- Obszary obserwowanych korzyści: Objawy motoryczne, równowaga i chód
- Metodologiczna jakość dowodów: Niska do umiarkowanej
- Sztuki walki (tai chi i qigong)
- Obszary obserwowanych korzyści: Objawy motoryczne, równowaga i chód
- Metodologiczna jakość dowodów: Umiarkowana
- Nordic walking
- Obszary obserwowanych korzyści: Objawy motoryczne, równowaga i chód
- Metodologiczna jakość dowodów: Niska do umiarkowanej
- Trening oporowy
- Obszary obserwowanych korzyści: 6-minutowy test marszowy
- Metodologiczna jakość dowodów: Umiarkowana do wysokiej
- Ćwiczenia aerobowe
- Obszary obserwowanych korzyści: Objawy motoryczne, równowaga i chód
- Metodologiczna jakość dowodów: Niska do umiarkowanej
- Trening równowagi i chodu
- Obszary obserwowanych korzyści: Objawy motoryczne, równowaga i chód
- Metodologiczna jakość dowodów: Umiarkowana do wysokiej
- Hydroterapia
- Obszary obserwowanych korzyści: TUG (test "Wstań i idź"), lęk przed upadkiem
- Metodologiczna jakość dowodów: Niska do umiarkowanej
- Exergaming (gry wideo wymagające wysiłku fizycznego)
- Obszary obserwowanych korzyści: TUG, BBS i kwestionariusz Parkinson’s Disease Questionaire-39
- Metodologiczna jakość dowodów: Niska do umiarkowanej
- Zadania podwójne
- Obszary obserwowanych korzyści: Brak korzystnego wpływu
- Metodologiczna jakość dowodów: Niska do umiarkowanej
Ogólnie rzecz biorąc autorzy przeglądu stwierdzają, że fizjoterapia prowadzi do znaczącej poprawy wyników9.
Warto nadmienić, że początkowo udowodniono krótkoterminową skuteczność fizjoterapii u osób z chorobą Parkinsona, jak wskazuje np. przegląd systematyczny z 2012 r., przeprowadzony przez Claire L. Tomlinson i wsp.10. Później potwierdzono również jej długoterminową efektywność – w przeglądzie autorstwa Margaret K. Mak i wsp. czytamy, że dowody wskazują, iż co najmniej 4-tygodniowy trening chodu lub 8-tygodniowy trening równowagi mogą dawać korzystny efekt utrzymujący się przez 3-12 miesięcy po zakończeniu leczenia. Długotrwałe działanie zaobserwowano również przy interwencjach treningu siłowego, treningu aerobowego, tai chi lub tańca – prowadzonych przez co najmniej 12 tygodni11.
Uaktualniony program ćwiczeń dla pacjentów z parkinsonem
W maju tego roku amerykańska The Parkinson’s Foundation opublikowała nowe zalecenia odnośnie do ćwiczeń, opracowane we współpracy z American College of Sports Medicine. Wytyczne te instruują, jak zapewnić pacjentom bezpieczne i skuteczne ćwiczenia. Główne zalecenia obejmują wizytę u fizjoterapeuty specjalizującego się w leczeniu parkinsona, który dokona ewaluacji funkcjonalnej i zaleci ćwiczenia. Należy pamiętać, by ćwiczenia, przeprowadzane co najmniej przez 150 minut tygodniowo, o intensywności umiarkowanej do wysokiej, wykonywać wyłącznie podczas okresów ON, gdy działają leki. Jest to ilość ćwiczeń niezbędna do poprawiania jakości życia.
Rodzaje ćwiczeń dla pacjentów z chorobą Parkinsona:
- aktywność aerobowa ma być prowadzona 3 razy w tygodniu po co najmniej 30 minut,
- trening siłowy ma być wykonywany 2-3 razy w tygodniu (w dni oddzielone od siebie) po co najmniej 30 minut i ma zawierać 10-15 powtórzeń dla głównych grup mięśniowych,
- trening równowagi, sprawności i wielozadaniowości ma się odbywać 2-3 razy w tygodniu, z codzienną integracją, jeśli jest to możliwe,
- rozciąganie należy wykonywać 2-3 razy22 .
Choroba Parkinsona - metody fizykoterapeutyczne
W 2021 r. przeprowadzono systematyczny przegląd badań nad przezczaszkową stymulacją prądem stałym w leczeniu choroby Parkinsona. Ujęto w nim 21 badań z udziałem 736 uczestników. Wyciąganie wniosków było utrudnione, jako że badania te charakteryzowały się sporą heterogenicznością.
Mechanizm działania przezczaszkowej stymulacji prądem stałym nie jest poznany. Przypuszcza się, że podczas stymulacji obszarów docelowych mózgu może dochodzić do uwalniania dopaminy. Inny możliwy mechanizm to inhibicja móżdżkowo-mózgowa.
Metoda ta jest generalnie bezpieczna. Choć w jednym z badań 20% uczestników zgłosiło efekty uboczne (w pozostałych był to zdecydowanie mniejszy odsetek), to były one przemijające12.
Od przeszło 20 lat trwają badania nad przezczaszkową stymulacją magnetyczną w chorobie Parkinsona. W randomizowanym badaniu kontrolowanym z 2019 r. stwierdzono, że metoda ta, wycelowana w dodatkową korę ruchową, łagodzi objawy zamrożenia chodu13. Rok później autorzy tego badania przeprowadzili następne, mające na celu wyjaśnienie mechanizmu działania stymulacji magnetycznej. Okazało się, że korzystny efekt pojawia się dzięki normalizacji nieprawidłowych wzorców łączności funkcjonalnej w mózgu. Oprócz wzorców związanych z zamrożeniem chodu stymulacja magnetyczna normalizuje inne zaburzone wzorce łączności, obserwowane w chorobie Parkinsona14.
Przezczaszkowa stymulacja magnetyczna jest także najszerzej badaną technologią nieinwazyjnej neuromodulacji, stosowanej w leczeniu dyskinez wywołanych lewodopą. W wielu takich badaniach wykazano korzystne efekty oraz dobrą tolerancję metody. Jej działanie oparte jest na zmianach w łączności mózgu, jego neuroplastyczności, neurotrasmiterach, regeneracji tkanki nerwowej oraz modulacji przepływu krwi. Konieczne są szerzej zakrojone badania kliniczne w celu lepszego poznania mechanizmów działania oraz optymalizacji parametrów leczenia15.
Ciekawą formą fizjoterapii dla osób z chorobą Parkinsona są ćwiczenia w wodzie. Według przeglądu systematycznego z 2019 r. nie tylko poprawiają one deficyty motoryczne, ale działają lepiej niż zwykłe ćwiczenia (na sucho) w takich obszarach jak równowaga, lęk przed upadkiem i związana ze zdrowiem jakość życia16.
Fizjoterapia w choroba Parkinsona - perspektywy na przyszłość
Nadzieje na skuteczniejsze leczenie choroby Parkinsona wiązane są przede wszystkim z terapią genową, która wyposażałaby komórki nerwowe w narzędzia umożliwiające wystarczającą produkcję dopaminy. Obecnie prowadzonych jest ponad 20 badań klinicznych nad lekami tego typu. Wiele z nich w fazie pierwszej dało bardzo obiecujące rezultaty. Na ostateczne wyniki – i dopuszczenie leków do obrotu – musimy jednak jeszcze poczekać.
Badania na zwierzętach z modelem choroby Parkinsona wykazały korzystne działanie fotobiomodulacji (terapii światłem). Istnieje również cały szereg opisów przypadków lub serii przypadków, w których dzięki tej metodzie uzyskano znaczące złagodzenie objawów u pacjentów. Australijscy naukowcy piszą, że zdecydowanie warte rozważenia jest przeniesienie tych dowodów eksperymentalnych do praktyki klinicznej, jako że ta metoda leczenia jest bezpieczna, a uzyskana poprawa zachęcająca. Kolejnym krokiem powinny być duże randomizowane badania kontrolowane17.
Jak wykazują dane naukowe, terapia tlenowo-ozonowa skutecznie pobudza mikrokrążenie krwi w mózgu i zwiększa wytwarzanie energii przez neurony. Ma ona również działanie przeciwzapalne i przeciwskurczowe, aktywuje system antyoksydacyjny w mitochondriach i ułatwia usuwanie katabolitów z komórek. Wydaje się również, że terapia taka nasila i wydłuża efekty działania takich leków jak lewodopa. W badaniu z 2018 r. sprawdzono efekt podawania mieszanki tlenowo-ozonowej poprzez rektalną insuflację pacjentom z chorobą Parkinsona. Okazało się, że terapia wywołała znaczącą redukcję objawów mięśniowo- funkcjonalnych, posturalnych i stabilometrycznych, obserwowanych podczas uprawiania sportu18.
Innym lekiem przyszłości o wstępnie dużym potencjale wydaje się być honokiol – lignan pozyskiwany z kory, szyszek i liści kilku gatunków rodzaju Magnolia, a stosowany od wieków m.in. w tradycyjnej medycynie chińskiej. Współczesna nauka odkryła, że ma on właściwości neuroprotekcyjne. W testach in vitro substancja ta wykazuje silną aktywność neurotropową.
Badania przedkliniczne wykazują, że honokiol łagodzi skutki udaru mózgu i napadów padaczkowych, a w modelach behawioralnych poprawia uczenie się i pamięć. W 2018 r. w badaniu na zwierzętach z modelem choroby Parkinsona stwierdzono, że honokiol wykazuje działanie ochronne i terapeutyczne odnośnie do zaburzeń motorycznych i postępujących uszkodzeń dopaminergicznych u takich zwierząt. Autorzy badania sugerują, że substancja ta może w przyszłości stać się lekiem stosowanym w leczeniu objawów ruchowych i neurodegeneracji w chorobie Parkinsona19.
Obiecujące wydają się również wstępne badania nad zastosowaniem terapii tlenem hiperbarycznym. W chińskim badaniu na szczurach z 2015 r. zauważono, że połączenie tej terapii z lewodopą ma działanie neuroprotekcyjne u zwierząt z modelem choroby Parkinsona. Autorzy przypuszczają, że mechanizm opiera się na redukcji stresu oksydacyjnego i ochronie przed apoptozą20. Podobne wyniki uzyskano trzy lata później w japońskim badaniu, w którym stwierdzono, że łagodna terapia tlenem hiperbarycznym (ciśnienie 1317 hPa przy 45% tlenu) hamuje wyniszczanie neuronów dopaminergicznych w istocie czarnej u myszy z modelem choroby Parkinsona21. Gdyby te dane potwierdziły się w szeroko zakrojonych badaniach na ludziach, metoda ta dawałaby pacjentom dużą nadzieję.
Jak widać, rola fizjoterapii w chorobie Parkinsona pozostaje niezwykle istotna. Wcześnie wdrożone i odpowiednio prowadzone postępowanie może znacząco pomagać pacjentom w jak najdłuższym zachowaniu sprawności i dobrej jakości życia.
Honokiol pozyskiwany jest z roślin rodzaju Magnolia.
- Tysnes O.B., Storstein A., J Neural Transm. 2017 (Aug); 124(8): 901-905.
- Greenland J.C., Baker R.A., In: Parkinson’s Disease: Pathogenesis and Clinical Aspects. Stroker T.B., Greenland J.C. (Editors), Codon Publications, Brisbane, Australia.
- Armstrong M.J., Okun M.S., JAMA. 2020; 323(6): 548-560.
- Rascol O. et al., The Lancet. 2021 Dec 1; 20(12): 1048-1056.
- NICE guideline [NG71]. Parkinson’s disease in adults. 2017 (www.nice.org.uk/guidance/ng71)
- Shukla A.W., Malaty I.A., Semin Neurol. 2017 Apr; 37(2): 193-204.
- Lee D.J. et al., Neural Regen Res. 2018 Aug; 13(8): 1342-1345.
- Keus S.H.J. et al, European Physiotherapy Guideline for Parkinson’s disease. 2014; KNGF/ParkinsonNet, the Netherlands.
- Radder D.L.M. et al., Neurorehabil Neural Repair. 2020 Oct; 34(10): 871-880.
- Tomlinson C.L. et al., BMJ. 2012; 345:e5004.
- Mak M.K. et al., Nat Rev Neurol. 2017 Nov; 13(11): 689-703.
- Liu X. et al., Front Ageing Neurosci. 2021; 13:746797.
- Mi T.M. et al., Parkinsonism Relat Disord. 2019 Nov; 68: 85-90.
- Mi T.M. et al., npj Parkinson’s Disease. 2020; 6: 16.
- Wu Y. et al., Front Neurol. 2021 November; 12: 758345.
- Cugusi L. et al., J Physiother. 2019 Apr; 65(2): 65-74.
- Hamilton C. et al., Neural Regen Res. 2018 Oct; 13(10): 1738-1740.
- Morelli L. et al., Ozone Therapy. 2018; 3: 7511.
- Chen H.H. et al., Pharmacological Reports. 2018 Aug; 70(4); 668-676.
- Pan X. et al., Neurosci Lett. 2015 Jul 23; 600: 220-225.
- Kusuda Y. et al., Neurosci Res. 2018 Jul; 132: 58-62.
- https://www.parkinson.org/blog/awareness/New-Exercise-Recommendations