Nieprawidłowości mózgu w prognozowaniu funkcjonowania poznawczego w porażeniu mózgowym - wprowadzenie
Porażenie mózgowe (PM) opisuje grupę trwałych zaburzeń w rozwoju ruchowym i postawy, powodujących ograniczenia aktywności, a przypisywanych niepostępującym zakłóceniom w rozwoju mózgu u płodu lub niemowlęcia. PM jest najczęstszą diagnozą w przypadkach niesprawności ruchowej w dzieciństwie1 i często prowadzi do upośledzenia funkcji poznawczych, komunikacji i zachowania, tym samym wpływając negatywnie na życie codzienne2. Wcześniejsze badania donoszą o upośledzeniu intelektualnym (ID – intellectual disability) u 24–45% tych dzieci3,4.
Objawy motoryczne i niemotoryczne są wyraźnie powiązane: dzieci z bardziej ograniczoną mobilnością (poziom IV i V w systemie klasyfikacji funkcji motoryki dużej GMFCS) wykazują również niemotoryczne upośledzenia, takie jak deficyty poznawcze lub drgawki5. Poziom GMFCS oparty jest na osiągach motorycznych i słabe funkcjonowanie motoryczne może być powiązane ze słabym funkcjonowaniem poznawczym3,6. Padaczka również powiązana jest z deficytami poznawczymi7. Innymi znanymi czynnikami są poziom wykształcenia rodziców i niska waga urodzeniowa, chociaż, według doniesień, negatywne powiązanie tego ostatniego obniżyło się z biegiem lat8,9.
Schematy uszkodzeń mózgu różnią się w zależności od czasu ich wystąpienia. Wady rozwojowe mózgu powstają w pierwszym trymestrze ciąży i powiązane są ze spastycznością i konkretnymi upośledzeniami poznawczymi (np. obniżoną zdolnością rozumienia języka mówionego)10. Uszkodzenia mózgu w spastycznym PM, a mianowicie uszkodzenie substancji białej, związane jest z drugim trymestrem. W cięższych przypadkach (poziom IV i V w systemie GMFCS) takie uszkodzenie mózgu powiązane jest z bardzo słabym funkcjonowaniem poznawczym11,12.
Uszkodzenie substancji szarej, obejmujące obustronne uszkodzenie jąder podstawnych i wzgórz (BGT – basal ganglia and thalami) oraz zawał tętnicy środkowej mózgu, jest wynikiem zdarzenia wewnątrzmacicznego w trzecim trymestrze ciąży13. Uszkodzenia BGT powiązane są z dyskinetycznym PM, a w ciężkich przypadkach także ze spastycznością14. Rozumienie języka mówionego może być u tych pacjentów zachowane, pomimo ciężkiej niesprawności ruchowej, w zależności od stopnia objęcia uszkodzeniem substancji białej10. Istnieją doniesienia, iż pacjenci z dyskinetycznym PM wykazują lepsze funkcjonowanie intelektualne i wykonawcze niż pacjenci ze spastycznym PM, przy wzięciu poprawek na poziom GMFCS i wcześniactwo15.
Jednostronne PM wiązane jest z zaburzeniami funkcji wykonawczych, co może być spowodowane uszkodzeniami w dowolnym obszarze sieci czołowo-podkorowej16.
Niewiele badań relacjonuje testy indywidualne w reprezentatywnej próbce17. Mało wiadomo na temat wartości prognostycznej zarówno jakościowej, jak i ilościowej oceny mózgu we wczesnym wieku metodą MRI, szczególnie w połączeniu z innymi cechami klinicznymi.
Celem badania jest analiza relacji pomiędzy funkcjonowaniem poznawczym w wieku szkolnym pacjentów z PM a 1) nieprawidłowościami w mózgu i 2) zestawem zmiennych z poszczególnych domen ICF (Międzynarodowej Klasyfikacji Funkcjonowania, Niepełnosprawności i Zdrowia), w oparciu o wcześniejszą wiedzę i dostępne dane: funkcjonowanie motoryczne (poziom GMFCS), padaczka, wiek ciążowy, waga urodzeniowa i poziom wykształcenia rodziców.
Domeny ICF obejmują:
- struktury ciała,
- funkcje ciała,
- aktywność i uczestnictwo,
- czynniki kontekstowe (m.in. środowiskowe i osobiste)18.
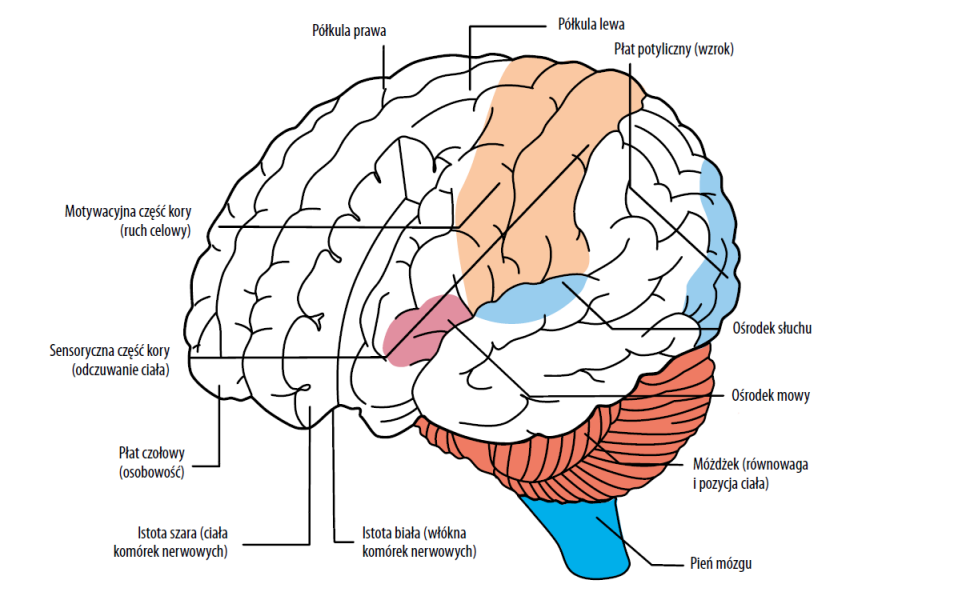
Ryc. 1. Budowa mózgu.
Badanie nad nieprawidłowościami mózgu w prognozowaniu funkcjonowania poznawczego w porażeniu mózgowym - metody
Uczestnicy
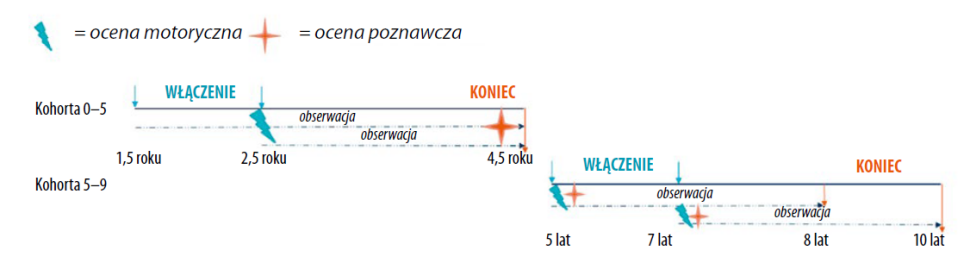
PERRIN, Pediatryczne Badanie Rehabilitacyjne Porażenia Mózgowego w Holandii, jest prospektywnym, podłużnym badaniem kohortowym nad przebiegiem i czynnikami determinującymi codzienne funkcjonowanie dzieci z PM. Bieżące badanie wykorzystuje dane z kohort PERRIN 0–5 i 5–9. Do kohorty 0–5 (n = 100) włączono dzieci w wieku 1,5 lub 2,5 roku, z okresem obserwacji do wieku 4,5 roku. Do kohorty 5–9 (n = 115) włączono dzieci w wieku 5 lub 7 lat, z okresem obserwacji przez trzy kolejne lata19. Rekrutacja odbyła się pomiędzy rokiem 2002 a 2007. Od wszystkich rodziców uzyskano świadomą zgodę. Aprobatę etyczną dla badania wydały komitety etyki medycznej w Ośrodku Medycznym Uniwersytetu w Utrechcie, Ośrodku Medycznym Uniwersytetu VU w Amsterdamie i czterech ośrodkach rehabilitacyjnych, uczestniczących w badaniu.
U 77 spośród 215 dzieci w tym badaniu dostępne klinicznie było neuroobrazowanie. U dwojga dzieci dostępne były tylko skany tomografii komputerowej (CT) i udało się uzyskać tylko jakościową część oceny MRI. Dwoje dzieci wykluczono z badania z powodu innej diagnozy. Ogółem „kohorta neuroobrazowania PERRIN 0–9” składa się z 75 dzieci (n = 27 z grupy 0–5 i n = 48 z grupy 5–9).
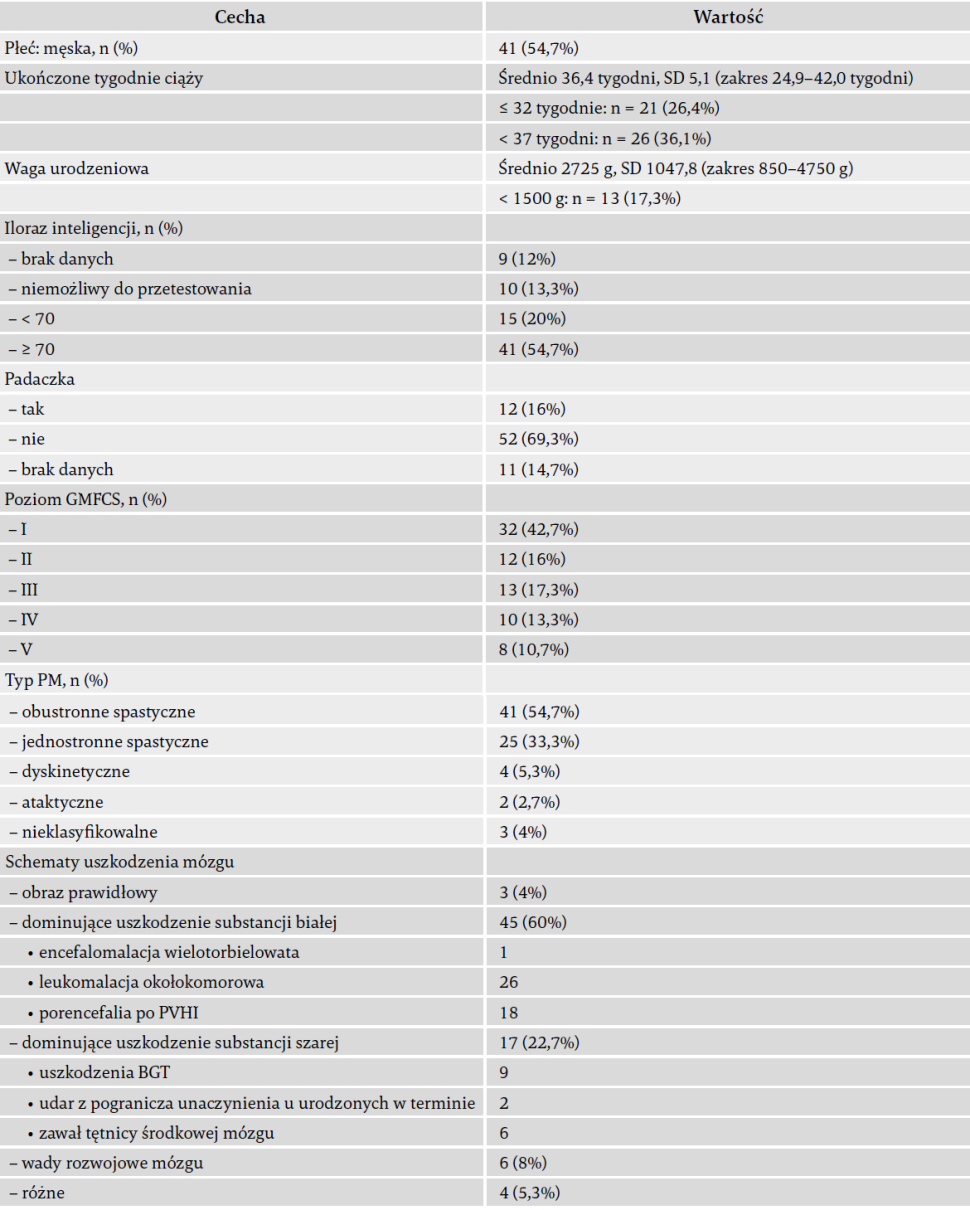
Rozkład płci, typu PM i poziomu GMFCS był bardzo podobny w grupie PERRIN MRI i w grupie PERRIN bez MRI (dwustronne wartości p testu chi-kwadrat Pearsona: 0,108, 0,604 i 0,959), co gwarantuje, że obecna grupa PERRIN MRI jest reprezentatywna dla całej kohorty PERRIN. Następujące informacje zaczerpnięto z historii medycznej, uzyskanej od rodziców: wiek ciążowy, waga urodzeniowa, diagnoza padaczki. Tab. 1 przedstawia cechy charakterystyczne populacji: więcej niż jedna trzecia uczestników urodziła się przed terminem (< 37. tygodnia ciąży: n = 26, 36,1%), 13 uczestników (17,3%) miało wagę urodzeniową < 1500 g, a u 12 uczestników (16%) zdiagnozowano padaczkę.
Tab. 1. Charakterystyka podstawowa, n = 75.
Użyte skróty: BGT – jądra podstawne i wzgórze; PM – porażenie mózgowe; GMFCS – System Klasyfikacji Funkcji Motoryki Dużej; n – liczba; PVHI – zawał krwotoczny przykomorowy; SD – odchylenie standardowe.
Neuroobrazowanie: ocena nieprawidłowości mózgu – domena ICF struktur ciała
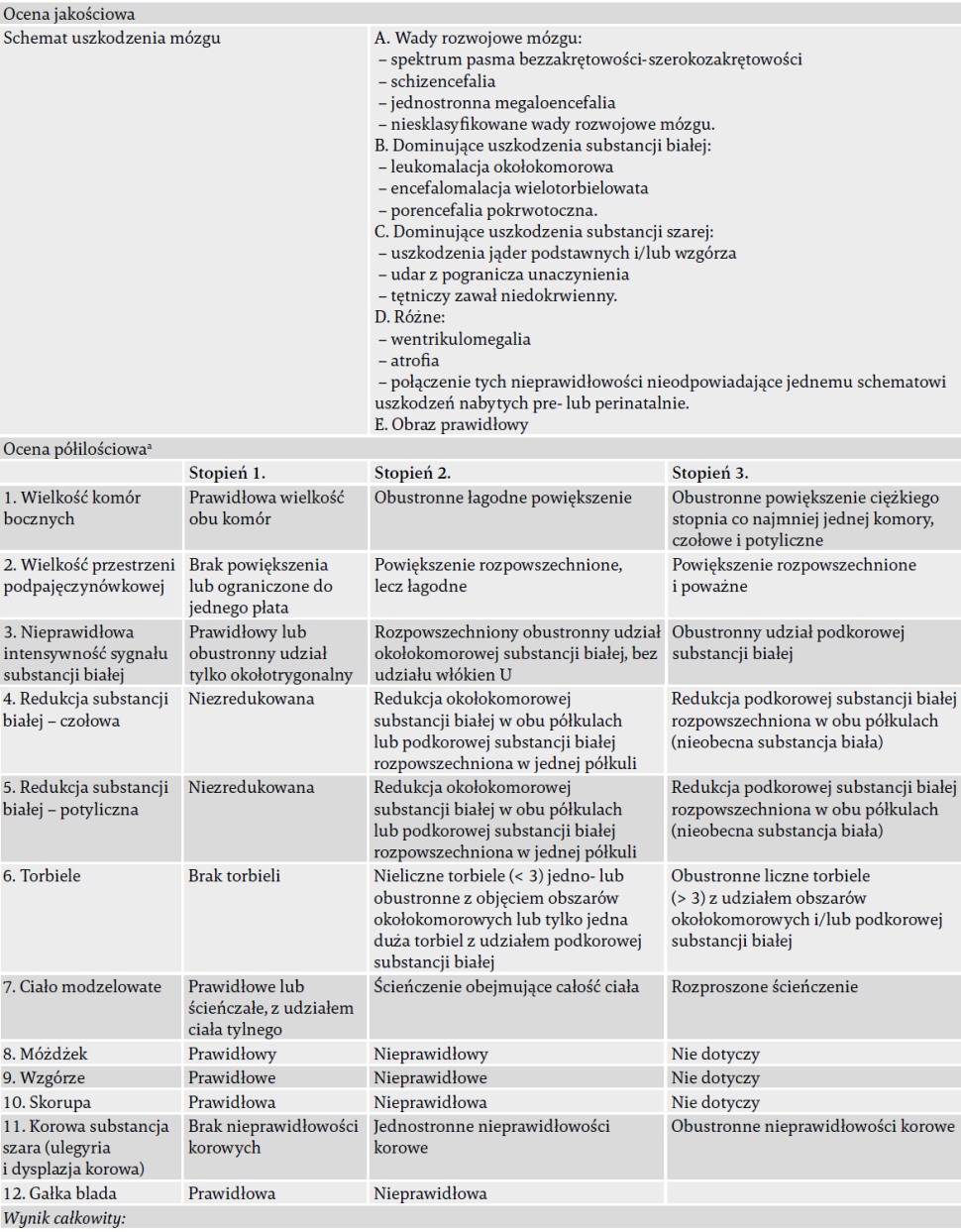
Szczegóły techniczne użytych skanerów różniły się w zależności od szpitala i roku (2000–2006). Mediana wieku w chwili neuroobrazowania wynosiła 17 miesięcy (IQR 6,25–25). Ogółem 52 uczestników (69,3%) przeskanowano w wieku < 2 lat: 16 z nich (21,6%) przeskanowano w okresie noworodkowym (w wieku ≤ 1 miesiąca), a 12 (16,2%) – pomiędzy 18. a 23. miesiącem życia. Pozostałych 24 uczestników (32%) miało w chwili neuroobrazowania od 2 do 17 miesięcy. Zastosowaliśmy zarówno jakościowy, jak i półilościowy system oceny MRI. Jakościowy: użyliśmy opartej na MRI klasyfikacji "schematu uszkodzeń mózgu", podanej przez Himmelmanna i wsp.13. W tab. 2 przedstawiamy ogólny układ zastosowanej klasyfikacji. Półilościowy: oceny neuroobrazowania dokonano według skali zaadaptowanej z Cioni i wsp.20 , niezależnie od schematu jakościowego. Półilościowa skala Cioni składa się z 7 punktów, każdy o zakresie od stopnia 1. (prawie prawidłowy) po stopień 3. (najbardziej nieprawidłowy). Punkty skali zostały rozbudowane: punkt "redukcja substancji białej" został rozdzielony na "redukcję substancji białej czołowej" i "redukcję substancji białej potylicznej". Poza tym do skali dodano następujące punkty: móżdżek, wzgórze, skorupa i gałka blada. Ostatnie cztery punkty mogą być oceniane jako prawidłowe (stopień 1.) lub nieprawidłowe (stopień 2.). Dwanaście skal półilościowych zsumowano do wyników cząstkowych dla „rozmiaru uszkodzeń substancji białej” (stopnie nieprawidłowości sygnałów substancji białej, redukcja substancji białej czołowej i potylicznej, torbiele i ciało modzelowate, o zakresie od 5 do 15) i dla „rozmiaru uszkodzeń substancji szarej” (stopnie dla wzgórza, skorupy, szarej substancji korowej i gałki bladej, o zakresie od 4 do 9).
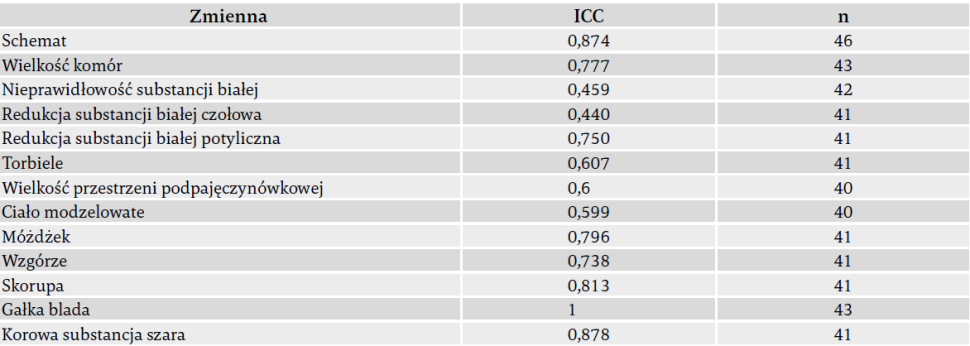
Neonatolog (LSdV, z doświadczeniem > 30 lat) ocenił neuroobrazowanie wszystkich uczestników. Drugi lekarz, neurolog dziecięcy (RJV, z doświadczeniem > 15 lat), niezależnie ocenił również neuroobrazowanie 46 uczestników. Dla sprawdzenia wiarygodności zastosowanej skali oceny wyliczono współczynnik korelacji wewnątrzklasowej (ICC) (tab. 3).
Tab. 2. Punkty oceny MRI.
a Punkty 1 i 2 odzwierciedlają wielkość atrofii; punkty od 3 do 7 są sumowane dla uzyskania "oceny cząstkowej uszkodzenia substancji białej" (w zakresie od 5 do 15); punkty od 9 do 12 są sumowane dla uzyskania "oceny cząstkowej uszkodzenia substancji szarej" (w zakresie od 4 do 9).
Tab. 3. Wiarygodność oceny MRI przedstawiona jako korelacja wewnątrzklasowa (ICC).
Użyte skróty: ICC – korelacja wewnątrzklasowa.
Ocena funkcjonalna nieprawidłowości mózgu w prognozowaniu funkcjonowania poznawczego w porażeniu mózgowym
Ocena funkcjonowania poznawczego – domena ICF funkcji ciała
Upośledzenie poznawcze zdefiniowano jako niewerbalny iloraz inteligencji (IQ) wynoszący 70 lub mniej. IQ kohorty 0–5 oparto na wynikach IQ Niewerbalnego Testu Inteligencji Snijders-Oomen (SON) w wieku 4,5 roku21. IQ kohorty 5–9 oparto na wynikach Testu Progresywnych Matryc Ravena w wersji kolorowej dla dzieci przy pierwszym pomiarze (wiek 5 i 7 lat)22. Uczestnicy wyłączani byli z tych rezultatów, jeśli nie byli w stanie wykonać testu IQ z powodu upośledzenia ruchowego.
Klasyfikacja funkcji motorycznych – domena ICF aktywności
Dzieci zostały sklasyfikowane przez przeszkolonego badacza według poziomu GMFCS (I-V), typu upośledzenia motorycznego i rozkładu kończyn19,23. Aby umożliwić rzetelną ocenę, dla kohorty 0–5 użyto danych z pomiarów w wieku 30 miesięcy, a dla kohorty 5–9 – pomiarów podstawowych w wieku 5 i 7 lat24. Ryc. 2 pokazuje oś czasu włączenia do badania i oceny funkcjonalnej obu kohort.
Ryc. 2. Oś czasu włączenia do badania i ocen funkcjonalnych.
Poziom wykształcenia rodziców – domena ICF czynników środowiskowych
Dane dotyczące poziomu wykształcenia obojga rodziców zebrano przy użyciu kwestionariuszy i podzielono na osiem poziomów: od szkoły podstawowej (poziom 1) do uniwersytetu (poziom 8). Użyto najwyższego poziomu.
Statystyka
Wszystkie analizy statystyczne wykonano przy użyciu programu IBM SPSS Statistics wersja 24. Przeprowadzono eksploracyjną jednowymiarową analizę regresji logistycznej dla wszystkich zmiennych z upośledzeniem poznawczym (zmienną dychotomiczną) jako wynikiem zależnym: wyniku cząstkowego substancji białej (o zakresie od 5 do 15), wyniku cząstkowego substancji szarej (o zakresie od 4 do 9), poziomu GMFCS (poziom I–V), wagi urodzeniowej (w gramach) i najwyższego poziomu wykształcenia rodziców (poziom 1–8). Wykonano dokładny test Fishera dla oceny możliwych powiązań z upośledzeniem poznawczym dla danych kategorycznych: pięciu różnych schematów uszkodzeń mózgu i padaczki.
Zastosowano analizę regresji logistycznej z wieloma zmiennymi dla uzyskania modelu czynników ryzyka w upośledzeniu poznawczym, obejmującego te zmienne, które wykazywały znaczące jednoczynnikowe powiązanie z upośledzeniem poznawczym, a także dla wyliczenia ilorazów szans (OR; z 95% przedziałami ufności; C.I.). Analiza ta objęła wynik cząstkowy substancji białej i poziom GMFCS. Sześciu uczestników z wadami rozwojowymi mózgu wyłączono z analizy, ponieważ skala oceny MRI dla uszkodzeń substancji białej i szarej nie była przeznaczona dla tej grupy pacjentów.
Dla niektórych brakujących danych neuroobrazowania zastosowano imputację regresji stochastycznej, by ograniczyć ryzyko odchylenia poprzez usunięcie niekompletnych przypadków. Porównano analizy z imputacją i bez niej.
Badanie nieprawidłowości mózgu w prognozowaniu funkcjonowania poznawczego w porażeniu mózgowym - rezultaty
Schematy nieprawidłowości mózgu – domena ICF struktur ciała
"Dominujące uszkodzenia substancji białej" (60%) i "dominujące uszkodzenia substancji szarej" (23%) były najczęstszymi schematami uszkodzeń mózgu. Zaledwie w 4% przypadków sklasyfikowano MRI mózgu jako "prawidłowe". Szczegóły przedstawia tabela 1. Współczynnik ICC oceny wahał się od 0,44 (dość dobry) do 1 (doskonały), średnio: 0,73 (dobry) (tab. 3).
Funkcjonowanie poznawcze – domena ICF funkcji ciała
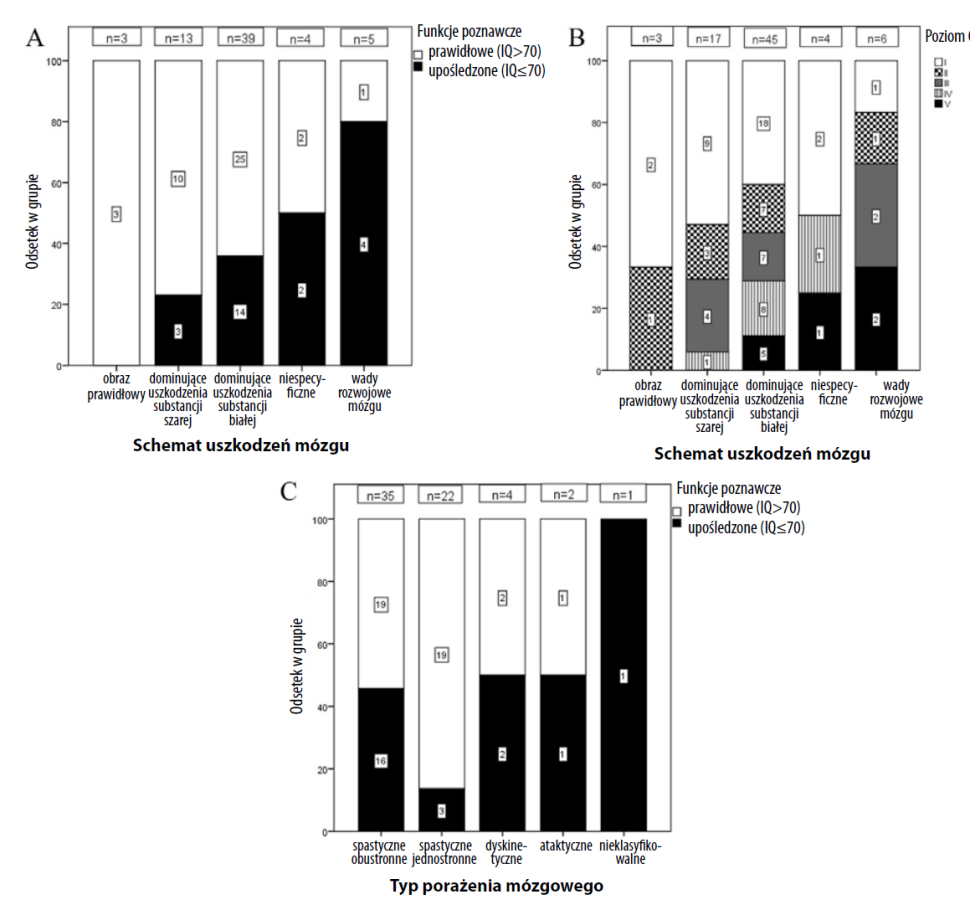
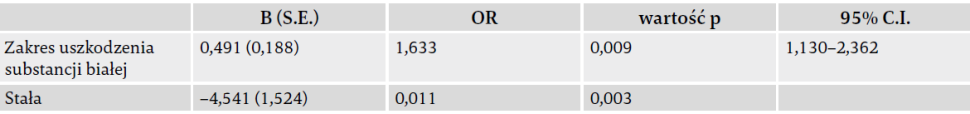
Niewerbalny IQ był możliwy do zbadania u 56 uczestników: 17 uczestników wykonało test SON (wiek 4,5 roku), a 39 uczestników wykonało Test Progresywnych Matryc Ravena w wersji kolorowej (wiek 5 i 7 lat). Spośród tych uczestników 41 (73%) sklasyfikowano jako wykazujących prawidłowe funkcje poznawcze (tj. IQ > 70), a 15 (27%) jako wykazujących upośledzenie poznawcze (tj. IQ ≤ 70). Ośmiu dodatkowych uczestników (w większości na poziomie IV–V GMFCS) próbowało wykonać testy, ale najwyraźniej nie byli w stanie tego zrobić z powodu upośledzeń poznawczych, dlatego też sklasyfikowano ich jako upośledzonych pod względem funkcji poznawczych. W przypadku dwóch uczestników brak było wyniku IQ z powodu upośledzeń motorycznych. U dziewięciu innych uczestników brak wyniku IQ spowodowany był innymi przyczynami, niezwiązanymi z funkcjonowaniem poznawczym. Ryc. 3A przedstawia rozkład funkcjonowania poznawczego dla poszczególnych schematów uszkodzeń mózgu.
Typ PM i klasyfikacja funkcji motorycznych – domeny ICF funkcji ciała i aktywności
Większość spośród 75 uczestników miała spastyczne PM; 41 (55%) miało obustronne spastyczne PM; 25 (33%) miało jednostronne spastyczne PM; 4 – dyskinetyczne PM; 2 – ataktyczne PM, a 3 – nieklasyfikowalne PM. Najczęstszym poziomem GMFCS był poziom I (n – 32, 43%), a dystrybucja pozostałych czterech poziomów była względnie równa. Szczegóły zawierają tab. 1, ryc. 3B i 3C.
Ryc. 3. Dystrybucja schematów uszkodzenia mózgu, poziomu GMFCS, upośledzenia poznawczego i typu PM.
Czynniki prognostyczne funkcjonowania poznawczego
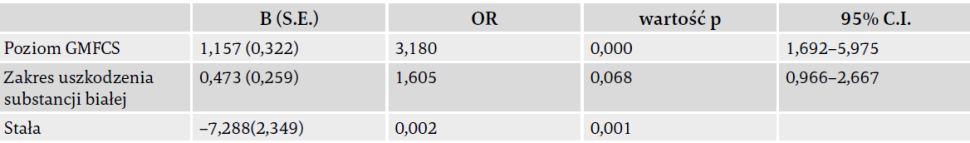
Analiza jednoczynnikowa nie wykazała znaczącego statystycznie powiązania pomiędzy upośledzeniem poznawczym a którymkolwiek ze schematów uszkodzeń mózgu, wynikiem cząstkowym substancji szarej, padaczką, wiekiem ciążowym, wagą urodzeniową lub poziomem wykształcenia rodziców. Jednakże w przypadku wyniku cząstkowego substancji białej i poziomu GMFCS istniał znaczący związek z upośledzeniem poznawczym. Regresja logistyczna z wieloma zmiennymi wykazała, że wyższy stopień uszkodzenia substancji białej, stwierdzony w MRI wykonanym we wczesnym wieku (mediana 17 miesięcy), jest czynnikiem prognostycznym dla późniejszego upośledzenia funkcji poznawczych (OR 1,63 dla zakresu wyniku cząstkowego substancji białej, 95% C.I. 1,13–2,36). Ten model oparty na MRI może poprawnie rozróżniać pomiędzy obecnością i nieobecnością niepełnosprawności intelektualnej w 71% przypadków. Po dodaniu informacji funkcjonalnych, model zawierający poziom GMFCS (OR 3,18, 95% C.I. 1,69-5,98) i stopień uszkodzenia substancji białej (OR 1,61, 95% C.I. 0,97–2,67) może poprawnie wyjaśniać upośledzenie funkcji poznawczych w 89% przypadków. Szczegóły przedstawiono w tab. 4 i 5. Wnioski te nie uległy zmianie po imputacji regresji stochastycznej pewnych brakujących wartości neuroobrazowania ani po wyłączeniu ośmiu pacjentów, którzy nie byli w stanie wykonać testu funkcji poznawczych.
Tab. 4. Model regresji logistycznej z wieloma zmiennymi dla obecności upośledzenia funkcji poznawczych, oparty na charakterystyce MRI; n = 54, brak 15 uczestników (6 uczestników z wadami rozwojowymi mózgu wyłączono).
R2 (Nagelkerke) = 0,212; użyte skróty: S.E. – błąd standardowy; C.I. – przedział ufności; OR – iloraz szans. Obszar pod krzywą ROC: 0,710 (S.E. 0,071, 95% C.I. 0,571–0,849).
Tab. 5. Model regresji logistycznej z wieloma zmiennymi dla obecności upośledzenia funkcji poznawczych, oparty na charakterystyce MRI i poziomie GMFCS; n = 54, brak 15 uczestników (6 uczestników z wadami rozwojowymi mózgu wyłączono).
R2 (Nagelkerke) = 0,568; użyte skróty: S.E. – błąd standardowy; C.I. – przedział ufności; OR – iloraz szans. Obszar pod krzywą ROC: 0,890 (S.E. 0,050, 95% C.I. 0,793–0,988).
Badanie nieprawidłowości mózgu w prognozowaniu funkcjonowania poznawczego w porażeniu mózgowym - dyskusja
Schematy nieprawidłowości mózgu – domena ICF struktur ciała
Częstość występowania stwierdzonych przez nas schematów nieprawidłowości mózgu jest bardzo zbliżona do podawanych wcześniej liczb odnośnie do PM (dominujące uszkodzenia substancji białej – 60%, dominujące uszkodzenia substancji szarej – 23%, obraz prawidłowy – 4% i wady rozwojowe mózgu – 8%)3,13,25. W dużym przeglądzie, obejmującym 2076 pacjentów, Arnfield i wsp. stwierdzili wady rozwojowe mózgu u 9,3%, uszkodzenia substancji białej u 46,2%, uszkodzenia substancji szarej u 25,4% (z wyłączeniem udarów pourodzeniowych), a prawidłowy obraz MRI u 12% pacjentów. Nie można wykluczyć całkowicie, że dziedziczna paraplegia spastyczna (HSP – hereditary spastic paraplegia) była obecna u któregoś z trzech (4%) pacjentów z prawidłowym MRI, ponieważ zaawansowana analiza genetyczna nie była częścią powszechnej oceny diagnostycznej w czasach włączania uczestników do badania PERRIN (2002–2007). Jednakże podczas obserwacji podłużnej nie odnotowano wskazówek klinicznych sugerujących HSP czy też postępującą encefalopatię.
Funkcjonowanie poznawcze – domena ICF funkcji ciała
W naszej kohorcie 23 spośród 64 (36%) uczestników sklasyfikowano jako mających upośledzone funkcje poznawcze (włączając w to ośmiu pacjentów, którzy nie byli w stanie wykonać testów z powodu upośledzeń funkcji poznawczych), a 27% badanych pacjentów miało niewerbalny IQ ≤ 70. Wcześniejsza literatura donosi o odsetkach niepełnosprawności intelektualnej wahających się od 24 do 51%1,3,4,11.
Należy zauważyć, że nasze liczby oparte są wyłącznie na niewerbalnym IQ, dlatego też używamy określenia "upośledzenie poznawcze" zamiast "niepełnosprawność intelektualna". Zgodnie z definicją Amerykańskiego Stowarzyszenia Niepełnosprawności Intelektualnych i Rozwojowych (American Association on Intellectual and Developmental Disabilities, AAIDD) przy diagnozowaniu niepełnosprawności intelektualnej poza funkcjonowaniem poznawczym powinno się brać pod uwagę także zachowania adaptacyjne (tzn. umiejętności koncepcyjne, społeczne i praktyczne)26. Stadskleiv i wsp. stosują tę szerszą definicję: proporcja pacjentów z niepełnosprawnością intelektualną wynosiła 24%, podczas gdy proporcja z IQ < 70 wynosiła 33%3. Stadskleiv i wsp. donoszą również o nierównym profilu poznawczym u około 20% pacjentów. Nasze dane tylko częściowo rozróżniają profile poznawcze: test SON wykazuje IQ "wykonawczy" i "rozumowy", ale Test Progresywnych Matryc Ravena w wersji kolorowej wykazuje tylko całkowity IQ. U dziewięciorga dzieci (spośród 21) test SON wykazał znaczącą różnicę pomiędzy dwoma typami inteligencji, a dwoje z tych dzieci sklasyfikowano jako "upośledzone intelektualnie". Oznacza to, że wśród 21 dzieci w naszej kohorcie badanych testem SON większość dzieci sklasyfikowanych jako "upośledzone intelektualnie" nie wykazuje znaczącej różnicy pomiędzy IQ wykonawczym a IQ rozumowania. Nasze dane nie ujawniają jednak, którzy pacjenci mają ograniczone werbalne możliwości poznawcze ani którzy pacjenci doświadczają w codziennym życiu problemów w wyniku niezharmonizowanego profilu poznawczego.
Klasyfikacje motoryczne – domena ICF aktywności
Nasze liczby dotyczące dystrybucji PM pozostają w zgodności z literaturą, opisującą przedziały od 39 do 55% dla obustronnego spastycznego PM (55%) i od 29 do 50% dla jednostronnego PM (33%)3,4. W naszej kohorcie 43% uczestników sklasyfikowanych było na poziomie I GMFCS, a 76% na poziomie I–III GMFCS. W literaturze poziom I jest najczęstszy – dotyczy od 32 do 51% przypadków, a także 65–70% pacjentów z PM, którzy potrafią chodzić samodzielnie3,4,11,25.
Czynniki prognostyczne dla funkcjonowania poznawczego
Analiza wielu zmiennych wykazała, że zakres uszkodzeń substancji białej i poziom GMFCS są czynnikami prognostycznymi dla funkcjonowania poznawczego w wieku szkolnym. Pięć jakościowych schematów uszkodzeń mózgu nie wykazało powiązania z funkcjonowaniem poznawczym. Możliwe jest jednak porównanie częstości występowania upośledzenia funkcji poznawczych w tych podgrupach z literaturą. Oprócz schematów uszkodzeń mózgu z gorszymi wynikami neurorozwojowymi powiązane jest także upośledzenie funkcji wzrokowych27. Niestety, w badaniu PERRIN nie dokonano systematycznego zebrania informacji na temat funkcji wzrokowych.
W naszej kohorcie dziewięcioro uczestników z uszkodzeniem jąder podstawnych i wzgórz (BGT) miało całkiem dobre wyniki w porównaniu z literaturą: ośmiu z nich sklasyfikowano na poziomie I–III GMFCS i tylko jeden z siedmiu przebadanych miał upośledzenie poznawcze. Uszkodzenia BGT są częściej wiązane z poziomem IV i V GMFCS (67% według Himmelmanna4) i upośledzeniem funkcji poznawczych28. Jednakże inne publikacje donoszą, iż wyniki pacjentów z uszkodzeniem BGT są zmienne i zależą od stopnia uszkodzeń dodatkowych, szczególnie substancji białej14,29. Dodatkowe uszkodzenie kory okołośrodkowej zwiększa ryzyko upośledzenia poznawczego14. Dla wyjaśnienia dobrych rezultatów naszych uczestników potrzebne może być bardziej szczegółowe różnicowanie zastosowanej oceny skanów MRI. Ponieważ jednak siedmiu z dziewięciu uczestników sklasyfikowano jako spastyczny typ PM, jest mało prawdopodobne, by ich skany MRI nie wykazywały dodatkowych uszkodzeń.
W przeciwieństwie do większości opublikowanych badań Weeke i wsp. stwierdzili, że IQ w wieku szkolnym związany jest z zakresem uszkodzeń substancji szarej, a nie białej30. Jednakże to badanie Weeke i wsp. wykorzystywało konkretnie skany MRI wykonane w pierwszym tygodniu po urodzeniu pacjentów leczonych hipotermią po encefalopatii niedotlenieniowo-niedokrwiennej. Dzięki zastosowaniu chłodzenia można spodziewać się mniej ciężkich uszkodzeń substancji białej, z późniejszymi konsekwencjami dla funkcji poznawczych30. W naszej kohorcie częstość występowania upośledzenia poznawczego jest wyższa w grupie z dominującymi uszkodzeniami substancji białej (31%, 13% – brak) niż w grupie z dominującymi uszkodzeniami substancji szarej (18%, 24% – brak). Poza tym 71% naszych uczestników z dominującymi uszkodzeniami substancji białej jest w stanie chodzić (poziom I–III GMFCS). Analogiczne są doniesienia z literatury, mówiące o tym, że uszkodzenia substancji białej w około 75% przypadków powiązane są z łagodnymi upośledzeniami motorycznymi (I–II GMFCS) i z upośledzeniem rozumienia języka4,10,25.
Oprócz powiązania funkcjonowania poznawczego ze stopniem uszkodzenia substancji białej i poziomem GMFCS nasze dane nie wykazały powiązań funkcjonowania poznawczego z poziomem wykształcenia rodziców, wiekiem ciążowym, wagą urodzeniową i padaczką. Literatura donosi, iż poziom wykształcenia rodziców powiązany jest z funkcjonowaniem poznawczym dziecka i występowaniem upośledzenia intelektualnego, szczególnie u dzieci urodzonych przed terminem9,31. Ponieważ znaczenie ma nie tylko poziom wykształcenia matki, postanowiliśmy włączyć najwyższy poziom wykształcenia rodziców31. W naszej kohorcie 36,1% uczestników urodziło się przed terminem (< 37. tygodnia ciąży). Jak się wydaje, nasze badanie dostarcza dowodów, iż w populacji o mieszanym wieku ciążowym, uszkodzeniach mózgu i PM, uszkodzenie mózgu jest silniejszym czynnikiem prognostycznym dla funkcji poznawczych niż poziom wykształcenia rodziców.
Co więcej, waga urodzeniowa i padaczka nie zostały zidentyfikowane jako czynniki prognostyczne funkcjonowania poznawczego w naszej populacji. Częstość występowania padaczki w naszej populacji (16%) jest niższa niż w doniesieniach z literatury (około 30%)32. Możliwe, że u części pacjentów padaczka rozpoczyna się później. Nie było współliniowości pomiędzy rozmiarem uszkodzeń substancji białej a wagą urodzeniową. Chociaż wiadomo, że niska waga urodzeniowa i padaczka mogą mieć negatywny wpływ na funkcjonowanie poznawcze, możliwe jest, że cechy charakterystyczne MRI powiązane są z funkcjonowaniem poznawczym w sposób bardziej bezpośredni.
Ograniczenia badania
Liczba dostępnych skanów MRI była ograniczona (77/215 – 36%), ponieważ neuroobrazowanie nie było częścią pierwotnych badań PERRIN. Wykorzystaliśmy dostępne klinicznie skany mózgu MRI z lat 2000–2007. Wprawdzie zalecane jest, by u każdego dziecka podejrzewanego o PM wykonano w niemowlęctwie MRI mózgu33, nie zawsze tak się działo (i dzieje) – z przyczyn osobistych lub związanych z wiekiem czy też z powodu ograniczonych środków. Dodatkowo niniejsze badanie oparte jest na konwencjonalnych obrazach MR (wykonanych pomiędzy rokiem 2000 a 2006). Nowsze badania miały możliwość zastosowania bardziej zaawansowanych sekwencji MR, takich jak obrazowanie dyfuzyjne DTI i wolumetria 3D, które mogą ujawniać więcej subtelnych nieprawidłowości.
Dla uzyskania rzetelnej klasyfikacji MRI ważny jest wiek pacjenta w chwili wykonywania badania obrazowego, o czym wspomina Himmelmann i wsp.: z powodu niecałkowitej mielinizacji łagodne uszkodzenia mogą zostać przeoczone przed ukończeniem przez pacjenta 2 lat13. Mediana wieku neuroobrazowania wynosiła 17 miesięcy (IQR 6,25– 25), a tylko 22 uczestników (29,3%) miało w chwili neuroobrazowania 2 lata lub więcej. Niemniej jednak skanowanie noworodkowe (≤ 1 miesiąc) jest również miarodajne i zostało zastosowane u 16 pacjentów (21%). 24 uczestników (32%) skanowano w wieku 2–17 miesięcy, co jest najmniej miarodajnym okresem. Spośród tych 24 uczestników 10 zostało sklasyfikowanych jako przypadki "leukomalacji okołokomorowej" (PVL – periventricular leukomalacia), która jest schematem uszkodzeń najtrudniejszym do wiarygodnej oceny u dzieci w wieku poniżej 24 miesięcy. Innymi schematami w tej grupie były: porencefalia (n = 5), wady rozwojowe mózgu (n = 5), zawał tętnicy środkowej mózgu (n = 2), uszkodzenie BGT (n = 1) i obraz prawidłowy (n = 1). Dziewięciu z 10 uczestników sklasyfikowanych jako PVL miało powiększone komory, co można ocenić miarodajnie w każdym wieku. Ogółem prawidłowy obraz stwierdzono tylko u 4% dzieci, co jest dość niskim odsetkiem w porównaniu z literaturą. Z tego powodu mało prawdopodobne jest, aby znacząca część została błędnie sklasyfikowana jako "prawidłowa". Co więcej, dodatkowa (eksploracyjna) analiza obejmująca tylko pacjentów z MRI w wieku powyżej 17 miesięcy (28 pełnych przypadków) wykazała te same trendy, chociaż nie była już znacząca statystycznie ze względu na małe liczby.
Rzetelność klasyfikacji MRI była ogólnie dobra. Jednakże zgodność pomiędzy osobami oceniającymi redukcję czołowej substancji białej była stosunkowo niska. Tego punktu nie analizowano oddzielnie, lecz tylko w połączeniu z innymi punktami dotyczącymi substancji białej, i dlatego wpływ tej niskiej wiarygodności jest ograniczony. Poza tym, niestety, dostępne były tylko ograniczone informacje na temat padaczki – przydatne byłyby informacje o leczeniu, jak również o funkcjonowaniu wzrokowym.
Jak wspomniano wcześniej, ograniczeniem tego badania jest to, że mierzono tylko inteligencję niewerbalną, podczas gdy niepełnosprawność intelektualna zależy od całości funkcjonowania poznawczego i zachowań adaptacyjnych26. Dlatego też nasze rezultaty obejmują upośledzenie funkcjonowania poznawczego, ale nie niepełnosprawność intelektualną. Co więcej, nie dokonano adaptacji dla dzieci z ciężkim upośledzeniem ruchowym, by umożliwić im odpowiedzi na testy poznawcze. Jak opisano, ośmioro pacjentów (w większości poziom IV–V GMFCS) próbowało wykonać testy, lecz najwyraźniej nie było w stanie tego zrobić z powodu swego funkcjonowania poznawczego. Jednakże, ponieważ nie dokonano adaptacji dla upośledzenia ruchowego, trudno jest stwierdzić z całą pewnością, że tylko upośledzenie poznawcze uniemożliwiło dzieciom odpowiedź. Dlatego po wyłączeniu tych ośmiorga pacjentów przeprowadziliśmy także analizy regresji. Wnioski oparte na tych dodatkowych analizach pozostają niezmienione.
Badanie nieprawidłowości mózgu w prognozowaniu funkcjonowania poznawczego w porażeniu mózgowym - wniosek
Rozmiar uszkodzenia mózgowej substancji białej, oceniony za pomocą MRI we wczesnym wieku, jest czynnikiem ryzyka dla późniejszego funkcjonowania poznawczego. Poziom GMFCS może również być pomocny w identyfikowaniu dzieci zagrożonych upośledzeniem funkcji poznawczych.
Uszkodzenia mózgu wykazane w MRI wraz z GMFCS mają silną wartość prognostyczną w upośledzeniu poznawczym. W naszej kohorcie waga urodzeniowa, wiek ciążowy, padaczka i poziom wykształcenia rodziców nie były powiązane z upośledzeniem funkcji poznawczych.
Nasze wyniki dostarczają cennych informacji prognostycznych klinicystom, co może stworzyć możliwości dostosowania opieki, wsparcia i oczekiwań we wczesnej fazie życia dzieci z PM i ich rodzin.
Źródło: European Journal of Paediatric Neurology 32 (2021) 56-65. ©2021 The Authors Na podstawie licencji CC BY 4.0 (http://creativecommons.org/licenses/by/4.0)
- C. Cans, Surveillance of cerebral palsy in Europe: a collaboration of cerebral palsy surveys and registers. Surveillance of Cerebral Palsy in Europe (SCPE), Dev. Med. Child Neurol. 42 (12) (2000) 816-824.
- P. Rosenbaum, N. Paneth, A. Leviton, M. Goldstein, M. Bax, D. Damiano, et al., A report: the definition and classification of cerebral palsy April 2006, Dev. Med. Child Neurol. Suppl. 109 (suppl 109) (2007) 8-14.
- K. Stadskleiv, R. Jahnsen, G.L. Andersen, S. von Tetzchner, Neuropsychological profiles of children with cerebral palsy, Dev. Neurorehabil. 21 (2) (2018) 108-120.
- K. Himmelmann, P. Uvebrant, Function and neuroimaging in cerebral palsy: a population-based study, Dev. Med. Child Neurol. 53 (6) (2011) 516-521.
- L. Enkelaar, M. Ketelaar, J.W. Gorter, Association between motor and mental functioning in toddlers with cerebral palsy, Dev. Neurorehabil. 11 (4) (2008) 276-282.
- Y.C. Wu, K.R. Heineman, S. La Bastide-Van Gemert, D. Kuiper, M. Drenth Olivares, M. Hadders-Algra, Motor behaviour in infancy is associated with neurological, cognitive, and behavioural function of children born to parents with reduced fertility, Dev. Med. Child Neurol. 62 (9) (2020) 1089-1095; https://doi.org/10.1111/dmcn.14520.
- L.V. Gabis, N.M. Tsubary, O. Leon, A. Ashkenasi, S. Shefer, Assessment of abilities and comorbidities in children with cerebral palsy, J. Child Neurol. 30 (12) (2015) 1640-1645.
- A. Goisis, B. Ozcan, M. Myrskyla, Decline in the negative association between low birth weight and cognitive ability, Proc. Natl. Acad. Sci. U.S.A. 114 (1) (2017) 84-88.
- H.S. Wong, P. Edwards, Nature or nurture: a systematic review of the effect of socio-economic status on the developmental and cognitive outcomes of children born preterm, Matern. Child Health J. 17 (9) (2013) 1689-1700.
- J.J. Geytenbeek, K.J. Oostrom, L. Harlaar, J.G. Becher, D.L. Knol, F. Barkhof, et al., Language comprehension in nonspeaking children with severe cerebral palsy: neuroanatomical substrate? Eur. J. Paediatr. Neurol. : EJPN : Off. J. Eur. Paediatr. Neurol. Soc. 19 (5) (2015) 510-520.
- K. Himmelmann, E. Beckung, G. Hagberg, P. Uvebrant, Gross and fine motor function and accompanying impairments in cerebral palsy, Dev. Med. Child Neurol. 48 (6) (2006) 417-423.
- S.M. Reid, E.M. Meehan, S.J. Arnup, D.S. Reddihough, Intellectual disability in cerebral palsy: a population- based retrospective study, Dev. Med. Child Neurol. 60 (7) (2018) 687-694.
- K. Himmelmann, V. Horber, J. De La Cruz, K. Horridge, V. Mejaski-Bosnjak, K. Hollody, et al., MRI classification system (MRICS) for children with cerebral palsy: development, reliability, and recommendations, Dev. Med. Child Neurol. 59 (1) (2017) 57-64.
- I. Krageloh-Mann, A. Helber, I. Mader, M. Staudt, M. Wolff, F. Groenendaal, et al., Bilateral lesions of thalamus and basal ganglia: origin and outcome, Dev. Med. Child Neurol. 44 (7) (2002) 477-484.
- O. Laporta-Hoyos, J. Ballester-Plane, D. Leiva, T. Ribas, J. Miralbell, C. Torroja-Nualart, et al., Executive function and general intellectual functioning in dyskinetic cerebral palsy: comparison with spastic cerebral palsy and typically developing controls, Eur. J. Paediatr. Neurol. : EJPN : Off. J. Eur. Paediatr. Neurol. Soc. 23 (4) (2019) 546-559.
- A. Crichton, M. Ditchfield, S. Gwini, M. Wallen, M. Thorley, J. Bracken, et al., Brain magnetic resonance imaging is a predictor of bimanual performance and executive function in children with unilateral cerebral palsy, Dev. Med. Child Neurol. 62 (5) (2020) 615-624. https://onlinelibrary.wiley.com/doi/10.1111/dmcn.14462.
- K. Stadskleiv, Cognitive functioning in children with cerebral palsy, Dev. Med. Child Neurol. 62 (3) (2020) 283-289.
- W.H. Organisation, International Classification of Functioning, Disability and Health, 2001. Geneva.
- D.W. Smits, J.W. Gorter, M. Ketelaar, P.E. Van Schie, A.J. Dallmeijer, E. Lindeman, et al., Relationship between gross motor capacity and daily-life mobility in children with cerebral palsy, Dev. Med. Child Neurol. 52 (3) (2010).
- G. Cioni, M.C. Di Paoo, B. Bertuccelli, P.B. Paolicelli, R. Canapicchi, MRI findings and sensorimotor development in infants with bilateral spastic cerebral palsy, Brain Dev. 19 (4) (1997) 245-253.
- P. Tellegen, M. Winkel, B. Wijnberg-Williams, J. Laros, Snijders-Oomen Nietverbale Intelligentietest, SON-R 21/2-7: Verantwoording en handleiding [Snijders-Oomen Nonverbal Intelligence Test, SON-R 21/2-7: Manual], Swets&Zeitlinger, Lisse, Netherlands, 1998.
- J.C. Raven, J.H. Court, Raven’s Progressive Matrices and Vocabulary Scales, Oxford psychologists Press, 1998.
- R. Palisano, P. Rosenbaum, S. Walter, D. Russell, E. Wood, B. Galuppi, Development and reliability of a system to classify gross motor function in children with cerebral palsy, Dev. Med. Child Neurol. 39 (4) (1997) 214-223.
- D.-W. Smits, J.W. Gorter, P.E. van Schie, A.J. Dallmeijer, M. Ketelaar, P.S. Group, How do changes in motor capacity, motor capability, and motor performance relate in children and adolescents with cerebral palsy? Arch. Phys. Med. Rehabil. 95 (8) (2014) 1577-1584.
- E. Arnfield, A. Guzzetta, R. Boyd, Relationship between brain structure on magnetic resonance imaging and motor outcomes in children with cerebral palsy: a systematic review, Res. Dev. Disabil. 34 (7) (2013) 2234-2250.
- R.L. Schalock, S.A. Borthwick-Duffy, V.J. Bradley, W.H. Buntinx, D.L. Coulter, E.M. Craig, et al., Intellectual Disability: Definition, Classification, and Systems of Supports, ERIC, 2010.
- G. Cioni, B. Bertuccelli, A. Boldrini, R. Canapicchi, B. Fazzi, A. Guzzetta, et al., Correlation between visual function, neurodevelopmental outcome, and magnetic resonance imaging findings in infants with periventricular leucomalacia, Arch. Dis. Child. Fetal Neonatal Ed. 82 (2) (2000) F134-F140.
- S.P. Miller, V. Ramaswamy, D. Michelson, A.J. Barkovich, B. Holshouser, N. Wycliffe, et al., Patterns of brain injury in term neonatal encephalopathy, J. Pediatr. 146 (4) (2005) 453-460.
- O. Laporta-Hoyos, K. Pannek, J. Ballester-Plane, L.B. Reid, E. Vazquez, I. Delgado, et al., White matter integrity in dyskinetic cerebral palsy: relationship with intelligence quotient and executive function, NeuroImag. Clinic. 15 (2017) 789-800.
- L.C. Weeke, F. Groenendaal, K. Mudigonda, M. Blennow, M.H. Lequin, L.C. Meiners, et al., A novel magnetic resonance imaging score predicts neurodevelopmental outcome after perinatal asphyxia and therapeutic hypothermia, J. Pediatr. 192 (2018) 33-40.e2.
- C.A. van Houdt, A.G. van Wassenaer-Leemhuis, J. Oosterlaan, A.H. van Kaam, C.S.H. Aarnoudse-Moens, Developmental outcomes of very preterm children with high parental education level, Early Hum. Dev. 133 (2019) 11-17.
- M. van Gorp, S.R. Hilberink, S. Noten, J.L. Benner, H.J. Stam, W.M.A. van der Slot, et al., Epidemiology of cerebral palsy in adulthood: a systematic review and meta-analysis of the most frequently studied outcomes, Arch. Phys. Med. Rehabil. 101 (6) (2020) 1041-1052, https://doi.org/10.1016/j.apmr.2020.01.009.
- I. Novak, C. Morgan, L. Adde, J. Blackman, R.N. Boyd, J. Brunstrom-Hernandez, et al., Early, accurate diagnosis and early intervention in cerebral palsy: advances in diagnosis and treatment, JAMA Pediatr. 171 (9) (2017) 897-907.