Czym jest rizartroza?
Rizartroza jest to zwyrodnienie stawu śródręczno-paliczkowego kciuka, prowadzące do znacznej utraty jego funkcji oraz często wiążące się z występowaniem znacznych dolegliwości bólowych.
Szacuje się, że kciuk zapewnia około 45% funkcji ręki. Jest on niezbędny w codziennych czynnościach oraz w pracach manualnych zapewniających części społeczeństwa możliwość wykonywania pracy zarobkowej. Kciuk jest właściwie niezbędny do pisania, szycia, odkręcania, otwierania oraz wykonywania wszelkich czynności precyzyjnych.
Poza dolegliwościami bólowymi w przebiegu rizartrozy dochodzi do znacznej sztywności kciuka i ustawienia go w pozycji zaburzającej przywiedzenie i wyprost. Do oceny stopnia zaawansownia tej patologii najczęściej stosuje się czterostopniową skalę rizartrozy według Eatona i Littlera1.
Skala rizartrozy wg. Eatona i Littlera
- W stadium I obserwuje się początki zwężenia szpary stawowej stawu śródręczno-paliczkowego kciuka.
- W fazie II dodatkowym objawem obserwowanym w diagnostyce obrazowej jest sklerotyzacja podchrzęstna kości.
- W stopniu III występują osteofity i dochodzi do dogrzbietowego zwichnięcia w stawie.
- W ostatnim, IV stadium zmiany zwyrodnieniowo-wytwórcze obejmują dodatkowo kość łódeczkowatą.
Rizartroza przyczynia się do znacznej niepełnosprawności funkcji ręki u osób powyżej 40. roku życia. W tej grupie wiekowej kryteria rozpoznania spełnia od 6 do 12% populacji2. Prawdopodobnymi czynnikami ryzyka jest nadmierna wiotkość stawów oraz obciążanie kciuka powtarzającą się, monotonną i ciężką pracą manualną.
Czy zastosowanie ortezy w leczeniu rizartrozy jest skuteczne?
Ze względu na ciężar choroby i znaczne pogorszenie jakości życia oraz ograniczenie możliwości wykonywania czynności manualnych poszukiwane są różne metody pozwalające na odciążenie stawu kciuka objętego chorobą zwyrodnieniową.
Jedną z możliwości odciążenia jest zastosowanie ortezy. Jedno z lepiej zaplanowanych badań nad zastosowaniem ortez w przebiegu rizartrozy zostało przeprowadzone przez zespół Monireha Baniego i opublikowane w 2013 roku w czasopiśmie "Disability and Rehabilitation: Assistive Technology"3.
Do udziału w badaniu zostali skierowani pacjenci z rozpoznaniem choroby zwyrodnieniowej stawu nadgarstkowo-śródręcznego kciuka 1. i 2. stopnia. W celu jak najlepszego doboru pacjentów opracowano kryteria włączające, które obejmowały: diagnozę na podstawie objawów klinicznych i obrazowych oraz bóle w okolicy podstawy kciuka.
Kryteria wyłączające z badania obejmowały:
- innego rodzaju deformacje ręki,
- zaburzenia anatomiczne dystalnego stawu międzypaliczkowego kciuka,
- używanie zaopatrzenia ortopedycznego kciuka w okresie ostatnich 6 miesięcy,
- zabiegi operacyjne ręki w ciągu ostatnich 6 miesięcy,
- uczulenie na materiał, z którego wykonana była szyna.
35 uczestników losowo przypisano do jednej z trzech grup:
- grupa 1: użytkowanie prefabrykowanych ortez na kciuk
- grupa 2: użytkowanie spersonalizowanych ortez na kciuk
- grupa 3: kontrolna.
Badanie zostało przeprowadzone w modelu krzyżowym (cross-over). Uwzględniono dwa czterotygodniowe okresy leczenia z dwutygodniowym okresem przerwy pomiędzy interwencjami. Grupa kontrolna była również obserwowana przez 10 tygodni.
Szyny zastosowano w celu stabilizacji stawu śródręczno-paliczkowego kciuka, pozostawiając jednocześnie swobodne ruchy paliczka dystalnego w celu zachowania funkcjonalności ręki. Szyny prefabrykowane wykonane były z pianki neoprenowej. Grubość materiału wynosiła 3,5 mm.
Spersonalizowana szyna została wykonana na podstawie wzorca dopasowanego do rozmiaru ręki pacjenta. Do jej wytworzenia wykorzystano materiał o grubości 1,6 mm, uzyskujący właściwości plastyczne w niskich temperaturach. Pacjentów poproszono o używanie szyn podczas codziennych czynności.
Badanymi parametrami były:
- natężenie bólu (oceniane za pomocą skali VAS),
- funkcja ręki (określana na podstawie kwestionariusza DASH: disabilities of the arm, shoulder and hand),
- siła chwytu (mierzona za pomocą dynamometru),
- chwyt boczny (również za pomocą dynamometru, w pozycji 90 stopni zgięcia łokcia i z nadgarstkiem w pozycji neutralnej pomiędzy supinacją i pronacją).
Pomiarów dokonywano na początku badania oraz w 4., 6. i 10. tygodniu.
Porównanie wyników badania skuteczności ortezy w leczeniu rizartrozy
Porównanie skuteczności ortezy po 4. tygodniu:
Obydwa rodzaje ortez przyczyniły się do istotnej statystycznie redukcji bólu (p = 0,0001) i wzrostu siły chwytu bocznego (p = 0,0001). Wynik na skali DASH poprawił się istotnie jedynie w grupie używającej ortezy prefabrykowanej, natomiast nie zmienił się w przypadku ortezy wykonanej na miarę. Nie stwierdzono również poprawy w zakresie siły chwytu w żadnej z grup.
Porównanie skuteczność ortezy po 6. tygodniu:
Po zakończeniu pierwszego czterotygodniowego okresu terapii zastosowano dwutygodniową przerwę mającą na celu sprawdzenie trwałości uzyskanego efektu. Nie wszystkie pozytywne zmiany związane z prowadzoną terapią zostały utrzymane.
Obniżenie poziomu bólu na istotnym statystycznie poziomie utrzymało się jedynie w grupie, która używała ortez wykonanych na miarę. Tym razem wynik w skali DASH był wyższy w grupie używającej ortezy robionej na miarę w porównaniu z grupą kontrolną.
Siła chwytu bocznego nadal była statystycznie istotnie wyższa w obydwu grupach stosujących ortezy w porównaniu z grupą kontrolną. W przeciwieństwie do tego siła ogólna chwytu w obydwu grupach badawczych nie była istotnie statystycznie wyższa niż w przypadku grupy kontrolnej.
Porównanie skuteczność ortezy po 10. tygodniu:
Obydwa rodzaje ortez – prefabrykowana oraz wykonana na miarę – skutecznie zredukowały dolegliwości bólowe w porównaniu z grupą kontrolną (p = 0,0001).
Zaobserwowano również istotną statystycznie poprawę w skali funkcjonalnej DASH oraz w zakresie chwytu bocznego w obydwu grupach eksperymentalnych (p = 0,0001). Przyrost siły ogólnej był nieznaczny i nie uzyskał istotności statystycznej w porównaniu z grupą kontrolną.
Porównanie między ortezą prefabrykowaną a wykonaną na miarę
Autorzy badania nie zaobserwowali różnicy w sile ogólnej, sile chwytu oraz funkcjach kończyny w zależności od zastosowania ortezy prefabrykowanej lub wykonanej na miarę.
W przeciwieństwie do tego zaobserwowano istotną różnicę w intensywności dolegliwości bólowych po 10. tygodniu badania. Były one istotnie statystycznie niższe w grupie używającej ortezy wykonanej na miarę.
Zaobserwowano przy tym ciekawą zależność. Po pierwszym pomiarze orteza spersonalizowana przyczyniała się do mniejszej redukcji bólu niż orteza standardowa. Po drugim pomiarze różnice te zostały zniwelowane, a obydwie ortezy były równie skuteczne w porównaniu z grupą kontrolną. Z kolei w trzecim pomiarze orteza indywidualna zdecydowanie bardziej przyczyniała się do redukcji bólu.
Podsumowując przytoczone badanie, można stwierdzić, że obydwa typy ortez znacząco przyczyniają się do redukcji bólu oraz poprawy funkcji ręki i siły specyficznego chwytu.
W długoterminowym łagodzeniu bólu skuteczniejsze wydaje się zastosowanie ortez wykonanych na miarę. Żaden z przebadanych typów ortez nie przyczynił się do poprawy ogólnej siły chwytu.
Być może czas unieruchomienia związany z użytkowaniem ortezy przyczynia się od atrofii mięśniowej utrudniającej przyrost siły chwytu. W związku z tym zastosowanie stabilizatora nigdy nie powinno być jedyną formą terapii.
Konieczne jest wdrożenie technik fizjoterapeutycznych pomagających zachować funkcję kciuka, ręki i całej kończyny górnej. Orteza może być natomiast bardzo dobrą pomocą, ułatwiającą funkcjonowanie pacjenta w codziennym życiu i przyczyniającą się do łagodzenia dolegliwości bólowych.
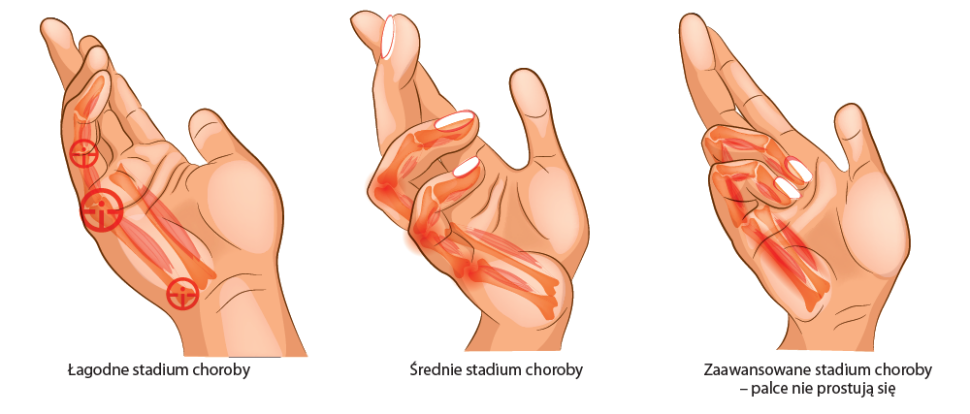
Przykurcz Dupuytrena - objawy
Przykurcz Dupuytrena jest chorobą, w przebiegu której dochodzi od zwłóknienia rozcięgna dłoniowego. Początkowym objawem jest zgrubienie skóry dłoni oraz pojawienie się ciastowatego obrzęku.
Już we wczesnym stadium można zazwyczaj rozpoznać występowanie guzka lub guzków, które, choć nie są bolesne, łączą ze sobą warstwy skóry i powięzi głębokiej, ograniczając coraz bardziej zakres ruchomości.
Z biegiem czasu guzek zmienia swoją postać – przypomina twardy sznurek, który stopniowo wciąż grubieje i twardnieje, obejmując staw śródręczno-paliczkowy oraz międzypaliczkowy bliższy. Najczęściej zaatakowany jest palec serdeczny lub mały, aczkolwiek problem może dotyczyć każdego palca.
Choroba początkowo rozwija się jednostronnie, natomiast nierzadko przechodzi w postać dwustronną. Częstość występowania w populacji jest bardzo zróżnicowana: od 2% do 42% w niektórych społecznościach4.
Często stwierdza się predyspozycje rodzinne do zachorowania. Etiologia tej jednostki chorobowej nadal nie została należycie poznana. Jest ona często klasyfikowana do nadrzędnej kategorii bliznowców, a proliferacja fibroblastów jest jedną z głównych cech mikroskopowych.
Przykurcz Dupuytrena dotyka głównie starszych mężczyzn pochodzenia europejskiego. Dolegliwość stwierdza się głównie wśród ludności północnoeuropejskiej. Średnia wieku wystąpienia zachorowania wynosi: 55 lat u mężczyzn i 65 lat u kobiet.
Początkowe stadia choroby pod pewnymi względami przypominają procesy złośliwe, takie jak np. włókniakomięsak, jednak sama zmiana nie ulega zezłośliwieniu. Podobne procesy mogą występować nie tylko w obszarze strony dłoniowej ręki, lecz również podeszwy stopy (choroba Ledderhose’a) oraz grzbietowej strony penisa (choroba Peyroniego).
W przypadku przykurczu Dupuytrena występują ograniczenia funkcjonalne (w zakresie wykonywania prac manualnych oraz codziennych czynności) oraz problemy natury kosmetycznej. Częściowa utrata funkcji ręki, niedogodności w sytuacjach społecznych (podawanie ręki) i zakłopotanie wyglądem mogą przyczyniać się do znacznego dyskomfortu psychicznego.
Terapia przykurczu Dupuytrena jest uzależniona od stopnia jego nasilenia i subiektywnej uciążliwości objawów. Główną metodą postępowania jest leczenie chirurgiczne, chociaż zazwyczaj nie jest ono niezbędne.
Stosowane są również różne modalności fizykoterapeutyczne, mogące w znacznym stopniu poprawić jakość życia pacjentów z tą przypadłością. Jedną z najczęściej stosowanych form terapii zachowawczej przykurczu Dupuytrena jest fala uderzeniowa.
Na początku 2021 roku zostało opublikowane badanie przeprowadzone przez zespół Karstena Knoblocha, podejmujące tematykę zastosowania fali uderzeniowej w omawianej jednostce chorobowej5.
Zastosowanie fali uderzeniowej w przykurczu Dupuytrena
Zewnątrzustrojowa fala uderzeniowa jest formą terapii zachowawczej, wykorzystuje falę akustyczną, wytwarzającą gwałtowną zmianę ciśnienia. Pozwala ona w sposób mechaniczny dokonywać mikrouszkodzeń struktur tkankowych.
Zgodnie z logiką takiego rozumowania wprowadzone sztucznie zmiany tkankowe mają pobudzić komórki do przebudowy i zmian strukturalnych w pożądanym kierunku.
W omawianym badaniu uczestniczyło 52 pacjentów o średniej wieku równej 58 lat, a 62% z nich stanowili mężczyźni. Średni czas trwania choroby przed przystąpieniem do badania wynosił 40 miesięcy.
27 osób zostało w randomizowany sposób przydzielonych do grupy badawczej z wykorzystaniem fali uderzeniowej, a pozostałych 27 osób znalazło się w grupie kontrolnej. W grupie badawczej zastosowano skupioną falę uderzeniową emitującą 2000 impulsów o gęstości energii 0,35mJ/mm2.
Pacjentów poddano 3 sesjom terapii w cotygodniowych odstępach. W grupie kontrolnej zastosowano podobny schemat postępowania, jednak gęstość energii dostarczanej do tkanek była zbyt niska, aby wywołać jakikolwiek efekt terapeutyczny.
W terapii pozorowanej pacjenci otrzymywali 2000 impulsów o gęstości energii 0,01mJ/mm2 podczas każdej z trzech cotygodniowych sesji. Ocena skuteczności zastosowania fali uderzeniowej dokonywana była po 3, 6, 12 i 18 miesiącach od ostatniego zabiegu.
W analizie wyników uwzględniono następujące parametry:
- nasilenie bólu
- skalę DASH (disabilities of the arm, shoulder and hand) zawierającą 30 pytań o codzienne czynności angażujące funkcje ręki (np. otwieranie słoika, przekręcanie klucza)
- kwestionariusz funkcji ręki (MHQ)
- skalę reumatologiczną URAM
- siłę chwytu [kg]
- stopień zadowolenia pacjenta.
Traktując początkowy stopień nasilenia bólu jako 0, u pacjentów z grupy kontrolnej obserwowano jego nasilenie nawet do 40% po upływie 12 miesięcy. W przeciwieństwie do tego ból w grupie poddanej terapii za pomocą fali uderzeniowej zmalał.
Najbardziej zauważalny spadek bólu zaobserwowano po 6 miesiącach (o 60%), jednak także po 18 miesiącach wynosił on ponad 50%. Różnica ta była wysoce istotna statystycznie.
Analogiczną sytuację zaobserwowano w przypadku kwestionariusza MHQ: po 18 miesiącach pogorszenie w grupie kontrolnej wynosiło ponad 5%. Największa poprawa w grupie badawczej wystąpiła po 6 miesiącach (ponad 10%) i utrzymywała się na poziomie ponad 5% po 18 miesiącach.
Wynik na skali URAM nie zmienił się w grupie badawczej, natomiast pogorszył się w grupie kontrolnej. Siła chwytu nie uległa zmianie w żadnej z grup. Satysfakcja pacjentów leczonych falą uderzeniową wynosiła 56% w odniesieniu do złagodzenia objawów oraz 59% w odniesieniu do zahamowania progresji choroby. Uwzględniając te same kategorie, zadowolenie pacjentów w grupie kontrolnej wynosiło odpowiednio 12% i 24%.
Wnioski z przytoczonego badania wydają się jednoznaczne: zastosowanie fali uderzeniowej w przypadku przykurczu Dupuytrena łagodzi ból, poprawia funkcję ręki oraz zwiększa jakość życia i przyczynia się do większej satysfakcji pacjentów.
Aby osiągnąć taki wynik, wystarczające jest przeprowadzenie jedynie trzech zabiegów w miesięcznych odstępach. Efekty są trwałe i utrzymują się na podobnym poziomie przynajmniej przez 18 miesięcy.
Fala uderzeniowa jest bezpiecznym, skutecznym i ekonomicznym sposobem zachowawczej terapii przykurczu Dupuytrena i jako taka z pewnością może być zalecana przy tej dolegliwości.
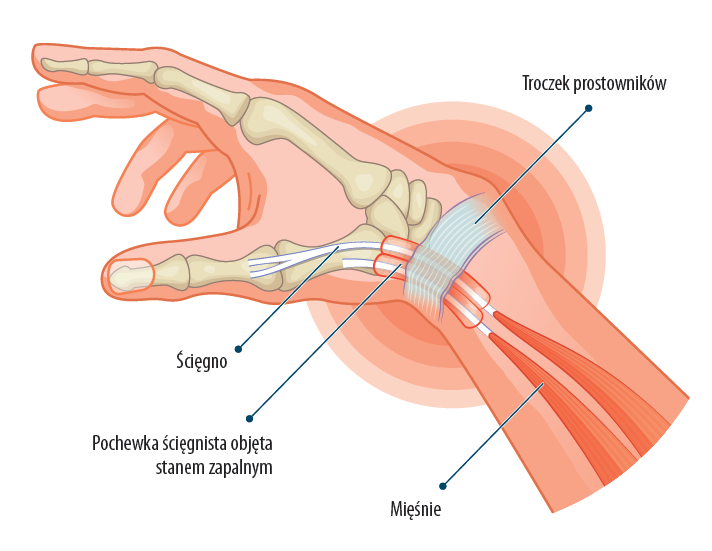
Choroba de Quervaina - objawy i przyczyny
Jest to zapalenie pochewki ścięgnistej okolicy wyrostka rylcowatego kości promieniowej. Rozwija się w okolicy okołonadgarstkowej ścięgien mięśnia odwodziciela długiego kciuka oraz prostownika krótkiego kciuka.
Ból oraz objęcie stanem zapalnym ścięgien jest przyczyną zaburzeń funkcjonalnych: chory z dużym trudem i przy znacznym osłabieniu wykonuje czynności wymagające chwytu z zaciśniętą pięścią, chwytu precyzyjnego oraz przytrzymywania przedmiotów przy pomocy kciuka.
Osoby cierpiące z powodu choroby de Quervaina starają się ochronić bolesne, zmienione chorobowo miejsce. Ból pojawiający się nagle, przy rozciągnięciu ścięgien, powoduje częste upuszczanie przedmiotów i niezręczność.
Symptomy pojawiają się zazwyczaj powoli i mają charakter przeciążeniowy, związany z powtarzanymi ruchami wyżymania, szycia na drutach, szydełkowania, używania śrubokrętu, klucza lub innych narzędzi.
Przyczyną wystąpienia mogą być także zmiany hormonalne występujące głównie w III trymestrze ciąży, charakteryzujące się rozluźnieniem tkanek łącznych oraz gromadzeniem się obrzęków. Przeciążenia są również typowe dla młodych mam wykonujących czynności pielęgnacyjne u swojego dziecka.
Niektóre sporty wymagające gwałtownego przyspieszenia i zmiany kierunku pracy ręki i nadgarstka (np. golf, rzut młotem, sporty rakietowe, wędkarstwo) mogą predysponować do rozwoju tego schorzenia.
Problem coraz bardziej narasta w związku ze współczesnym stylem życia – nadwyrężaniem okolicy nadgarstka w pracy, podczas korzystania z telefonów komórkowych i grania w gry wideo.
Patogeneza związana jest z pojawieniem się włóknistego zgrubienia pochewki ścięgnistej w okolicy wyrostka rylcowatego kości promieniowej, któremu mogą towarzyszyć ogniskowe zmiany kostne. W badaniu ultrasonograficznym obserwuje się również zwiększone unaczynienie pochewki ścięgnistej.
Podczas zbierania wywiadu i przeprowadzania diagnostyki należy zwrócić szczególną uwagę na jakiekolwiek urazy ręki i kciuka oraz stany zapalne okolicy nadgarstka i palców. Istotne jest uzyskanie informacji odnośnie do chorób towarzyszących, np. cukrzycy, niewydolności serca. Ważne jest uzyskanie informacji o wykonywanej pracy, aktywności sportowej i hobby.
W badaniu przedmiotowym przeprowadza się ocenę wizualną oraz zakresu ruchomości. Badana jest funkcjonalna ruchomość nadgarstka i kciuka oraz ruchy bierne rozciągające zaatakowane struktury. Typowymi testami klinicznymi stosowanymi w rozpoznaniu choroby de Quervaina są test Finkelsteina i test Brunellego.
Podczas wykonywania testu Finkelsteina pacjent mocno zaciska kciuk w pięści, natomiast terapeuta biernie wprowadza odchylenie dołokciowe nadgarstka, rozciągając w ten sposób nadwyrężone struktury. Wynik badania jest dodatni, jeżeli test sprowokuje dolegliwości bólowe. Test Brunellego jest pozytywny, gdy oporowane odwiedzenie kciuka podczas aktywnego zgięcia nadgarstka odtwarza dolegliwości pacjenta.
Rozpoznanie stawiane jest zazwyczaj na podstawie obrazu klinicznego, a diagnostyka obrazowa może mieć charakter uzupełniający, raczej w celu wykluczenia innej patologii mogącej podszywać się pod chorobę de Quervaina.
Zdjęcie rentgenowskie może być pomocne w wykluczeniu złamania lub zwichnięcia kości nadgarstka, rezonans magnetyczny rzadko jest konieczny w przypadku niejasnej diagnozy, a badanie ultrasonograficzne pozwala ocenić stopień obrzęku i przygotować pacjenta do ewentualnych bardziej inwazyjnych form leczenia, natomiast badanie dopplerowskie ukazuje stopień zaawansowania neowaskularyzacji.
Wynik w skali DASH, oceniający jakość życia w odniesieniu do funkcji ręki, poprawiał się istotnie statystycznie w grupie leczonej falą uderzeniową, natomiast ulegał sukcesywnemu pogorszeniu u pacjentów z grupy kontrolnej.
Leczenie ma zwykle charakter zachowawczy i może obejmować różne modalności przyczyniające się do odciążenia okolicy nadgarstka i złagodzenia objawów.
Choroba de Quervaina
Zapalenie pochewek ścięgnistych i ścięgien mięśni kontrolujących ruchy kciuka
Leczenie choroby de Quervaina
Wstrzyknięcia sterydowe u osób z chorobą de Quervaina
W 2014 roku Muhammad Omer Ashraf i V.G. Devadoss opublikowali przegląd systematyczny i metaanalizę skuteczności wstrzyknięć środków sterydowych w przypadku choroby de Quervaina u osób dorosłych. Autorzy poddali pogłębionej analizie 12 badań6. Poniżej przytaczamy niektóre ze stwierdzeń zawartych w ich artykule.
- Badanie Witta i wsp. z wykorzystaniem środka sterydowego oraz lokalnego leku sterydowego, wraz z okresem unieruchomienia zapewniającego odciążenie, było skuteczne u 62% badanych, a efekt utrzymywał się przez 18 miesięcy. Badanie przeprowadzono na 87 nadgarstkach zaatakowanych przez chorobę de Quervaina.
- McKenzie, stosując analogiczny sposób postępowania terapeutycznego, zaobserwował skuteczność wynoszącą 93%, a uzyskany efekt również utrzymywał się przez 18 miesięcy.
- Anderson, przebadawszy 55 pacjentów po 4 latach od zakończenia interwencji, opisał odsetek wyleczenia na poziomie 90%.
- Richie i Briner przebadali największą liczbę nadgarstków (n = 226) i stwierdzili ustąpienie dolegliwości bólowych u 83% pacjentów.
Choroba de Quervaina charakteryzuje się obrzękiem i bólem w okolicy podstawy kciuka, który powoduje odchylenie dołokciowe nadgarstka oraz odwiedzenie kciuka.
Ogólne wyniki terapii sterydowej były bardzo dobre. Obserwowano tylko nieliczne i z reguły łagodne skutki uboczne; najpoważniejszymi były – w pojedynczych przypadkach – osłabienie siły chwytu i zapalenie żył powierzchownych. Wymienionych skutków ubocznych pozbawione były metody postępowania fizjoterapeutycznego.
Zastosowanie lasera niskoenergetycznego i ultradźwięków w leczeniu choroby de Quervaina
W 2015 roku zespół Renu Sharmy opublikował badanie porównujące skuteczność zastosowania lasera niskoenergetycznego i ultradźwięków w przypadku choroby de Quervaina7.
W badaniu uczestniczyło 30 osób, przydzielonych w randomizowany sposób do jednej z dwóch grup interwencyjnych. Jedna grupa otrzymywała zabiegi laseroterapii, podczas gdy u drugiej stosowano ultradźwięki; przeprowadzono po 7 zabiegów co drugi dzień. Ocenie poddawano wynik testu Finkelsteina, tkliwość w okolicy wyrostka rylcowatego kości promieniowej, siłę chwytu oraz ból.
Istotną poprawę zaobserwowano w przypadku obydwu grup w odniesieniu do skali tkliwości, siły chwytu oraz natężenia dolegliwości bólowych mierzonego za pomocą skali VAS.
Szczególnie interesujący był wzrost siły chwytu. Parametr ten wzrósł ze 120 mmHg do 160 mmHg w grupie leczonej za pomocą ultradźwięków oraz ze 120 mmHg do 140 mmHg w przypadku laseroterapii. W obydwu grupach wynik był istotny statystycznie, przy czym zaobserwowano również istotną różnicę na korzyść grupy otrzymującej ultradźwięki.
Wynik testu Finkelsteina oraz badania ultrasonograficzne nie wykazały znaczącej różnicy pomiędzy grupami ani względem sytuacji początkowej. Z przytoczonego badania wynika, że zastosowanie lasera niskoenergetycznego i ultradźwięków może przynieść ulgę w dolegliwościach bólowych i poprawić funkcję (siłę chwytu ręki) u osób z chorobą de Quervaina.
Jednocześnie warto podkreślić, że postępowanie fizykoterapeutyczne pozbawione jest potencjalnych skutków ubocznych mogących powstawać w następstwie wdrażania bardziej inwazyjnych form leczenia.
Porównanie kinezjotapingu z innymi modalnościami fizykoterapeutycznymi w leczeniu choroby de Quervaina
W 2013 roku zespół Keynoosh Homayouni dokonał porównania skuteczności kinezjotapingu i innych form fizykoterapii w przypadku choroby de Quervaina8. Badacze dokonali selekcji 60 pacjentów, spośród których w sposób randomizowany utworzyli równoliczne grupy.
W grupie oznaczonej jako "fizjoterapia" wykonywano następujące zabiegi:
- kąpiele parafinowe (sesje 10-minutowe)
- ultradźwięki (1 MHz, 1 W/cm2, 20 minut)
- TENS (4 Hz, 200 milisekund, 5 minut).
W grupie z kinezjotapingiem zastosowano oklejanie mające na celu odciążenie odwodziciela długiego kciuka i prostownika krótkiego kciuka (z siłą naciągu równą 70%). Aplikacja zawierała również korekcję funkcjonalną polegającą na wyproście nadgarstka. Ostatni pasek taśmy został naklejony jako tzw. korekcja przestrzenna.
Czas prowadzenia terapii w obydwu grupach wynosił 1 miesiąc. Ocenianymi parametrami zmiany były ból oraz obrzęk.
W grupie kinezjotapingu zaobserwowano spadek bólu z 58 do 13 punktów w skali VAS (p < 0,001). W grupie otrzymującej inne modalności fizykoterapeutyczne nasilenie bólu zmieniło się z 56 do 18 punktów (p < 0,001). Chociaż w obydwu grupach zmiany były istotne, zaobserwowano również istotną statystycznie różnicę między grupami na korzyść kinezjotapingu.
Obrzęk uległ istotnemu zmniejszeniu u 73% pacjentów z kinezjotapingiem oraz u 19% pacjentów stosujących inne zabiegi fizykoterapeutyczne.
Wyniki opisanego badania wskazują, że kompleksowe zabiegi z zakresu fizykoterapii są skuteczne w łagodzeniu bólu związanego z chorobą de Quervaina. Kinezjotaping poza łagodzeniem bólu przyczyniał się również do zmniejszenia obrzęku.
Obydwa sposoby postępowania są godne rozważenia u pacjentów z omawianą jednostką chorobową. Ich dobór powinien być zdeterminowany sytuacją pacjenta oraz dostępnymi środkami terapeutycznymi. Fizjoterapeuta ma możliwość zaproponowania pacjentowi różnych rozwiązań, których skuteczność została potwierdzona w badaniu.
Czym jest zespół cieśni nadgarstka?
Zespół cieśni nadgarstka jest dolegliwością nerwu pośrodkowego, który ulega kompresji w kanale nadgarstka. Obszar dolegliwości może być różny ze względu na różnice anatomiczne i miejsce podziału nerwu.
W najczęstszej postaci pacjenci zgłaszają się z bólem, odrętwieniem i parestezjami w obszarze zaopatrywanym przez nerw pośrodkowy, czyli głównie po stronie dłoniowej ręki oraz kciuka (w tym kłębu), palca wskazującego, środkowego i połowy palca serdecznego.
Szacuje się, że problem ten dotyczy 4–5% populacji, częściej kobiet (zachorowalność: 193 na 100 000) niż mężczyzn (zachorowalność: 88 na 100 000)9. Szczyt zachorowań u kobiet przypada na czwartą i piątą dekadę życia, natomiast u mężczyzn – na siódmą i ósmą10.
Do zaburzeń funkcji nerwu pośrodkowego w obszarze nadgarstka dochodzi w wyniku wzrostu ucisku nerwu i jego niedokrwienia. Podczas gdy normalne ciśnienie, jakie toleruje nerw pośrodkowy, wynosi od 2 do 10 mmHg, zmiany ustawienia nadgarstka powodują jego znaczny wzrost.
Szacuje się, że wyprost powoduje dziesięciokrotny wzrost kompresji, natomiast zgięcie – ośmiokrotny11. Zwiększona kompresja powoduje nie tylko niedokrwienie, lecz także podrażnienie struktur mogące skutkować stanem zapalnym, lokalnym obrzękiem i w rezultacie jeszcze znaczniejszym zmniejszeniem przestrzeni i swobody ruchu nerwu pośrodkowego.
Ze względu na przytoczony patomechanizm na wystąpienie zespołu cieśni nadgarstka najbardziej narażone są osoby wykonujące powtarzające się, monotonne ruchy nadgarstka w kierunku zgięcia i wyprostu.
Istotnym czynnikiem sprzyjającym pojawieniu się dolegliwości jest ekspozycja kończyn górnych na wibracje (praca za pomocą młota pneumatycznego, wiertarki udarowej itd.). Istotne znaczenie mogą mieć również czynniki wewnątrzpochodne, związane z gromadzeniem się płynów w obszarze nadgarstka, takie jak ciąża, menopauza, niedoczynność tarczycy, choroby nerek itd.
Ważne jest również ustalenie, czy u pacjenta występują patologie mogące wpływać na stan układu nerwowego, takie jak cukrzyca, niedobory witamin czy kontakt z neurotoksynami.
Zespół cieśni nadgarstka - diagnostyka
Poza zebraniem szczegółowego wywiadu w badaniu przesiewowym pod kątem zespołu cieśni nadgarstka najczęściej wykonywane są dwa testy: Tinela i Phalena.
Test Tinela polega na opukiwaniu obszaru kanału nadgarstka. Wynik jest dodatni, jeżeli manewr ten przyczyni się do wystąpienia symptomów w obszarze zaopatrzenia nerwu pośrodkowego.
W teście Phalena pacjent łączy ze sobą strony grzbietowe rąk, zginając nadgarstki pod kątem 90 stopni. Pozycja ta utrzymywana jest przez minutę. Jeżeli sprowokuje ona dolegliwości, z dużym prawdopodobieństwem można podejrzewać zespół cieśni nadgarstka.
W przypadku 80% pacjentów zachowawcze leczenie zespołu cieśni nadgarstka daje pozytywne rezultaty. Najistotniejsze znaczenie ma usunięcie czynników drażniących nerw oraz ochrona nadgarstka.
Czasami stosowany jest odwrócony test, podczas którego pacjent łączy ręce stronami dłoniowymi, maksymalnie prostując nadgarstki. Interpretacja testu jest podobna jak w przypadku testu Phalena, aczkolwiek zalecane jest wykonywanie standardowego testu Phalena ze względu na jego wysoką czułość, specyficzność i łatwość przeprowadzenia oraz interpretacji.
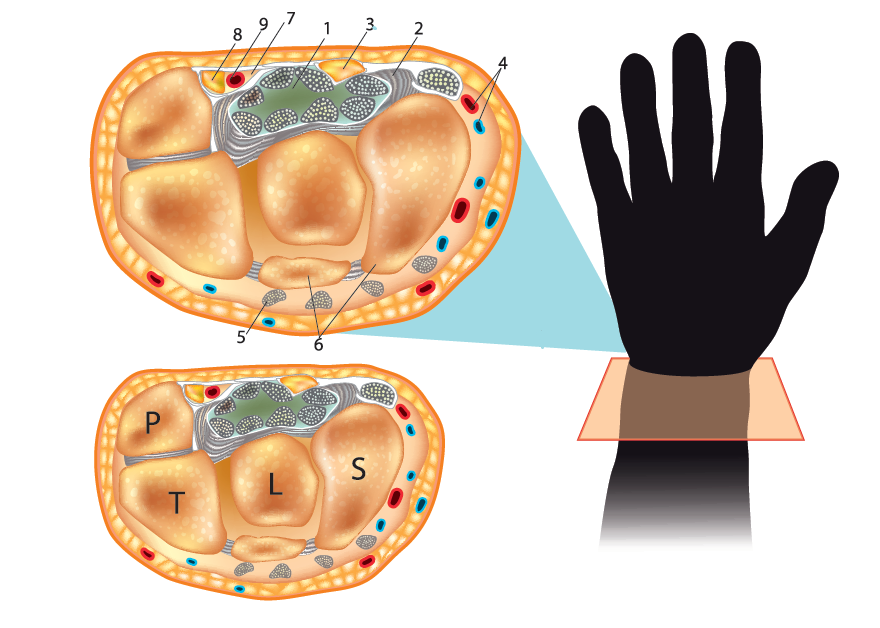
Budowa nadgarstka
- Kanał nadgarstka
- Więz. poprzeczne nadgarstka
- N. pośrodkowy
- Naczynia krwionośne
- Ścięgna
- Kości nadgarstka:
- P – kość grochowata
- T – kość trójgraniasta
- L – kość księżycowata
- S – kość łódeczkowata
- Kanał Guyona
- N. łokciowy
- T. łokciowa
Jak leczyć zespół cieśni nadgarstka?
Jeżeli występuje choroba podstawowa prowokująca problem nerwu pośrodkowego, należy dążyć do jej wyeliminowania lub ograniczenia negatywnego wpływu. W przypadku niedoborów witamin i mikroskładników zaleca się ich uzupełnianie. Miejscowo podawane są również leki sterydowe, wykonywana jest terapia manualna, zalecane są ćwiczenia.
Niestety objawy zespołu cieśni nadgarstka mają tendencję do nawracania już w ciągu jednego roku, nawet jeżeli leczenie zachowawcze zakończyło się pełnym ustąpieniem dolegliwości.
W niektórych przypadkach wykonywany jest zabieg chirurgiczny odbarczenia nerwu. W 2020 roku ukazał się przegląd literatury Aichy Zaralievy i wsp. dotyczący modalności fizykoterapeutycznych powszechnie stosowanych jako metody pomocnicze w leczeniu zespołu cieśni nadgarstka12.
Wśród metod leczenie cieśni nadgarstka badacze wymienili:
- terapię za pomocą bardzo wysokich częstotliwości
- laseroterapię niskoenergetyczną i wysokoenergetyczną
- pole magnetyczne o niskiej częstotliwości
- jonoforezę.
Zabiegi te wspomagająco stosowane są również w polskich ośrodkach leczniczych, zwykle jako terapia łączona, w seriach składających się z 10–15 zabiegów.
Jak wspomniano powyżej, kompleksowe podejście terapeutyczne zazwyczaj jest skuteczne, jednak w przypadku nieusunięcia czynników drażniących i chorób podstawowych objawy mają tendencję do nawrotów.
Czym jest ręka spastyczna w porażeniu mózgowym?
Spastyczność kończyny górnej może być cechą charakterystyczną jednej z wielu form dziecięcego porażenia mózgowego. Patofizjologia tego zaburzenia związana jest z brakiem oddziaływania hamującego, jakie w normalnej sytuacji wywiera górny neuron ruchowy względem motoneuronu dolnego. W rezultacie dochodzi do przewagi zginaczy jako wyjściowo dominującej i silniejszej grupy mięśniowej oraz do wygórowania odruchów.
Spastyczność w dziecięcym porażeniu mózgowym obejmuje zginacze nadgarstka i palców, co w znacznej mierze ogranicza funkcjonalne wykorzystanie ręki jako narządu manipulacyjnego, pozwalającego wykonywać codzienne czynności.
Przetrwałe ustawienie zgięciowe wynikające ze spastyczności powoduje przykurcze oraz doprowadza do deformacji rosnącej kończyny, w tym ręki, która staje się w jeszcze większej mierze pozbawiona podstawowych funkcji, w tym funkcji chwytnej, oraz motoryki precyzyjnej (np. możliwości pisania). Przykurczom i deformacjom towarzyszy ból oraz cierpienie psychofizyczne.
Aby chociaż trochę ulżyć pacjentom, zostały opracowane różne podejścia terapeutyczne mające na celu złagodzenie spastyczności i przykurczów, ograniczenie deformacji, zmniejszenie bólu oraz możliwie pełne, adekwatnie do przypadku, utrzymanie sprawności ręki. Możliwości leczenia obejmują zabiegi chirurgiczne, farmakoterapię, kinezyterapię, terapię zajęciową oraz określoną grupę zabiegów fizykoterapeutycznych.
Poniżej chcemy skupić się na tych możliwościach, jakie daje farmakoterapia miejscowa oraz środki fizykalne. Rozwiązania te stanowią istotną pomoc dla fizjoterapeutów, natomiast ich wykorzystanie w zaburzeniach neurologicznych, w tym w dziecięcym porażeniu mózgowym, wydaje się niewystarczająco rozpowszechnione w stosunku do korzyści, jakie mogą one przynieść.
Metody leczenia ręki spastycznej w porażeniu mózgowym
Toksyna botulinowa w terapii ręki spastycznej w porażeniu mózgowym
Terapia spastyczności w przypadku dziecięcego porażenia mózgowego może mieć charakter układowy lub miejscowy. W przypadku leczenia układowego stosuje się najczęściej baklofen lub diazepam. Nie wszystkie środki mogą być podawane przez długi czas oraz często są przyczyną istotnych skutków ubocznych, wśród których wymienia się m.in. nudności, wymioty, poczucie zmęczenia, zawroty głowy, stany depresyjne, zamglenie umysłowe i wiele innych.
Z tego powodu w adekwatnych sytuacjach dąży się do stosowania leczenia miejscowego, za pomocą którego można oddziaływać selektywnie na problematyczne mięśnie. Postępowanie takie dotyczy także ręki spastycznej w przebiegu niektórych postaci dziecięcego porażenia mózgowego.
Leczenie lokalne polega na podawaniu botuliny. Według Rosenbauma i wsp.13 ograniczenie spastyczności ręki w przypadku dziecięcego porażenia mózgowego jest koniecznością, ponieważ pozwala w sposób bardziej efektywny wykorzystywać zachowane umiejętności selektywnej kontroli motorycznej oraz ułatwia prowadzenie fizjoterapii nakierowanej na ich utrzymanie i rozwój.
Wykazano również korzystny wpływ botuliny na ogniskową nadaktywność mięśni i związane z nią dolegliwości bólowe14. Wśród białek produkowanych przez Clostridium botulinum znajduje się neurotoksyna botulinowa oddziałująca na płytkę nerwowo-mięśniową. W wyniku jej działania dochodzi do hamowania uwalniania acetylocholiny na zakończeniach nerwowych, co ogranicza skurcz mięśnia.
W przypadku gdy preparat zostanie podany we właściwy sposób, ewentualne skutki uboczne są rzadkie i zazwyczaj łagodne15. W literaturze przedmiotu wymienia się różne miejsca aplikacji botuliny w obrębie kończyny górnej pacjentów z dziecięcym porażeniem mózgowym. Miejsca te wybiera się w zależności od stopnia spastyczności i ograniczeń funkcjonalnych16.
W odniesieniu do funkcji ręki miejscami aplikacji botuliny są najczęściej:
- m. zginacz promieniowy nadgarstka,
- m. zginacz łokciowy nadgarstka,
- przywodziciel kciuka
Należy jednak pamiętać, że nasilona spastyczność innych mięśni kończyny górnej może bezpośrednio wpływać na zaburzenia funkcji ręki, w związku z tym botulina często podawana jest lokalnie także do innych mięśni. Zmniejszenie spastyczności znacznie poprawia jakość życia pacjentów oraz ułatwia utrzymanie sprawności ręki i jej poprawę.
Krioterapia w ręce spastycznej
Krioterapia poza łagodzeniem dolegliwości bólowych może być stosowana w celu regulacji napięcia mięśniowego. Efekt ten w przypadku spastyczności nie jest trwały, jednak zapewnia powstanie okna terapeutycznego, podczas którego możliwe jest bardziej wydajne przeprowadzenie sesji kinezyterapii i terapii zajęciowej.
Krioterapia przyczynia się również do zmniejszenia obrzęków oraz przyspiesza procesy regeneracyjne. Właściwości te mogą być pożądane w przypadku zaburzeń trofiki ręki objętej spastycznością.
Skuteczność terapii z wykorzystaniem zimna u pacjentów z dziecięcym porażeniem mózgowym została przebadana przez zespół Gehana M. Abd El-Maksouda, a wyniki badania opublikowano w 2011 roku w "Journal of Advanced Research"17.
W badaniu uczestniczyło 30 dzieci ze spastyczną postacią porażenia mózgowego w wieku od 4 do 6 lat. U 18 z nich występowała diplegia, a u pozostałych 12 – tetraplegia. Dzieci zostały w sposób randomizowany przydzielone do dwóch równolicznych grup o podobnej charakterystyce pod względem stopnia zaawansowania niepełnosprawności.
U każdego dziecka oceniano poziom spastyczności (za pomocą zmodyfikowanej skali Ashwortha, MAS), zakres ruchomości wyprostu łokcia i nadgarstka (przy użyciu elektronicznego goniometru) oraz poziom zdolności ruchowych w zakresie motoryki małej i dużej (za pomocą skali rozwoju motorycznego Peabody).
Pomiar wymienionych parametrów przeprowadzany był przed rozpoczęciem terapii oraz pod koniec trzymiesięcznego leczenia. Obydwie grupy – eksperymentalna i porównawcza – otrzymywały taką samą fizjoterapię oraz terapię zajęciową, które realizowane były w ciągu dwugodzinnych sesji odbywających się 3 razy w tygodniu przez 3 miesiące.
Sesje terapeutyczne obejmowały ćwiczenia biernej ruchomości łokcia, nadgarstka i palców w kierunku wyprostu, ćwiczenia propriocepcji, stymulowanie wzorca wyprostnego kończyny górnej ze szczególnym uwzględnieniem ręki, wzmacnianie grup mięśniowych przeciwdziałających spastyczności oraz specyficzny trening ręki obejmujący sięganie, chwytanie oraz bardziej precyzyjne czynności manipulacyjne wykonywane jednorącz i oburącz.
W grupie eksperymentalnej każda sesja poprzedzona była miejscowym zastosowaniem zimna. Przed przystąpieniem do serii zabiegów terapeuta sprawdzał zdolność odczuwania temperatury przez dzieci, aby zapewnić bezpieczeństwo przebiegu leczenia.
W wyniku przeprowadzonej terapii istotne obniżenie spastyczności wystąpiło u 13 spośród 15 dzieci w grupie eksperymentalnej, natomiast u dwojga sytuacja pozostała niezmieniona. W grupie kontrolnej spastyczność obniżyła się u 10 dzieci, a u 5 pozostała na tym samym poziomie. Obydwa wyniki były wysoce istotne statystycznie.
Zaobserwowano jednak także efekt grupy, świadczący o statystycznie istotnie większej poprawie w grupie eksperymentalnej, w której główną część terapii poprzedzono zastosowaniem zimna. Również w przypadku zakresu wyprostu łokcia i nadgarstka w obydwu grupach wystąpiła poprawa, natomiast efekt był statystycznie lepszy w grupie eksperymentalnej.
Ze skali rozwoju motorycznego Peabody badacze ocenili część dotyczącą motoryki precyzyjnej jako tę, która dostarcza najbardziej wiarygodnych informacji o zachodzących zmianach. Obydwie grupy odniosły istotne korzyści terapeutyczne, lecz także w tym przypadku grupa eksperymentalna osiągnęła wyraźnie lepsze wyniki niż kontrolna.
Na podstawie przytoczonego badania można stwierdzić, że terapeutyczne zastosowanie zimna, poprzedzające właściwą formę terapii, może zwiększyć jej skuteczność. Tym niemniej wszelkie formy krioterapii pozostają uzupełnieniem kinezyterapii i terapii zajęciowej, i ich zastosowanie ma jedynie sens w połączeniu z nimi. Zastosowanie zimna krótkotrwale obniża poziom spastyczności, zapewniając terapeucie przestrzeń na skuteczniejsze wdrożenie programu usprawniania.
Obrzęk ręki po udarze
Zgodnie z danymi dostępnymi w literaturze przedmiotu obrzęk ręki występuje u 18,5% pacjentów w ostrej fazie po udarze mózgu oraz u 37% w fazie przewlekłej18.
Do chwili obecnej patomechanizm doprowadzający do występowania obrzęku ręki nie został dokładnie poznany, a etiopatologia ma jedynie charakter hipotetyczny. Niektórzy autorzy postulują wpływ zastoju żylnego związanego z brakiem ruchomości i wymuszoną pozycją kończyny19, podczas gdy inni zwracają uwagę na zaburzenia wazomotoryczne po udarze, związane z nieprawidłowym funkcjonowaniem autonomicznego układu nerwowego20.
Hipoteza autonomicznej dysregulacji układu naczyniowego, prowadzącej do zaburzeń filtracji i wchłaniania płynu międzykomórkowego, wydaje się prawdopodobna.
Terapia obrzęku ręki po udarze
Dotychczas poddano badaniom kilka form terapii mającej na celu zmniejszenie obrzęku ręki u pacjentów poudarowych. Wykaz różnych metod, opracowany przez zespół Thuy Anh Giang, znalazł się w przeglądzie piśmiennictwa poświęconego tej tematyce, który ukazał się w 2016 roku w "Hong Kong Journal of Occupational Therapy". Wynika z niego, że jedną z najskuteczniejszych form terapii obrzęku poudarowego ręki jest akupresura.
Hyun Sook Kang wraz z zespołem przebadała 56 pacjentów po udarze, u których występował obrzęk ręki. Pacjenci zostali przydzieleni do dwóch równolicznych grup: kontrolnej i eksperymentalnej. W grupie kontrolnej przeprowadzano sesje rehabilitacji, które w grupie eksperymentalnej uzupełniono o zabiegi akupresury.
Polegały one na uciskaniu punktów meridianowych w celu poprawy przepływu energii Qi i funkcjonowania narządów związanych z meridianami i konkretami punktami. Zabiegi akupresury trwały po 10 minut i były wykonywane przez 2 tygodnie.
U pacjentów dokonywano pomiaru różnych parametrów, w tym m.in. obrzęku w obszarze palców, zakresów ruchomości, siły chwytu i bólu. W odniesieniu do stanu ręki po udarze w grupie, w której stosowano terapię uzupełnioną o akupresurę, stwierdzono istotnie większą redukcję obrzęku palców oraz wzrost zakresu zgięcia i wyprostu nadgarstka.
Przytoczone wyniki są trudne do interpretacji z punktu widzenia medycyny Zachodu. Zakładając, że badanie zostało wykonane rzetelnie, można rozważyć uzupełnienie terapii pacjentów po udarze z obrzękami ręki o elementy akupresury.
Być może odpowiednio stosowane uciski w rzeczywistości oddziałują na układ autonomiczny, przyczyniając się do harmonizacji jego funkcji i poprawy kontroli nad przepływem płynów.
W terapii manualnej znane są odruchowe strefy neurolimfatyczne zwane punktami Chapmana, których uciskanie może również wpływać na poprawę przepływu chłonki w okolicy narządów wewnętrznych.
Opisane postępowanie wydaje się całkowicie nieszkodliwe, a potencjalnie może przynieść korzyść pacjentowi. Terapeuci zainteresowani pracą holistyczną mogą znaleźć opis konkretnych punktów akupresurowych w artykule źródłowym21.
Czym jest ręka onkologiczna?
Leczenie raka piersi staje się częstą przyczyną powikłań pod postacią obrzęków limfatycznych w obrębie kończyny górnej. Zgodnie z dostępnymi danymi naukowymi problem ten może dotyczyć nawet 25% leczonych kobiet22. Problemy z odpływem chłonki mogą pojawić się także po samej biopsji węzła wartowniczego23.
Obrzęk limfatyczny, gromadzący się w wyniku uszkodzeń związanych z zabiegiem onkologicznym, może być kontrolowany, jednak nie może zostać trwale wyleczony.
Obrzęk obejmuje zazwyczaj całą kończynę górną, natomiast jego rozmieszczenie może być różne. Obszar dystalny – ręka – może zostać oszczędzony. Jeżeli tak się nie dzieje, wzrost objętości płynu w obszarze ręki bywa szczególnie uciążliwy. Obrzęk gromadzi się głównie w obszarze grzbietu ręki oraz palców.
Ze względu na stosunkowo niewielką przestrzeń znaczna objętość płynu szybko wypełnia dostępne miejsce. Dochodzi do kompresji struktur naczyniowych i nerwowych oraz rozciągania skóry powodującego ból. Możliwość chwytu i wykonywania bardziej precyzyjnych czynności jest ograniczona. Pojawia się trudność w zginaniu i prostowaniu palców.
Istotnym problemem jest odprowadzanie obrzęku limfatycznego z obszaru ręki. Główny problem stanowi siła grawitacji, powodująca ciągły napływ limfy do dalszych obszarów kończyny górnej i jej zaleganie.
W celu usunięcia obrzęku podczas odprowadzania chłonki należy skierować ją w przeciwną stronę, opracowując najpierw odcinki proksymalne, stopniowo zbliżając się do dystalnych. Zgodnie z tą metodologią postępowania ręka zostaje opracowana jako ostatnia.
Należy również pamiętać o odpowiedniej prędkości odprowadzania chłonki, sile nacisku i nierozgrzewaniu tkanek. Zachowanie wszystkich warunków pracy z ręką objętą obrzękiem limfatycznym jest trudne.
Terapia jest żmudna, prowadzi do czasowego zmniejszenia obrzęku i musi być systematycznie ponawiana. Jest jednak niezbędna dla zachowania funkcji ręki i komfortu pacjentki. Nie bez znaczenia są również kwestie estetyczne i emocjonalne – związane z samą chorobą, jak i następstwami niezbędnego, lecz agresywnego leczenia.
Terapia ręki onkologicznej
Metody pielęgnacji i terapii kończyny objętej obrzękiem limfatycznym obejmują stosowanie bandażowania oraz rękawów uciskowych ograniczających odpływ chłonki do obszarów dystalnych, elementy drenażu limfatycznego, wykonywane przez samą pacjentkę, profesjonalną opiekę fizjoterapeuty posiadającego umiejętności wykonywania manualnego drenażu limfatycznego oraz zastosowanie urządzeń wykonujących mechaniczny drenaż limfatyczny.
Do chwili obecnej często pojawiają się wątpliwości wśród terapeutów i samych pacjentów odnośnie do skuteczności pneumatycznego drenażu limfatycznego wykonywanego za pomocą aparatury. Mogą być one uzasadnione ze względu na zmienioną architekturę węzłów i naczyń chłonnych w obszarach proksymalnych.
Pewnego wyjaśnienia dostarcza badanie przeprowadzone przez zespół Kristen E. Adams, opublikowane w 2010 roku w "Biomedical Optics Express"24. Było to badanie pilotażowe, mające na celu stwierdzenie skuteczności zastosowania mechanicznego odprowadzania chłonki u kobiet z obrzękami limfatycznymi po przebytej mastektomii.
Uczestniczyło w nim 9 kobiet: 3 w grupie kontrolnej i 6 w grupie badawczej. W celu określenia parametrów przepływu chłonki uczestniczkom podawano kontrast umożliwiający śledzenie drogi jej przepływu i akumulacji za pomocą kamery odbierającej obraz z zakresu bliskiej podczerwieni.
Następnie wykonywano procedurę drenażu pneumatycznego:
- 12 minut odprowadzania chłonki z obszaru klatki piersiowej,
- 18 minut przygotowawczego drenażu obejmującego odcinki bliższe kończyny górnej,
- 30 minut właściwego drenażu skoncentrowanego na odprowadzaniu chłonki z ręki, przedramienia i ramienia.
- Procedura lecznicza była wykonywana u wszystkich uczestniczek obustronnie.
Zgodnie z uzyskanymi wynikami u wszystkich zdrowych osób z grupy kontrolnej doszło do istotnego wzrostu prędkości i objętości odprowadzonej limfy. Taki sam efekt wystąpił po stronie przeciwnej do wykonanej mastektomii u kobiet z grupy badawczej. Także u 4 z 6 badanych kobiet w kończynie po stronie pozabiegowej zaobserwowano istotny statystycznie i klinicznie wzrost parametrów odprowadzania chłonki.
Ciekawych rezultatów dostarcza łączne zastosowanie kompleksowej fizjoterapii ręki oraz mechanicznej terapii pneumatycznej u pacjentek z obrzękami limfatycznymi po mastektomii. Taki sposób postępowania został opisany w badaniu zespołu Hulyi Uzkeser i opisany w 2013 roku w czasopiśmie "Breast Cancer"25.
W badaniu uczestniczyło 31 pacjentek, z których na podstawie randomizacji 15 przydzielono do grupy kontrolnej, a 16 – do grupy badawczej. W grupie kontrolnej wykonywano zabiegi obejmujące pielęgnację skóry, manualny drenaż limfatyczny, bandażowanie, zastosowanie rękawów uciskowych oraz ćwiczenia.
Grupa badawcza poddawana była tym samym zabiegom oraz dodatkowo aparaturowemu drenażowi kompresyjnemu trwającemu po 45 minut w trakcie każdej sesji. Leczenie obejmowało 15 sesji realizowanych przez 3 tygodnie.
Pomiarowi – przed terapią, bezpośrednio po jej zakończeniu oraz po 7 tygodniach od jej rozpoczęcia –poddawano objętości i obwody kończyn w ustalonych punktach (na wysokości stawów śródręczno-paliczkowych, nadgarstka, 10 cm powyżej i poniżej nadkłykcia bocznego) oraz wykonywano pomiary ultrasonograficzne.
W obydwu grupach uzyskano znaczną redukcję parametrów obrzęku. Po 7 tygodniach efekt terapii utrzymywał się, jednak był on niższy w przypadku grupy kontrolnej niż badawczej, u której utrzymał się na stałym poziomie.
Na podstawie przytoczonych badań można przypuszczać, że wspomaganie terapii przeciwobrzękowej w obszarze ręki i całej kończyny górnej u pacjentek po mastektomii za pomocą urządzeń kompresyjnych może być wartościowe oraz może przyczynić się do uzyskania trwalszych efektów.
Artykuł stanowi przegląd wybranych jednostek chorobowych z zakresu ortopedii, neurologii i onkologii (limfologii) dotyczących ręki. W niektórych przypadkach trudno jest wyizolować rękę od reszty kończyny górnej oraz od szerszego kontekstu terapeutycznego, dlatego został on również poruszony, gdzie było to uzasadnione.
Ze względu na kompleksowość obszaru, jakim jest ręka, coraz więcej terapeutów postanawia specjalizować się w pracy z tym obszarem ciała. Postępowanie takie jest celowe, jeżeli ręka będzie uznawana za część większego systemu, a terapia lokalna (na której skupiliśmy się w tym artykule) będzie częścią całościowego podejścia do problemu pacjenta.
- Faour-Martín O., Martín-Ferrero M.Á., Valverde-García J.A., Vega-Castrillo A., De La Red-Gallego M.Á. Rhizarthrosis fourth grade of eaton with hyperextension of the metacarpophalangeal joint, International Journal of Surgery Case Reports, 2013; Volume 4, Issue 10, pages 929-932.
- van der Oest M.J.W., Duraku L.S., Andrinopoulou E.R., Wouters R.M., Bierma-Zeinstra S.M.A., Selles, R.W., Zuidam J.M. The prevalence of radiographic thumb base osteoarthritis: a meta-analysis, Osteoarthritis and Cartilage, 2021; Volume 29, Issue 6, pages 785-792.
- Bani M.A., Arazpour M., Kashani R.V., Mousavi M.E., Hutchins S.W. Comparison of custom-made and prefabricated neoprene splinting in patients with the first carpometacarpal joint osteoarthritis. Disabil Rehabil Assist Technol. 2013, May; 8(3):232-7.
- Townley W.A., Baker R., Sheppard N., Grobbelaar A.O. Dupuytren’s contracture unfolded. BMJ. 2006; 332(7538):397-400. doi:10.1136/bmj.332.7538.397.
- Nobloch K., Hellweg M., Sorg H., Nedelka T. Focused electromagnetic high-energetic extracorporeal shockwave (ESWT) reduces pain levels in the nodular state of Dupuytren’s disease-a randomized controlled trial (DupuyShock). Lasers Med Sci 2021; Jan 23.
- Ashraf M.O., Devadoss V.G. Systematic review and meta-analysis on steroid injection therapy for de Quervain’s tenosynovitis in adults. Eur J Orthop Surg Traumatol. 2014 Feb; 24(2):149-57
- Sharma R., Aggarwal A.N., Bhatt S., Kumar S., Bhargava S.K. Outcome of low level lasers versus ultrasonic therapy in de Quervain’s tenosynovitis. Indian J Orthop. 2015 Sep-Oct; 49(5):542-8.
- Homayouni K., Zeynali L., Mianehsaz E. Comparison between kinesiotaping and physiotherapy in the treatment of de Quervain’s disease, J Musculoskelet Res, 16 (2013), pp. 1-6.
- Burton C., Chesterton L.S., Davenport G. Diagnosing and managing carpal tunnel syndrome in primary care, Br J Gen Pract. 2014; 64:262–263.
- Blumenthal S., Herskovitz S., Verghese J. Carpal tunnel syndrome in older adults, Muscle Nerve 2006; 34:78–83.
- Werner R.A., Andary M., Carpal tunnel syndrome: pathophysiology and clinical neurophysiology, Clin Neurophysiol. Volume 113, Issue 9, September 2002; pages 1373-1381.
- Zaralieva A., Georgiev G.P., Karabinov V., Iliev A., Aleksiev A. Physical Therapy and Rehabilitation Approaches in Patients with Carpal Tunnel Syndrome, Cureus 2020; 12(3):e7171. Published 2020 Mar 3; doi:10.7759/cureus.7171
- Rosenbaum P. L., Gracies J.M., Graham H.K., Miyasaki J.M., Naumann M., Russman B. et al. (2002). Prognosis for gross motor function in cerebral palsy: creation of motor development curves. JAMA 288, 1357–1363. doi: 10.1001/jama.288.11.1357
- Wissel J., Muller J., Dressnandt J., Heinen F., Naumann M., Topka H. et al. (2000). Management of spasticity associated pain with botulinum toxin A. J. Pain Symptom Manage. 20, 44–49. doi: 10.1016/S0885-3924(00)00146-9
- Graham H.K., Aoki K.R., Autti-Rämö I., Boyd R.N., Delgado M.R., Gaebler-Spira D.J. et al. (2000). Recommendations for the use of botulinum toxin type A in the management of cerebral palsy. Gait Posture 11, 67–79. doi: 10.1016/S0966-6362(99)00054-5
- Pavone V., Testa G., Restivo D.A. et al. Botulinum Toxin Treatment for Limb Spasticity in Childhood Cerebral Palsy. Front Pharmacol. 2016;7:29. Published 2016 Feb 19. doi:10.3389/fphar.2016.00029
- Gehan M. Abd El-Maksoud, Moussa A. Sharaf, Soheir S. Rezk-Allah, Efficacy of cold therapy on spasticity and hand function in children with cerebral palsy, Journal of Advanced Research, Volume 2, Issue 4, 2011, Pages 319-325.
- Geurts, A. C., Visschers, B. A., van Limbeek, J., & Ribbers, G. M. (2000). Systematic review of aetiology and treatment of poststroke hand oedema and shoulder-hand syndrome. Scandinavian Journal of Rehabilitation Medicine, 32(1), 4e10.
- Artzberger S.M., White J. Edema control. In G. Gillen (Ed.), Stroke rehabilitation: A function-based approach (pp. 307-500); St Louis: Elsevier 2011.
- Hesse S., Jahnke M., Ehret R., Mauritz K. Shoulderhand syndrome in hemiplegic patients: temperature, sympathetic skin responses, and nerve latencies of the affected and nonaffected upper extremity. Neurorehabilitation and Neural Repair, 1995, 9(4), 229e233.
- Kang H.S., Sok S.R., Kang J.S. Effects of Meridian acupressure for stroke patients in Korea. J Clin Nurs. 2009 Aug; 18(15):2145-52.
- Ozaslan C., Kuru B. Lymphedema after treatment of breast cancer. Am. J. Surg. 187 (2004), 69–72.
- Blanchard D.K., Donohue J.H., Reynolds C., Grant C. S. (2003) Relapse and morbidity in patients undergoing sentinel node biopsy alone or with axillary dissection for breast cancer. Arch. Surg. 138, 482–487
- Adams K.E., Rasmussen J.C., Darne C., Tan I.C., Aldrich M.B., Marshall M.V., Fife C.E., Maus E.A., Smith L.A., Guilloid R., Hoy S., Sevick-Muraca E.M. Direct evidence of lymphatic function improvement after advanced pneumatic compression device treatment of lymphedema. Biomed Opt Express 2010, Jul 15; 1(1):114-125.
- Uzkeser H., Karatay S., Erdemci B., Koc M., Senel K. Efficacy of manual lymphatic drainage and intermittent pneumatic compression pump use in the treatment of lymphedema after mastectomy: a randomized controlled trial. Breast Cancer 2015 May; 22(3):300-7.