Urazy mięśni i ścięgien w okolicy biodra i uda występują przede wszystkim w aktywnościach biegowych i skutkują długimi przerwami w korzystaniu z ruchu24,53,60. W określonych fazach podczas biegu mięśnie miednicy i uda są maksymalnie rozciągnięte lub maksymalnie napięte. Istnieje ryzyko uszkodzenia strukturalnego, gdy maksymalnie napięty mięsień zostanie rozciągnięty lub gdy maksymalnie rozciągnięty mięsień zostanie napięty przez skurcz koncentryczny. Z tego powodu częściej dochodzi do uszkodzenia mięśni dwustawowych66. Oprócz różnych mechanizmów urazów istnieje wiele czynników ryzyka, które sprzyjają uszkodzeniom mięśni lub ścięgien. Szczególnie podatne na urazy są mięśnie, których elastyczność została zmniejszona z powodu zmęczenia lub obecności tkanki bliznowatej3,41. Również niedostatecznie rozgrzane mięśnie lub zaburzenia równowagi mięśniowej prowadzą do wzrostu ryzyka kontuzji64. W przeciwieństwie do urazów mięśni całkowite zerwania ścięgien w okolicy bioder i ud są rzadkie. Wynika to z dużej wytrzymałości na rozciąganie zdrowego ścięgna, która jest mniej więcej cztery razy większa niż siła, jaką mogą rozwinąć omawiane tutaj mięśnie.
U nastolatków przyczep ścięgna jest bardziej podatny na zerwanie, co w rezultacie doprowadza do tak zwanego złamania awulsyjnego. U dorosłych zerwania mają częściej charakter śródścięgnisty lub lokalizują się na połączeniu mięśniowo-ścięgnistym. Wstępnie uszkodzone ścięgna mogą zrywać się przy średnim wysiłku sportowym lub nawet w trakcie codziennych aktywności. Strukturalne uszkodzenie tkanki ścięgien następuje wraz z wiekiem lub w wyniku mikrourazów. Wcześniejsze choroby, takie jak dna moczanowa, cukrzyca, nadczynność przytarczyc, choroby reumatyczne, choroby autoimmunologiczne czy uszkodzenia spowodowane lekami, np. po iniekcjach kortyzonu lub przyjmowaniu antybiotyków z grupy chinolonów, są wymieniane jako czynniki predysponujące do zwyrodnienia ścięgien1.
Niestety, często przeoczane są całkowite zerwania ścięgna w okolicy bioder i ud lub niedoszacowywany jest zakres urazu. Nieleczone zerwania ścięgien zwykle prowadzą do słabych wyników funkcjonalnych. Opóźniona diagnoza często stanowi problem terapeutyczny, gdyż częstość powikłań znacząco wzrasta w przypadku opóźnionej operacji.
Anatomia funkcjonalna chodu
Znajomość interakcji poszczególnych stawów i grup mięśni podczas ruchu jest podstawą leczenia zerwania ścięgien uda. Chodzenie i bieganie stanowią zintegrowaną sekwencję następujących po sobie ruchów. Służą one do przesunięcia środka ciężkości ciała ludzkiego do przodu przy zachowaniu równowagi62. Stawy kończyn dolnych podczas cyklu chodu przechodzą określony schemat ruchu, co wiąże się ze stabilnymi i niestabilnymi pozycjami stawów, zgodnie z wymogami chodu wyprostowanego. Mięśnie są zdolne do przyspieszania (skurczu koncentrycznego), spowalniania (skurczu ekscentrycznego) i stabilizacji określonej pozycji (skurczu izometrycznego). W ten sposób można kontrolować sekwencje ruchu34.
Na początku fazy podporowej łańcuchy stawowe muszą znajdować się w stabilnej pozycji, aby siły mogły zostać przeniesione na podłoże. Staw kolanowy jest wyprostowany w czasie kontaktu pięty z podłożem. Stabilność w stawie kolanowym w pełnym wyproście jest zapewniona przez napięcie więzadeł pobocznych (ligg. collateralia) i torebkę stawową. Dodatkową stabilizację dynamiczną uzyskuje się poprzez jednoczesną pracę prostowników i zginaczy kolana. W stawie biodrowym podczas zgięcia więzadła są rozluźnione, ale sytuacja jest stabilna ze względu na dobre prowadzenie kości udowej i napięte mięśnie biodra.
Podczas wykonywania kroku kolano zostaje zgięte do około 35 stopni. W tej fazie mięsień czworogłowy uda (m. quadriceps femoris) jest ekscentrycznie aktywny razem z mięśniami grupy kulszowo-goleniowej i ma działanie spowalniające. Podczas fazy podparcia biodro jest powoli prostowane, aby przygotować fazę wymachu. Miednica pochyla się lekko w kierunku kończyny przenoszonej, co jest znane jako fizjologiczne zjawisko Trendelenburga. Niewielkie opadanie miednicy jest kontrolowane przez hamującą aktywność mięśni odwodzicieli, głównie przez mięsień pośladkowy średni (m. gluteus medius) kończyny podporowej. Podczas fazy wymachu miednica zostaje ponownie uniesiona i zrotowana do przodu. Jednocześnie zgięcie w stawie biodrowym jest wyzwalane przez koncentryczną aktywność zginaczy biodra, głównie mięśnia lędźwiowego (m. psoas), biodrowego (m. iliacus) i prostego uda (m. rectus femoris). Pod koniec fazy wymachu ruch miednicy jest spowalniany przez ekscentryczny skurcz prostowników biodra, zwłaszcza mięśnia pośladkowego (m. gluteus) i grupy kulszowo-goleniowej.
Badanie kliniczne i diagnostyka zerwanych ścięgien w okolicy biodra i uda
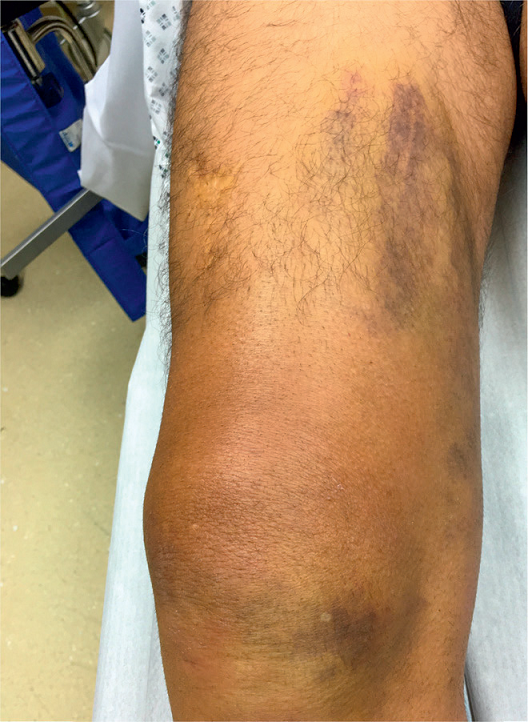
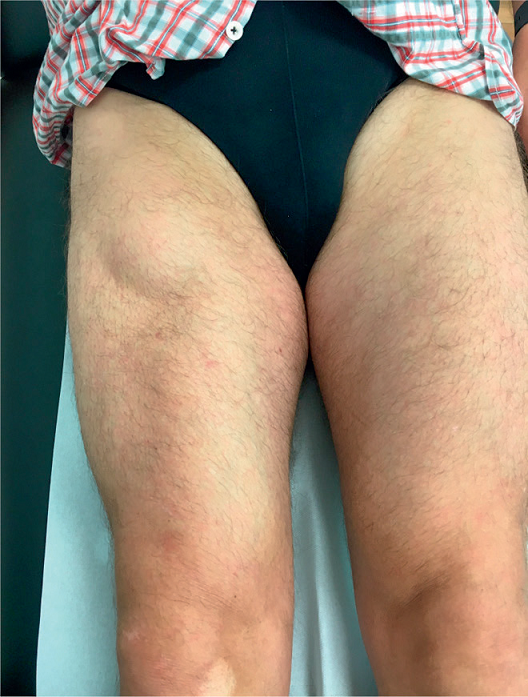
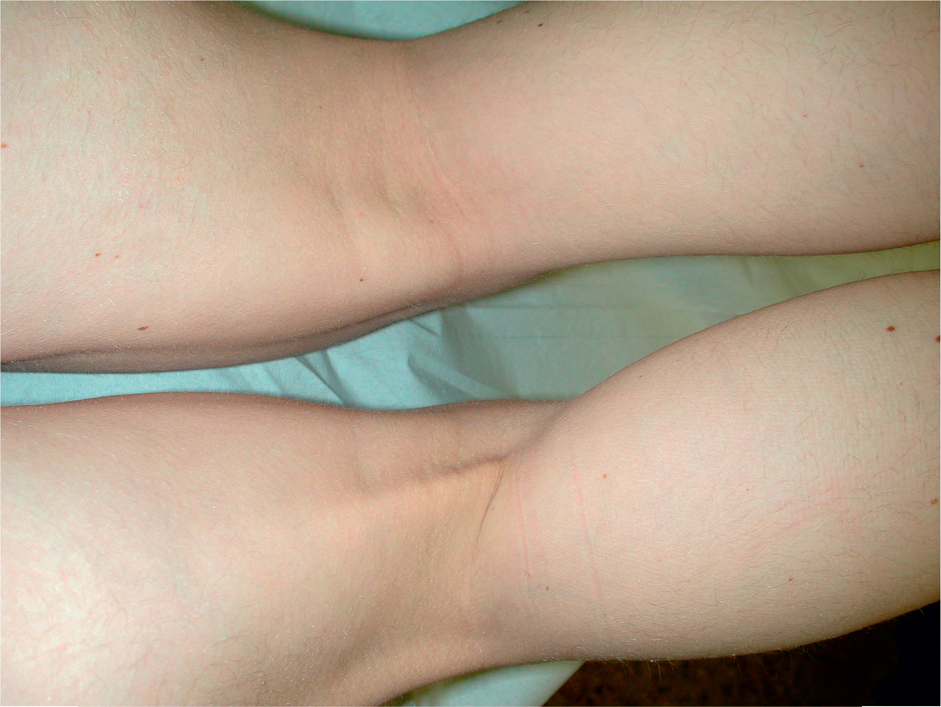
Celem badania klinicznego jest określenie ciężkości i lokalizacji urazu. Badanie rozpoczyna się od dokładnego wywiadu, obejmującego informacje odnośnie do okoliczności wystąpienia wypadku, poprzednich urazów i czynników ryzyka. W tym kontekście ważne jest opisanie przez pacjenta charakteru bólu. Nagły, ostry, ciągnący ból, któremu często towarzyszy dźwięk przypominający trzask, jest typowy dla zerwania ścięgien. Obraz kliniczny zależy od rozległości urazu. Podczas oględzin można stwierdzić wyraźny krwiak i widoczną różnicę w zarysie kończyny w przypadku całkowitego zerwania ścięgien lub mięśni (ryc. 1 i 2).
Ryc. 1. Typowy wygląd świeżego zerwania ścięgna z obrzękiem i wyraźnym krwiakiem na przykładzie zerwania ścięgna mięśnia czworogłowego.
Ryc. 2. Guz rzekomy i widoczna różnica w zarysie starego zerwania dystalnej części mięśnia prostego uda
Badanie palpacyjne pomaga dodatkowo rozpoznać występujące uszkodzenia. Wyczuwalna szczelina o szerokości większej niż palec jest pewnym znakiem całkowitego zerwania struktury. Zakres ruchu może pośrednio wskazywać na elastyczność mięśni. Kontrola stanu struktur musi uwzględniać porównanie obydwu stron. W przypadku urazów ostrych wartość informacyjna jest zmniejszona ze względu na ruchomość ograniczoną przez ból.
Test funkcjonalny przeprowadza się poprzez ogólne badanie siły przeciwko oporowi i porównując uzyskany wynik z wynikiem po przeciwnej stronie. W zależności od funkcjonalnego znaczenia mięśnia następuje mniej lub bardziej wyraźna utrata siły. Podobnie jak w przypadku pomiaru zakresu ruchu osłabienie siły związane z bólem wiąże się z ograniczoną wartością informacyjną opisanego elementu diagnostyki.
Ostateczne badanie układu nerwowo-naczyniowego służy wykluczeniu uszkodzenia pęczków struktur nerwowych i naczyniowych, zespołu ciasnoty lub zakrzepicy. Jeśli podejrzewa się uszkodzenie strukturalne, diagnostykę obrazową należy przeprowadzić szybko. Zdjęcie rentgenowskie jest niezbędne w celu wykluczenia uszkodzenia kości. Sonografia jest przydatnym instrumentem w rękach doświadczonego lekarza, a nawet przewyższa tomografię rezonansu magnetycznego w ocenie drobnych urazów17,54. Kolejnymi zaletami są łatwa dostępność, proste i wiarygodne określenie wielkości krwiaków i surowiczaków oraz niewielkie koszty oceny procesów gojenia13.
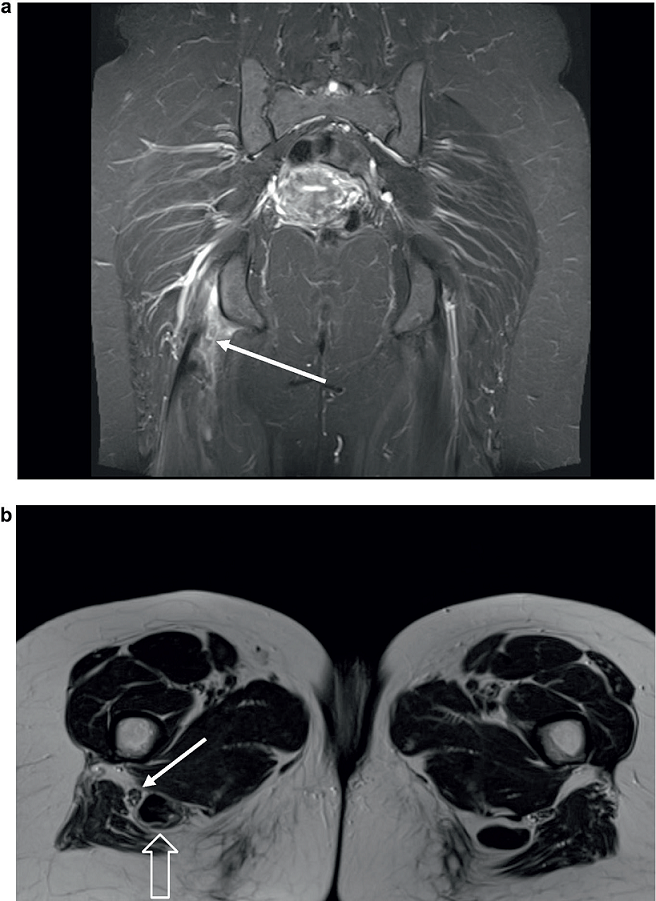
Ze względu na swoje istotne cechy rezonans magnetyczny jest zalecany jako kolejna metoda diagnostyczna67. Optymalny czas badania zawiera się w przedziale od 24 do 48 godzin po urazie, ponieważ bezpośrednio po nim nie można właściwie ocenić rozległości kontuzji32. Rezonans magnetyczny dostarcza wiarygodnych informacji o rozległości zerwania i retrakcji końca ścięgna. Główną zaletą w porównaniu z ultrasonografią jest to, że wszystkie struktury anatomiczne mogą być uchwycone przestrzennie dzięki różnym płaszczyznom przekrojów28. Jest to niezbędne przy planowaniu leczenia operacyjnego. Kolejną korzyścią jest dostępność wszystkich obrazów przekrojów w dniu wykonywania operacji (ryc. 3).
Ryc. 3a. Przekrój czołowy całkowitego zerwania mięśni grupy kulszowo-goleniowej z retrakcją końców ścięgien o 2 cm (strzałka). b. Przekrój osiowy przedstawia bliskie położenie nerwu kulszowego (strzałka gruba) z retrakcją brzuśca mięśniowego (strzałka cienka).
Zerwane ścięgna w okolicy uda i biodra
Klasyfikacja mięśni biodra i uda może odbywać się zarówno z topograficznego, jak i funkcjonalnego punktu widzenia, przy czym w artykule prezentujemy podejście funkcjonalne.
Zerwanie ścięgna - odwodziciele biodra
Zewnętrzne mięśnie bioder tworzą wielowarstwowy wachlarz mięśniowy, którego elementy zbiegają się od szerokiej płaszczyzny przyczepu początkowego na miednicy do stosunkowo niewielkiej strefy przyczepu końcowego na krętarzu. Powierzchownie położony jest mięsień naprężacz powięzi szerokiej (m. tensor fasciae latae) i mięsień pośladkowy wielki (m. gluteus maximus). W literaturze przedmiotu nie ma opisów przypadków zerwania ścięgien któregokolwiek z tych mięśni. Dzieje się tak ze względu na ich rozległy przyczep początkowy w okolicy kolca biodrowego i na zewnątrz talerza biodrowego miednicy, a także z powodu szerokiego ścięgna końcowego przechodzącego w pasmo biodrowo-piszczelowe (tractus iliotibialis), powięź szeroką (fascia lata) i kresę chropawą (linea aspera), które chronią je przed rozdarciem.
Mięsień pośladkowy średni (m. gluteus medius) i mały (m. gluteus minimus) położone są w głębi. Oba mięśnie mają przyczep początkowy na dużym obszarze na zewnątrz talerza biodrowego, ich włókna mięśniowe zbiegają się, tworząc silne płaskie ścięgno. Ścięgno mięśnia pośladkowego średniego przyczepia się do zewnętrznej strony szczytu krętarza większego (trochanter major). Pomiędzy ścięgnem a kością znajduje się kaletka. Ścięgno mięśnia pośladkowego małego przyczepia się na bocznej krawędzi przedniej powierzchni krętarza większego.
Z funkcjonalnego punktu widzenia drobne mięśnie pośladkowe są najważniejszymi stabilizatorami stawu biodrowego w fazie podporu i przenoszenia, z drugiej strony mają również istotny udział w rotacji miednicy25. Podczas chodzenia miednica po stronie kończyny przenoszonej jest chroniona przed opadaniem dzięki ekscentrycznej aktywności mięśni odwodzicieli kończyny podporowej. Podczas biegania aktywność jest prawie trzykrotnie większa34.
Podobieństwa morfologiczne i funkcjonalne między odwodzicielami biodra i barku doprowadziły do tego, że określa się je również jako "stożek rotatorów biodra"10. Urazowe zerwania przyczepu końcowego mięśnia pośladkowego średniego są rzadkie i ograniczone do opisów pojedynczych przypadków52. W przeciwieństwie do tego zerwania zwyrodnieniowe często występują w pobliżu przyczepu mięśnia pośladkowego średniego i małego w okolicy krętarza większego. Częstość częściowych i całkowitych zerwań mięśnia pośladkowego średniego i mięśnia pośladkowego małego wynosi około 25% u kobiet w wieku od 40 do 60 lat i około 10% u mężczyzn w tym samym wieku48. Wśród lekarzy oraz terapeutów rośnie świadomość częstości występowania i znaczenia zwyrodnieniowego zerwania ścięgna mięśnia pośladkowego średniego i małego.
W sytuacji tej patologii pacjenci skarżą się przede wszystkim na ból krętarza większego. W badaniu klinicznym stwierdza się miejscową tkliwość w okolicy przyczepu do krętarza większego oraz osłabienie odwodzenia biodra11. Objaw Trendelenburga i utykanie w mechanizmie Trendelenburga występują w połowie przypadków38. Dalsze badania obrazowe obejmują zdjęcie rentgenowskie i rezonans magnetyczny. MRI pozwala na klasyfikację zerwań14, jednak nie jest bardzo wiarygodny przy stawianiu dokładnej diagnozy38,61.
Częściowe zerwania leczy się przede wszystkim zachowawczo. Celem terapii we wczesnej fazie jest zmniejszenie bólu. Z powodzeniem stosuje się miejscowe zastrzyki z kortyzonu, NLPZ, terapię radialną falą uderzeniową o niskiej energii i redukcję obciążeń40. Po ustąpieniu bolesnej fazy następuje ukierunkowana terapia ruchowa z rozciąganiem pasma biodrowo-piszczelowego i mięśnia gruszkowatego (m. piriformis). Przede wszystkim ważne są aktywne ćwiczenia z oporem ze stopniowym zwiększaniem siły w celu wzmocnienia mięśni odwodzicieli. Wzmocnienie mięśni zapobiega obniżaniu się kończyny i wynikającemu z tego uwięźnięciu (zakleszczaniu się) struktur tkanek miękkich między krętarzem większym a pasmem biodrowo-piszczelowym w fazie podporowej. W przypadku objawów opornych na terapię lub niewydolności czynnościowej mięśni pośladkowych z dodatnim objawem Trendelenburga zaleca się zabieg operacyjny. Liczne badania wskazują na dobre wyniki kliniczne w zakresie poprawy wzorca chodu i siły odwodzenia po przeprowadzeniu otwartej lub artroskopowej refiksacji2,11,15,16,42. Dobre wyniki krótkoterminowe wymagają jednak potwierdzenia w dalszych badaniach klinicznych.
Zerwanie ścięgien w grupie zginaczy (grupie kulszowo-goleniowej)
Do grupy kulszowo-goleniowej należą mięśnie tylnego aspektu uda. Do grupy tej zalicza się mięsień dwugłowy uda (m. biceps femoris), półścięgnisty (m. semitendinosus) i półbłoniasty (m. semimembranosus). Mięsień półścięgnisty i ścięgno głowy długiej mięśnia dwugłowego mają wspólne ścięgno końcowe i obydwa posiadają przyczep początkowy na guzie kulszowym (tuber ischiadicum). Przyczep mięśnia półbłoniastego położony jest przednio-bocznie w stosunku do wymienionych poprzednio19. Ścięgno mięśnia dwugłowego przyczepia się na głowie kości strzałkowej (caput fibulae), a ścięgno mięśnia półścięgnistego na przyśrodkowej bliższej części kości piszczelowej. Ścięgno mięśnia półbłoniastego przyczepia się na tylnym przyśrodkowym plateau piszczeli i oddaje włókna, które wnikają do grzbietowej części torebki stawu kolanowego, do powięzi mięśnia podkolanowego (m. popliteus) i pod przyśrodkowe więzadło poboczne (lig. collaterale mediale).
W badaniach analizy chodu wykazano, że mięśnie grupy kulszowo-goleniowej pozostają napięte podczas całego ruchu. Maksymalne napięcie występuje w końcowej fazie przenoszenia i we wczesnej fazie podparcia, ponieważ wymach kończyny do przodu i do tyłu jest spowalniany w odpowiednich punktach zwrotnych przez ekscentryczne skurcze mięśni grupy kulszowo-goleniowej65. Aktywność mięśni wzrasta wraz ze wzrostem prędkości biegu.
Największe ryzyko urazu mięśni występuje pod koniec fazy przenoszenia, gdyż wyprost kolana i zgięcie biodra oznaczają, że mięśnie są maksymalnie rozciągnięte29. Typowym mechanizmem kontuzji jest również nagłe rozciągnięcie napiętych mięśni na skutek zgięcia w stawie biodrowym z wyprostowanym kolanem, co może się zdarzyć podczas startu z wody na nartach wodnych lub podczas biegu przez płotki27. Pacjenci zgłaszają ból w pośladku przypominający ukłucie nożem i uczucie "rozerwania". Skarżą się na zwiększony ból podczas siedzenia oraz często uczucie osłabienia i niestabilności w kolanie. Charakterystyczne jest przebarwienie pod wpływem powstałego krwiaka po stronie grzbietowej uda, które jednak może się pojawić dopiero po jednym lub dwóch dniach od urazu. Na początku pacjenci z trudem chodzą, bieganie jest zwykle niemożliwe i wiąże się z bólem przypominającym skurcz. Później odczuwany jest również ból przypominający rwę kulszową, ponieważ zdolność ślizgu nerwu kulszowego (n. ischiadicus) zostaje często ograniczona przez zrosty37.
Badanie kliniczne przeprowadza się w pozycji leżenia przodem z kolanem zgiętym pod kątem 90 stopni. Oprócz badania palpacyjnego w okolicy przyczepu na guzie kulszowym należy również ocenić stan napięcia ścięgien zginaczy w okolicy dołu podkolanowego (fossa poplitea). Napięcie ścięgien dobrze wskazuje na rozległość urazu, zwłaszcza w przypadku uszkodzenia mięśnia dwugłowego uda. Jeśli zerwanie jest całkowite, nie ma napięcia ścięgna, co określa się jako pozytywny objaw cięciwy (Bowstring sign) (ryc. 4)7. Testując siłę mięśni w rotacji wewnętrznej i zewnętrznej przeciwko oporowi, można wysnuć wnioski na temat uszkodzonych ścięgien. Konieczne jest specjalne badanie neurologiczne z badaniem nerwu kulszowego w celu wykluczenia towarzyszących uszkodzeń struktur nerwowych.
Ryc. 4. Brak napięcia ścięgien mięśnia dwugłowego uda i mięśnia półścięgnistego w prawym dole podkolanowym przy zgięciu pod kątem 90 stopni przy testowaniu przeciwko oporowi jako kliniczna oznaka całkowitego zerwania proksymalnego ścięgna (tzw. objaw cięciwy).
W przypadku urazów ścięgien, z wyjątkiem mięśnia dwugłowego, u sportowców rekreacyjnych można zastosować leczenie zachowawcze37. Podstawowe środki obejmują bandaże uciskowe i odciążenie za pomocą kul na przedramiona. Po krótkiej fazie odciążenia i ustąpieniu ostrych objawów bólowych można przejść do pełnego obciążenia. Należy unikać rozciągania ścięgien poprzez zginanie stawu biodrowego z wyprostowanym kolanem (siedzenie z wyprostowanym kolanem) i wchodzenia po schodach przez 4 tygodnie. Ćwiczenia czynne bez obciążenia i trening proprioceptywny można rozpocząć mniej więcej 4 tygodnie po urazie. Stopniowe zwiększanie obciążenia ma miejsce od 6. tygodnia, a przywrócenia pełnej zdolności do ćwiczeń można najczęściej oczekiwać po 12 tygodniach. Całkowite zerwanie mięśni grupy kulszowo-goleniowej prowadzi zwykle do znacznej utraty funkcji i poczucia niepewności podczas chodzenia4. Dotyczy to również przypadków urazu mięśnia dwugłowego uda (m. biceps femoris). Mięsień dwugłowy uda jest jedynym mięśniem, który przebiega ku bokowi i działa jako koaktywator mięśnia obszernego bocznego (m.vastuslateralis)31.
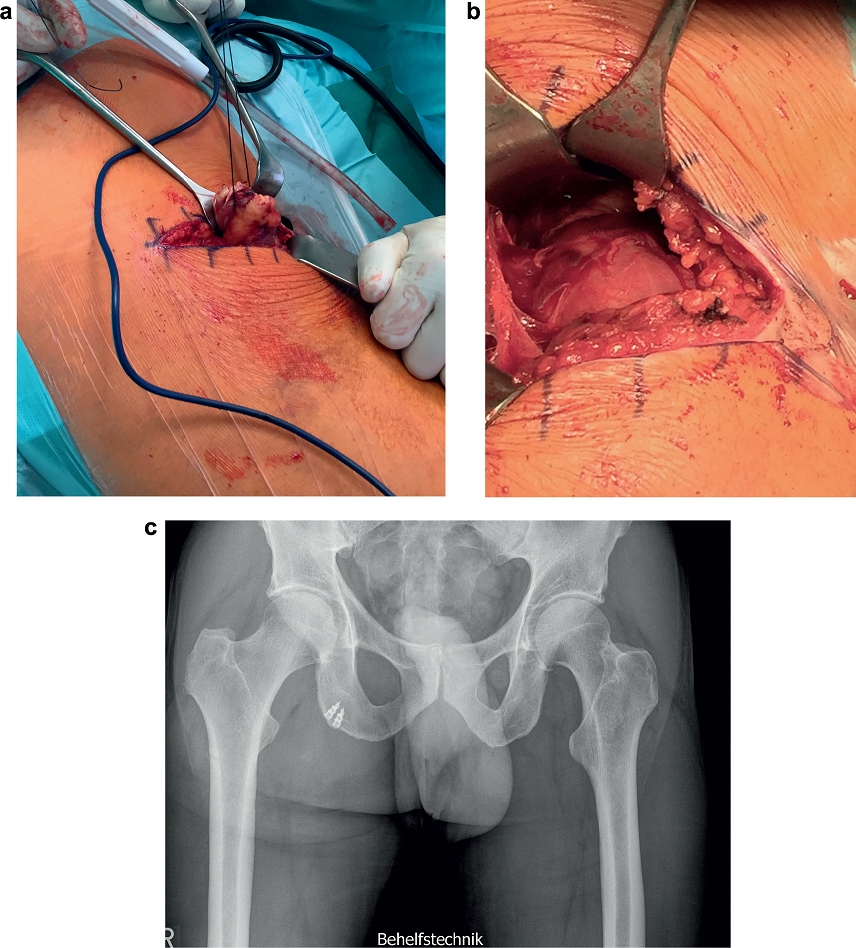
W obecnym piśmiennictwie w przypadku zerwania 2 lub nawet 3 ścięgien (ryc. 5) dostępna jest coraz większa liczba dowodów potwierdzających uzyskiwanie lepszych wyników czynnościowych przy wczesnej refiksacji (stabilizacji) chirurgicznej niż przy leczeniu zachowawczym6,9,33,36,37,50. W systematycznym przeglądzie Harris i in.27 na podstawie 300 przypadków rozerwania w obrębie bliższego końca grupy kulszowo-goleniowej wykazali, że po refiksacji chirurgicznej można osiągnąć znacznie lepsze wyniki w porównaniu z leczeniem zachowawczym pod względem parametrów wydolności w sporcie, siły, wytrzymałości i subiektywnej satysfakcji. Wczesna rekonstrukcja operacyjna przeprowadzona w ciągu 4 tygodni jest ważna dla dobrego wyniku funkcjonalnego. Opóźnione leczenie chirurgiczne zwiększa częstość powikłań, zwłaszcza ryzyko jatrogennego uszkodzenia nerwu kulszowego (n. ischiadicus). W nieskomplikowanych przypadkach dalsze leczenie można przeprowadzać bez ortezy. Przez 3 tygodnie kule przedramienne służą do odciążenia podczas chodzenia po równym podłożu, natomiast do 6. tygodnia po operacji są one stosowane podczas wchodzenia po schodach lub chodzenia na większe odległości.
Ryc. 5. Refiksacja całkowitego zerwania ścięgien mięśni grupy kulszowo-goleniowej. W pozycji leżenia przodem poszukuje się poprzecznego zagłębienia skóry i uszkodzenia powięzi przy dolnej krawędzi mięśnia pośladkowego wielkiego; ścięgno jest ponownie mocowane (a). Po umieszczeniu kotwicy w obszarze miejsca wprowadzenia refiksację przeprowadza się poprzez pociągnięcie za końce szwu (b). Ostateczna kontrola rentgenowska (c). Uwidocznienie położenia kotwicy.
Zerwanie ścięgien - grupa prostowników
Oderwania ścięgien grupy prostowników najczęściej dotyczą mięśnia prostego uda (m.rectusfemoris)43. Mięsień prosty uda jako mięsień dwustawowy przebiega nad stawem biodrowym i kolanowym, działając w ten sposób jako prostownik kolana i zginacz biodra. Powstaje on z głowy prostej (caput rectum) przyczepiającej się do kolca biodrowego oraz z głowy zagiętej (caput reflexum) odchodzącej od górnej krawędzi panewki i torebki stawu biodrowego20.
W przypadku całkowitego zerwania końce ścięgien mają tendencję do retrakcji. Największe ryzyko kontuzji występuje podczas sprintu ze względu na wymuszony skurcz koncentryczny w fazie przyspieszania kończyny przenoszonej. Wówczas mięsień jest maksymalnie rozciągany poprzez wyprost biodra i jednoczesne zgięcie w stawie kolanowym46. Ten sam mechanizm występuje w piłce nożnej podczas oddawania strzału i jest wzmocniony przez zewnętrzny opór podczas uderzenia. U nastolatków w wieku od 11 do 16 lat często dochodzi do naruszenia kości w strefie przyczepu.
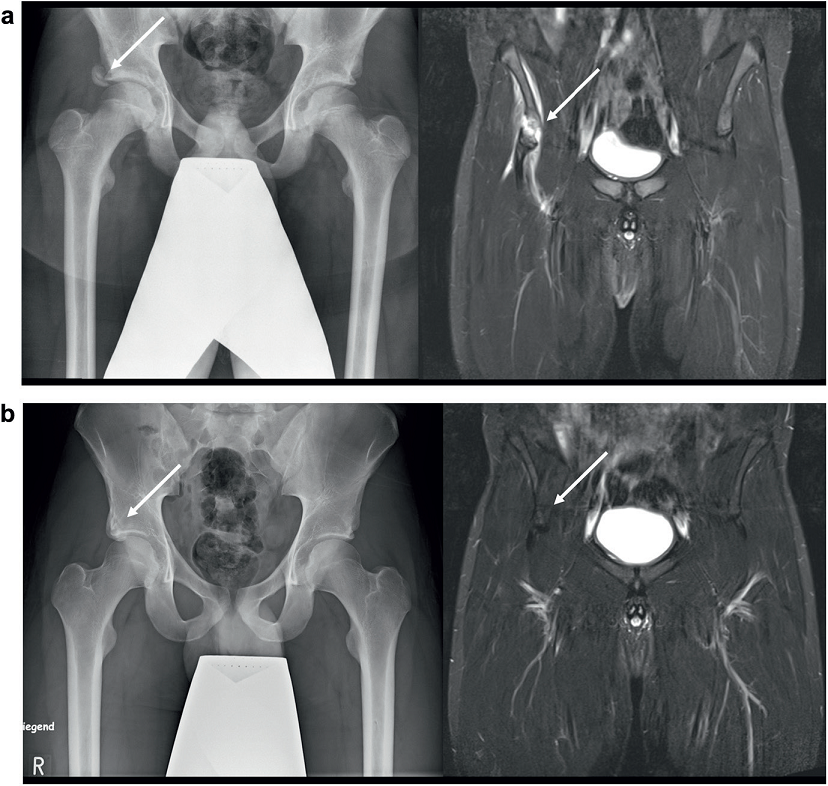
Oderwania wyrostka kostnego (apophysis) są zwykle leczone zachowawczo (ryc. 6). Chirurgiczna rekonstrukcja jest zalecana tylko w przypadku przemieszczenia fragmentu o więcej niż 2 cm63. To samo dotyczy całkowitego zerwania ścięgien u dorosłych. W przypadku leczenia zachowawczego powrót do sportu wyczynowego jest zwykle możliwy po 12 tygodniach21. W sytuacji całkowitego zerwania z retrakcją powyżej 2 cm zaleca się refiksację chirurgiczną22,30,57. Prowadzi to również do bardzo dobrych wyników funkcjonalnych przy całkowitym przywróceniu zdolności do ćwiczeń.
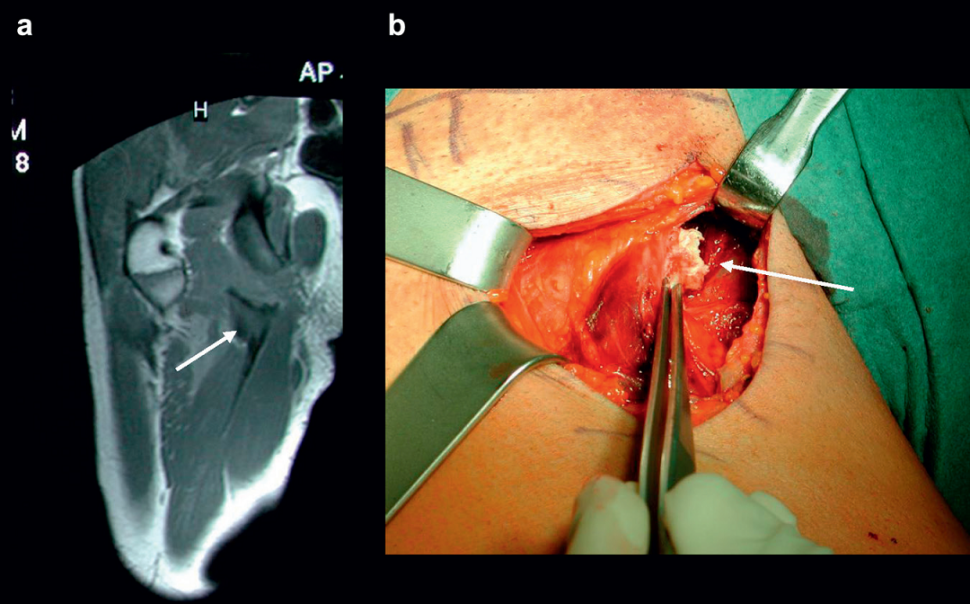
Ryc. 6. a. Oderwanie fragmentu wyrostka kostnego (apophysis) mięśnia prostego uda z przemieszczeniem fragmentu o 2 cm (strzałka). b. Przekrój czołowy z retrakcją końców ścięgien o 2 cm (strzałka). c. Obraz 2 lata po urazie (strzałka). d. Przekrój czołowy po wygojeniu, strzałka oznacza kolec biodrowy przedni dolny.
Cztery głowy mięśnia czworogłowego uda (mięsień prosty uda [m. rectus femoris], mięsień obszerny przyśrodkowy [m. vastus medialis], mięsień obszerny boczny [m. vastus lateralis], mięsień obszerny pośredni [m. vastus intermedius]) łączą się, tworząc wspólne ścięgno końcowe, które przyczepia się do górnej krawędzi rzepki. Więzadło rzepki (ligamentum patellae) rozciąga się od wierzchołka rzepki (apex patellae) jako przedłużenie ścięgna mięśnia czworogłowego, przyczepiając się do guzowatości piszczeli (tuberositas tibiae). Ścięgno mięśnia czworogłowego łączy się z troczkami rzepki (retinacula patellae) po obu jej stronach, które przyczepiają się do proksymalnej części kości piszczelowej i tworzą tak zwany rezerwowy aparat wyprostny. Podstawową funkcją mięśnia czworogłowego, wraz ze zginaczami, jest tłumienie sił, które występują, gdy pięta uderza o podłoże.
Ze względu na bardzo dużą wytrzymałość na rozciąganie wynoszącą ok. 300 N/mm2 do zerwania ścięgien dochodzi zwykle dopiero po wcześniejszym uszkodzeniu lub po operacjach prostowników8,23. Najczęstszym mechanizmem wypadków jest obciążenie ekscentryczne podczas zginania kolana, jak ma to miejsce np. bezpośrednio po kontakcie z podłożem, kiedy ruch środka ciężkości ciała w dół musi zostać zabsorbowany. Nagłe napięcie mięśni ud, które występuje podczas próby stabilizacji lub zapobiegnięcia upadkowi, może również prowadzić do zerwania. Pacjenci odczuwają nagły, ostry ból, a następnie mają wrażenie niepewności i niestabilności. Po urazie, w zależności od stopnia opuchlizny, można zaobserwować zagłębienie w tkankach; podczas badania palpacyjnego wyczuwalna jest szczelina. Jeżeli rezerwowy aparat wyprostny również ulegnie zerwaniu, występuje znaczne osłabienie wyprostu; jeśli jednak jest on nadal nienaruszony, możliwy jest wyprost przeciwko oporowi. Boczne zdjęcie rentgenowskie ukazuje niskie ustawienie rzepki, jeśli rozerwanie jest całkowite. W sytuacji gdy wyprost jest nadal możliwy, należy wykonać badanie rezonansem magnetycznym.
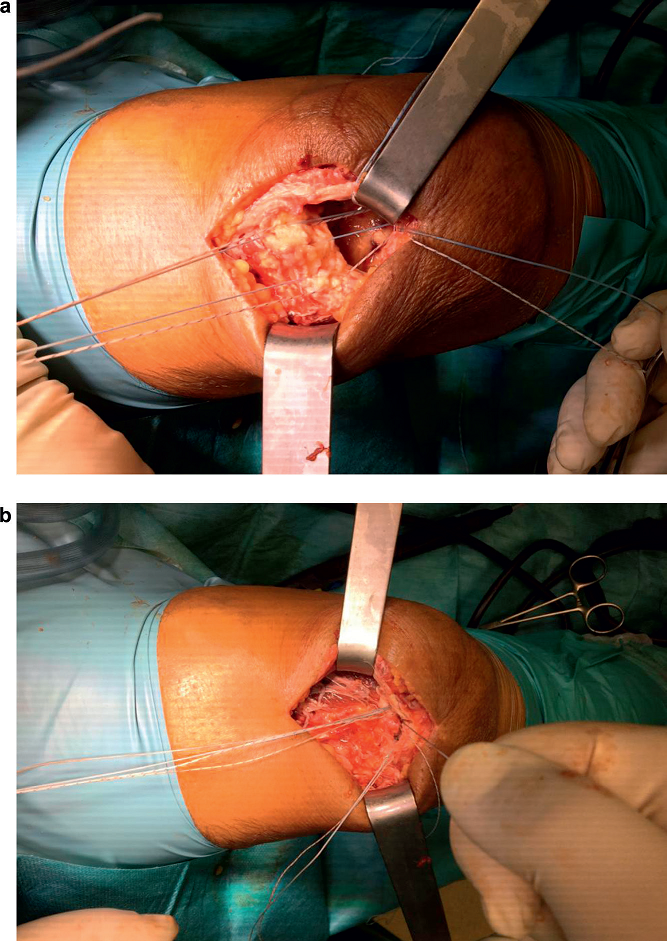
W przypadku całkowitego rozejścia się końców ścięgien zaleca się leczenie operacyjne. We własnej grupie pacjentów autorzy artykułu preferują stosowanie kotwic ze szwami ze względu na ich większą wytrzymałość na rozciąganie (ryc. 7)44. Dobre wyniki kliniczne daje refiksacja chirurgiczna, jednak po jej przeprowadzeniu najczęściej występuje niewielki deficyt zgięcia wynoszący 10–15 stopni oraz utrata siły podczas prostowania5,58. Opóźnione leczenie w przypadku całkowitych zerwań daje gorsze wyniki12,59.
Ryc. 7. Po założeniu kotwic kostnych i przymocowaniu końca ścięgna (a) repozycja ścięgna poprzez pociągnięcie za końce nici (b), a następnie zawiązanie nici.
Zerwanie ścięgien mięśni strony brzusznej okolicy biodra i grupy przywodzicieli
Mięśnie strony brzusznej stawu biodrowego obejmują mięsień biodrowo-lędźwiowy (m. iliopsoas) i mięśnie grupy przywodzicieli. Mięsień biodrowo-lędźwiowy składa się z dwóch części – brzuśca mięśnia lędźwiowego (m. psoas) i biodrowego (m. iliacus). Mięsień lędźwiowy odchodzi od bocznych powierzchni kręgów lędźwiowych oraz od wyrostków żebrowych (procc. costarii). Mięsień biodrowy rozpościera się na dużym obszarze dołu biodrowego (fossa iliaca). Wspólne ścięgno końcowe przyczepia się do krętarza mniejszego (trochanter minor). Sześć mięśni grupy przywodzicieli obejmuje mięsień grzebieniowy (m. pectineus), mięsień przywodziciel długi (m. adductor longus), mięsień smukły (m. gracilis) oraz znajdujący się w głębi mięsień przywodziciel krótki (m. adductor brevis) i przywodziciel wielki (m. adductor magnus). Mięsień przywodziciel długi odchodzi długim ścięgnem od przedniej części gałęzi górnej kości łonowej (ramus superior ossis pubis) i przyczepia się do środkowej jednej trzeciej kresy chropawej uda.
Główną funkcją mięśnia biodrowo-lędźwiowego jest zginanie biodra, przy czym mięsień lędźwiowy pomaga również w stabilizacji okolicy lędźwiowej. Mięśnie grupy przywodzicieli wraz z mięśniami głębokimi brzucha stabilizują miednicę podczas ruchu. W fazie podwójnego podporu przeciwdziałają rotacji miednicy. We wczesnej fazie przenoszenia działają synergistycznie z mięśniem biodrowo-lędźwiowym, a pod koniec tej fazy synergistycznie z mięśniami grupy kulszowo-goleniowej, kiedy zapobiegają zgięciu biodra poprzez skurcz ekscentryczny55. W fazie pojedynczego podporu przywodziciele wraz z odwodzicielami stabilizują staw biodrowy i zapobiegają przechylaniu miednicy.
Oderwanie mięśnia biodrowo-lędźwiowego jest bardzo rzadkie. Takie przypadki opisano tylko u osób starszych35,49. W przeciwieństwie do tego zerwania przywodzicieli są częstymi urazami w piłce nożnej, hokeju na lodzie, jeździe konnej i jeździe na łyżwach. Kontuzje grupy przywodzicieli zwykle występują podczas sprintu przez gwałtowny ruch kończyny przy napiętych mięśniach lub przez nagłą rotację podczas oddawania strzału w piłce nożnej. W przypadku całkowitego zerwania występuje wyczuwalna przerwa w ścięgnach i zmniejszenie siły przywodzenia. Najczęściej sytuacja ta dotyczy mięśnia przywodziciela długiego.
Terapia całkowitych zerwań jest kontrowersyjna. Opisy przypadków otwartych refiksacji w sytuacji zerwania okolic proksymalnych ścięgien wskazują na dobre wyniki u czołowych sportowców39,45,47. Jednak nawet przy leczeniu zachowawczym, pomimo retrakcji ścięgna, odnotowano bardzo dobre wyniki funkcjonalne, zwłaszcza u sportowców wyczynowych51,56. Zasada leczenia zachowawczego polega na unieruchomieniu lub odciążeniu chorego mięśnia. Orteza nie jest konieczna, w zależności od bólu możliwe jest natychmiastowe tolerowanie pełnego obciążenia. Ruch odwodzenia i przywodzenia w stawie biodrowym do 3. tygodnia jest ograniczony do 10-0-10 stopni, a do 6. tygodnia do 20-0-20 stopni, przy czym ruch prowadzony jest tylko biernie. Po 6 tygodniach od urazu zakres ruchu jest stopniowo zwiększany i rozpoczyna się trening. Okres gojenia i przywrócenia pełnej sprawności trwa co najmniej 12 tygodni.
Do autorów tej publikacji zgłosił się 15-letni pacjent z oderwaniem awulsyjnym ścięgna mięśnia przywodziciela długiego. Ze względu na przemieszczenie fragmentu o 2,5 cm, po wyczerpującej konsultacji z rodzicami, ścięgno poddano anatomicznej refiksacji za pomocą kotwicy kostnej (ryc. 8). Po 12 tygodniach ponownie uzyskano pełne obciążenie sportowe, jednak pacjent skarżył się na zaburzenia czucia i blizny w okolicy pachwiny.
Ryc. 8. a. Przekrój czołowy przedstawia przemieszczenie fragmentu (strzałka) w przypadku złamania awulsyjnego wywołanego siłą mięśnia przywodziciela długiego. b. Położenie śródoperacyjne, koniec ścięgna zaznaczony strzałką
Zerwanie ścięgien w okolicy biodra i uda - wnioski
Precyzyjna znajomość zakresu urazu i znaczenia funkcjonalnego uszkodzonego mięśnia jest warunkiem optymalnego leczenia zerwań ścięgien okolicy biodra i uda. Rozpoznanie opiera się na precyzyjnym i szczegółowym wywiadzie, dokładnym badaniu klinicznym i dalszej diagnostyce obrazowej. Rezonans magnetyczny wydaje się lepszą metodą od ultrasonografii w przypadku całkowitego zerwania ścięgien.
Podejście terapeutyczne obejmuje zarówno postępowanie zachowawcze, jak i chirurgiczne. Chociaż profilaktyka lekami zapobiegającymi kostnieniu heterotopowemu została udowodniona jedynie empirycznie, autorzy artykułu zalecają podawanie NLPZ przez dwa tygodnie. W zależności od retrakcji końców ścięgien, zerwania ścięgien mięśnia przywodziciela długiego i zerwania mięśnia pośladkowego średniego można zwykle leczyć zachowawczo, podczas gdy naderwanie mięśni grupy kulszowo-goleniowej, mięśnia prostego uda i ścięgna mięśnia czworogłowego najczęściej leczy się chirurgicznie. W przypadku całkowitego zerwania ścięgien ostateczną decyzję podejmuje się wspólnie z pacjentem po szczegółowej konsultacji dotyczącej przewidywanych ubytków czynnościowych w leczeniu zachowawczym oraz zagrożeń i ryzyka związanego z refiksacją chirurgiczną (tzw. wspólne podejmowanie decyzji [shared decision-making]). W przypadku operacyjnej stabilizacji stosowanie systemów kotwiczenia szwów stało się obecnie złotym standardem. Zastosowanie kotwic tytanowych jest korzystne ze względu na większą stabilność26. Umożliwiają one prostą, stabilną fiksację, dzięki której możliwe jest wczesne, funkcjonalne wdrożenie leczenia uzupełniającego.
Środki zapobiegawcze, takie jak rozgrzewka, rozciąganie i odpowiedni trening w celu uniknięcia zmęczenia, mogą znacznie zmniejszyć ryzyko kontuzji24.
Źródło: "Sports Orthopaedics and Traumatology", (Vol. 33, Issue 2, June 2017, p. 120–131), Wyd. ELSEVIER. Dziękujemy za zgodę na tłumaczenie i przedruk artykułu.
- M. Abate, C. Schiavone, V. Salini, I. Andia, Occurrence of tendon pathologies in metbolic disorders, Rheumatology (Oxford) 52 (4) (2013) 599–608.
- K. Alpaugh, B.J. Chilelli, S. Xu, S.D. Martin, Outcomes after primary open or endoscopic abductor tendon repair in the hip: a systematic review of the literature, Arthroscopy 31 (3) (2015) 530–540.
- A. Arnason, S.B. Sigurdsson, A. Gudmundsson, I. Holme, L. Engebretsen, R. Bahr, Risk factors for injuries in football, Am. J. Sports Med 32 (1 Suppl) (2004) 5S–16S.
- C.M. Askling, G. Koulouris, T. Saartok S. Werner, T.M. Best, Total proximal hamstring ruptures: clinical and MRI aspects including guidelines for postoperative rehabilitation, Knee Surg. Sports Traumatol, Arthrosc. 21 (3) (2013) 515–533.
- T. De Baere, B. Geulette, E. Manche, L. Barras, Functional results after surgical repair of quadriceps tendon rupture, Acta Orthop. Belg. 68 (2) (2002) 146–149.
- R.B. Blasier, L.G. Morawa, Complete rupture of the hamstring origin from water skiing injury, Am. J. Sports Med. 18 (4) (1990) 435–437.
- P. Birmingham, M. Müller, T. Wickiewicz, J. Cavanaugh, S. Rodeo, R. Warren, Functional outcome after repair of proximal hamstring avulsions, J. Bone Joint Surg. Am. 93 (19) (2011) 1819–1826.
- M. Bonnin, S. Lustig, D. Huten, Extensor tendon ruptures after total knee arthroplasty, Orthop. Traumatol. Surg. Res. 102 (1 Suppl) (2016) S21–S31.
- P.U. Brucker, A.B. Imhoff, A functional assessment after acute and chronic complete ruptures of the proximal hamstring tendons, Knee Surg. Sports Traumatol, Arthrosc. 13 (5) (2005) 411–418.
- Bunker, C.N. Esler, W.L. Leach, Rotator-cuff tear of the hip, J. Bone Joint Surg. Br. 79 (4) (1997) 618–620.
- Chandrasekaran, P. Lodhia, C. Gui, S.P. Vemula, T.J. Martin, B.G. Domb, Outcmes of open versus endoscopic repair of abductor muscle tears of the hip: a systematic review, Arthroscopy 31 (10) (2015) 2057–2067.
- V. Ciriello, S. Gudipati, T. Tosounidis, P.N. Soucacos, P.V. Giannoudis, Clinical oucomes after repair of quadriceps tendon rupture: a systematic review, Injury 43 (11) (2012) 1931–1938.
- D.A. Connell, M.E. Schneider-Kolsky, J.L. Hoving, F. Malara, R. Buchbinder, G.Koulouris, F. Burke, C. Bass, Longitudinal study comparing sonographic and MRI assessments of acute and healing hamstring injuries, Am. J. Roentgenol. 183 (4) (2004) 975–984.
- O. Cvitanic, G. Henzie, N. Skezas, J.Lyons, J. Minter, MRI diagnosis of tears of the hip abductor tendons (gluteus medius and gluteus minimus), Am. J.Roentgenol. 182 (1) (2004) 137–143.
- J.F. Davies, J.B. Stiehl, J.A. Davies, P.B. Geiger, Surgical treatment of hip abductor tendon tears, J. Bone Joint Surg. Am. 95 (15) (2013) 1420–1425.
- B.G. Domb, I. Botser, B.D. Giordano, Outcomes of endoscopic gluteus medius repair with minimum 2-year follow-up, Am. J. Sports Med. 41 (5) (2013) 988–997.
- F. Draghi, M. Zacchino, M. Canepari, P.Nucci, F. Alessandrino, Muscle injuries: ultrasound evaluation in the acute phase, J. Ultrasound 16 (4) (2013) 209–214.
- J. Ekstrand, M. Wald # en, M. Hägglund, Hamstring injuries have increased by 4% annually in men’s professional football, since 2001: a 13-year longitudinal analysis of the UEFA elite club injury study, Br, J. Sports Med. 50 (12) (2016) 731–737.
- J.M. Feucht, J.E. Plath, G. Seppel, S.Hinterwimmer, A.B. Imhoff, P.U.Brucker, Gross anatomical and dimensional characteristics of the proximal hamstring origin, Knee Surg. Sports Traumatol, Arthrosc. 23 (9) (2015) 2576–2582.
- H. Frick, H. Leonhardt, D. Starck In: Allgemeine Anatomie Spezielle Anatomie I, 1994, 4. Auflage, Georg Thieme Verlag Stuttgart, New York, S. 357.
- S.C. Gamradt, R.H. Brophy, R. Barnes, R.F. Warren, J.W. Thomas Byrd, B.T. Kelly, Nonoperative treatment for proximal avulsion of the rectus femoris in professional American football, Am. J. Sports Med. 37 (7) (2009) 1370–1374.
- V.V. Garcia, D.C. Duhrkop, R. Seijas, O. Ares, R. Cugat, Surgical treatment of proximal ruptures of the rectus femoris in professional soccer players, Arch. Orthop. Trauma Surg. 132 (3) (2012) 329–333.
- M.R. Garner, E. Gausden, M.B. Berkes, J.T. Nguyen, D.G. Lorich, Extensor mechanism injuries of the knee: demographic characteristics and comorbidities from a review of 726 patient records, J. Bone Joint Surg. Am. 97 (19) (2015) 1592–1596.
- W.E. Garrett Jr., Muscle strain injuries, Am. J. Sports Med. 24 (6 Suppl) (1996) S2–S8.
- F. Gottschalk, S. Kourosh, B. Leveau, The functional anatomy of tensor fasciae latae and gluteus medius and minimus, J. Anat. 166 (1989) 179–189.
- M.G. Hamming, M.J. Philippon, M.T. Rasmussen, F.P. Ferro, T.L. Turnbull, C.A. Trindade, R.F. LaPrade, C.A. Wijdicks, Structural properties of the intact proximal hamstring origin and evaluation of varying avulsion repair techniques: an in vitro biomechanical analysis, Am. J. Sports Med. (3) (2015) 721–728.
- J.D. Harris, M.J. Griesser, T.M. Best, T.J. Ellis, Treatment of proximal hamstring ruptures – a systematic review, Int. J. Sports Med. 32 (7) (2011) 490–495.
- D. Hayashi, B. Hamilton, A. Guermazi, R. de Villiers, M.D. Crema, F.W. Roemer, Traumatic injuries of thigh and calf muscles in athletes: role and clinical relevance of MR imaging and ultrasound, Insights Imaging 3 (6) (2012) 591–601.
- B.C. Heiderscheit, M.A. Sherry, A. Silder, E.S. Chumanov, D.G. Thelen, Hamstrinstrain injuries: recommendations for diagnosis, rehabilitation, and injury prevention, J, Orthop. Sports Phys. Ther. 40 (2) (2010) 67–81.
- T. Irmola, J.T. Heikkilä, S. Orava, J. Sarimo, Total proximal tendon avulsion of the rectus femoris muscle, Scand. J. Med. Sci. Sports 17 (4) (2007) 378–382.
- E. Kellis, V.B. Unnithan, Co-activation of vastus lateralis and biceps femoris muscles in pubertal children and adults, Eur. J. Appl. Physiol. Occup. Physiol. 79 (6) (1999) 504–511.
- G.M. Kerkhoffs, N. van Es, T. Wieldraaijer, I.N. Sierevelt, J. Ekstrand, C.N. van Dijk, Diagnosis and prognosis of acute hamstring injuries in athletes, Knee Surg. Sports Traumatol, Arthrosc. 21 (2) (2013) 500–509.
- K.E. Klingele, P.I. Sallay, Surgical repair of complete proximal hamstring tendon rupture, Am. J. Sports Med. 30 (5) (2002) 442–447.
- I.A. Kramers-de Quervain, E. Stüssi, A. Stacoff, Ganganalyse beim Gehen und Laufen, Schweizerische Zeitschrift für Sportmedizin und Sporttraumatologie 56 (2) (2008) 35–42.
- F.E. Lecouvet, X. Demondion, T. Leemrijse, B.C. Vande Berg, J.P. Devogelaer, J. Malghem, Spontaneous rupture of the distal iliopsoas tendon: clinical and imaging findings, with anatomic correlations, Eur. Radiol. 15 (11) (2005) 2341–2346.
- N. Lefevre, Y. Bohu, J.F. Naouri, S. Klouche, S. Herman, Returning to sports after surgical repair of acute proximal hamstring ruptures, Knee Surg. Sports Traumatol, Arthrosc. 21 (3) (2013) 534–539.
- L. Lempainen, I.J. Banke, K. Johansson, P.U. Brucker, J. Sarimo, S. Orava, A.B. Imhoff, Clinical principles in the management of hamstring injuries, Knee Surg. Sports Traumatol, Arthrosc. 23 (8) (2015) 2449–2456.
- D. Lindner, N. Shohat, I. Botser, G. Agar, B.G. Domb, Clinical presentation and imaging results of patients with symptomatic gluteus medius tears, J. Hip Preserv. Surg. 2 (3) (2015) 310–315.
- H. Lohrer, T. Nauc, Proximal adductor longus tendon tear in high level athletes. A report of three cases, Sportverl, Sportschad. 21 (2007) 190–194.
- D.P. Lustenberger, V.Y. Ng, T.M. Best, T.J. Ellis, Efficacy of treatment of trochanteric bursitis: a systematic review, Clin. J .Sport Med. 21 (5) (2011) 447–453.
- S.D. Mair, A.V. Seaber, R.R. Glisson, W.E. Garrett Jr., The role of fatigue in susceptibility to acute muscle strain injury, Am. J. Sports Med. 24 (2) (1996) 137–143.
- K.G. Makridis, M. Lequesne, H. Bard, P. Djian, Clinical and MRI results in 67 patients operated for gluteus medius and minimus tendon tears with a median follow-up of 4.6 years, Orthop. Traumatol. Surg. Res. 100 (8) (2014) 849–853.
- J. Mendiguchia, E. Alentorn-Geli, F. Idoate, G.D. Myer, Rectus femoris muscle injuries in football: a clinically relevant review of mechanisms of injury, risk factors and preventive strategies, Br, J. Sports Med. 47 (6) (2013) 359–366.
- M. Petri, A. Dratzidis, S. Brand, T. Calliess, C. Hurschler, C. Krettek, M. Jagodzinski, M. Ettinger, Suture anchor repair yields better biomechanical properties than transosseous sutures in ruptured quadriceps tendons, Knee Surg. Sports Traumatol, Arthrosc. 23 (4) (2015) 1039–1045.
- C. Quah, A. Cottam, J. Hutchinson, Surgical management of a completely avulsed adductor longus muscle in a professional equestrian rider, Case Rep. Orthop. (2014) 1–3.
- T. Rasul, D.A. Fischer, Primary repair of quadriceps tendon ruptures: results of treatment Abraham, Clin. Orthop. Relat. Res. 289 (1993) 205–207.
- L. Rizio, J.P. Salvo, M.R. Schurhoff, J.W. Uribe, Adductor longus rupture in professional football players: acute repair with suture anchors: a report of two cases, Am. J. Sports Med. 32 (1) (2004) 243–245.
- W.J. Robertson, M.J. Gardner, J.U. Barker, S. Boraiah, D.G. Lorich, B.T. Kelly, Anatomy and dimensions of the gluteus medius tendon insertion, Arthroscopy 24 (2) (2008) 130–136.
- M. Rubio, M. Rodriguez, S. Patnaik, P. Wang, Spontaneous iliopsoas tendon tear: A rare cause of hip pain in the elderly, Geriatr. Orthop. Surg. Rehabil. 7 (1) (2016) 30–32.
- J. Sarimo, L. Lempainen, K. Mattila, S. Orava, Complete proximal hamstring avulsions: a series of 41 patients with operative treatment, Am. J. Sports Med. 36 (6) (2008) 1110–1115.
- T.F. Schlegel, B.D. Bushnell, J. Godfrey, M. Boublik, Success of non-operative management of adductor longus tendon ruptures in national football league athletes, Am. J. Sports Med. 37 (7) (2009) 1394–1399.
- M.C. Stanton, M.D. Maloney, K.E. Dehaven, B.D. Giordano, Acute traumatic tear of gluteus medius and minimus tendons in a patient without antecedant peritrochanteric hip pain, Geriatr. Orthop. Surg. Rehabil. 3 (2) (2012) 84–88.
- K. Svensson, M. Alricsson, G. Karnebäck, T. Magounakis, S. Werner, Muscle injuries of the lower extremity: a comparison between young and old male elite soccer players, Knee Surg. Sports Traumatol, Arthrosc. 24 (7) (2016) 2293–2299.
- F. Tok, L. Ozçakar, M. De Muynck, M. Kara, G. Vanderstraeten, Musculoskeletal ultrasound for sports injuries, Eur. J. Phys. Rehabil. Med. 48 (4) (2012) 651–663.
- D.J. Tuite, P.J. Finegan, A.P. Saliaris, P.A. Renström, B. Donne, M. O’Brien, Anatomy of the proximal musculotendinous junction of the adductor longus muscle, Knee Surg. Sports Traumatol, Arthrosc. 6 (2) (1998) 134–137.
- P. Ueblacker, B. English, H.W. Müller-Wohlfahrt, Nonoperative treatment and return to play after complete proximal adductor avulsion in high-performance athletes, Knee Surg. Sports Traumatol .Arthrosc. 2015 Jun 9. [Epub ahead of print].
- P. Ueblacker, H.W. Müller-Wohlfahrt, S. Hinterwimmer, A.B. Imhoff, M.J. Feucht, Suture anchor repair of proximal rectus femoris avulsions in elite football players, Knee Surg. Sports Traumatol, Arthrosc. 23 (9) (2015), 2590-2504.
- M.A. Verdano, M. Zanelli, D. Aliani, T. Corsini, A. Pellegrini, F. Ceccarelli, Quadriceps tendon tear rupture in healthy patients treated with patellar drilling holes: clinical and ultrasonographic analysis after 36 months of follow-up, Muscles Ligaments Tendons J. 14 (2) (2014) 194–200.
- W.R. Volk, G.P. Yagnik, J.W. Uribe, Complications in brief: Quadriceps and patellar tendon tears, Clin. Orthop. Relat. Res. 472 (3) (2014) 1050–1057.
- P. Volpi, G. Melegati, D. Tornese, M. Bandi, Muscle strains in soccer: a five year survey of an italian major league team, Knee Surg. Sports Traumatol, Arthrosc. 12 (5) (2004) 482–485.
- D.J. Westacott, J.I. Minns, P. Foguet, The diagnostic accuracy of magnetic resonance imaging and ultrasonography in gluteal tendon tears – a systematic review, Hip Int. 21 (6) (2011) 637–745.
- L. Wiedmer, T. Langer, O. Knüsel, Gait pattern of patients with hip arthritis, Orthopäde 21 (1) (1992) 35–40.
- R. Wolf, Apophysenausriss. Standards der Sportmedizin, Deutsche Zeitschrift für Sportmedizin 51 (9) (2000) 305–306.
- S.S. Yeung, A.M. Suen, E.W. Yeung, A prospective cohort study of hamstring injuries in competitive sprinters: preseason muscle imbalance as a possible risk factor, Br. J. Sports Med. 43 (8) (2009) 589–594.
- B. Yu, R.M. Queen, A.N. Abbey, Y. Liu, C.T. Moorman, W.E. Garrett, Hamstring muscle kinematics and activation during overground sprinting, J. Biomech. 41 (15) (2008) 3121–3126.
- B. Zarins, J.V. Ciullo, Acute muscle and tendon injuries in athletes, Clin. Sports Med. 2 (1) (1983) 167–182.
- M.H. Zissen, G. Wallace, K.J. Stevens, M. Fredericson, C.F. Beaulieu, High hamstring tendinopathy: MRI and ultrasound imaging and therapeutic effi-cacy of percutaneous corticosteroid injection, Am. J. Roentgenol. 195 (4) (2010) 993–998.